基于灰度共生矩阵纹理特征分析鉴别胶质母细胞瘤与原发性中枢神经系统淋巴瘤
史云峰,钱丽霞,郭晓媛
(1.山西医科大学医学影像学系,山西 太原 030001;2.山西医科大学附属山西大医院磁共振科,山西 太原 030032)
胶质母细胞瘤(glioblastoma multiform, GBM)和原发性中枢神经系统淋巴瘤(primary central nervous system lymphoma, PCNSL)分别约占颅内肿瘤的15%和3%~6%[1-2],均为血供丰富、侵袭性强的肿瘤,难以鉴别。纹理分析可定量评价目标ROI内灰度空间变化和分布,相比于视觉分析,可更客观、详细地评估病变特征[3-4]。本研究探讨基于灰度共生矩阵(gray level co-occurrence matrix, GLCM)的纹理特征分析对GBM与PCNSL的鉴别诊断价值。
1 资料与方法
1.1 一般资料 回顾性分析2014年3月—2019年3月山西医科大学附属山西大医院收治的46例GBM患者(GBM组)和36例PCNSL患者(PCNSL组)的术前影像学资料。GBM组男27例,女19例,年龄39~74岁,平均(57.3±10.6)岁。PCNSL组男21例,女15例,年龄21~73岁,平均(54.4±13.6)岁,病理类型均为弥漫性大B细胞淋巴瘤,且均无自身免疫缺陷疾病。纳入标准:①经病理确诊为GBM或PCNSL;②在本院接受平扫+增强MR扫描,图像质量佳;③MR检查前患者均未接受激素、手术、放射及化学治疗等。
1.2 仪器与方法 采用Siemens Avanto 1.5T MR机。先行T1WI、T2WI平扫,采用SE序列采集轴位T1WI(TR 1 650 ms, TE 10 ms)及轴位T2WI(TR 3 500 ms,TE 85 ms);以单次激发SE-EPI序列采集DWI图像,b=0、1 000 s/mm2,TR 4 000 ms,TE 106 ms,由设备自带后处理软件分析DWI数据后生成ADC图;扫描层厚均为5.5 mm,层间距1.3 mm,FOV 230 mm×230 mm。之后以2~3 ml/s流率按剂量0.1 mmol/kg体质量经肘静脉注入钆喷酸葡胺行增强扫描,参数:TR 2 000 ms,TE 42 ms,层厚5.5 mm,层间距1.3 mm,FOV 230 mm×230 mm。
1.3 图像分析 以“DICOM”格式从工作站导出所有图像,调整窗宽、窗位。选择增强T1WI及ADC图像行纹理特征分析。以增强T1WI为参照,在图像显示病灶最大层面,通过MaZda软件(Version 4.6),避开病灶周围水肿区域、血管、增强的脑膜及静脉窦等,沿病灶边缘手动勾画ROI(包括坏死、囊变及出血区,图1、2),软件自动生成包括角二次矩能量(简称能量)、熵、对比、相关及逆差矩在内的多项纹理特征参数;重复3次,以平均值为最终结果。
1.4 统计学分析 采用SPSS 20.0统计分析软件。正态分布计量资料以±s表示,采用独立样本t检验比较组间差异;以中位数(上下四分位数)表示偏态分布资料,采用Mann-WhitneyU检验进行比较。以差异有统计学意义的纹理参数作为自变量,GBM和PCNSL为分类变量,采用enter法选择变量,建立Logistic回归模型,绘制ROC曲线并计算AUC,评估增强T1WI及ADC图像的纹理参数及Logistic回归模型对GBM与PCNSL的鉴别诊断效能。P<0.05为差异有统计学意义。
2 结果
GBM组与PCNSL组间增强T1WI纹理特征参数中能量、对比、相关、熵,ADC图像纹理特征参数中能量、相关、熵差异均有统计学意义(P均<0.01),见表1、2。将上述组间差异有统计学意义的参数纳入二元Logistic回归分析,得到Logistic回归模型:p=1/(1+e-x),其中x=13.29+82.52×能量(增强T1WI)-7.04×相关(增强T1WI)-3.25×熵(增强T1WI)-7.15×相关(ADC)。 ROC曲线结果显示,增强T1WI纹理参数中,熵的约登指数最大,为0.56,鉴别GBM与PCNSL的效能最强,AUC为0.81,敏感度为78.26%,特异度为77.78%;ADC图像纹理参数中亦以熵的约登指数最大,为0.38,鉴别GBM与PCNSL的效能最强,AUC为0.72,敏感度为56.52%,特异度为80.56%;Logistic回归模型鉴别诊断GBM与PCNSL的AUC为0.92,敏感度为91.30%,特异度为83.33%。见表3、图3。
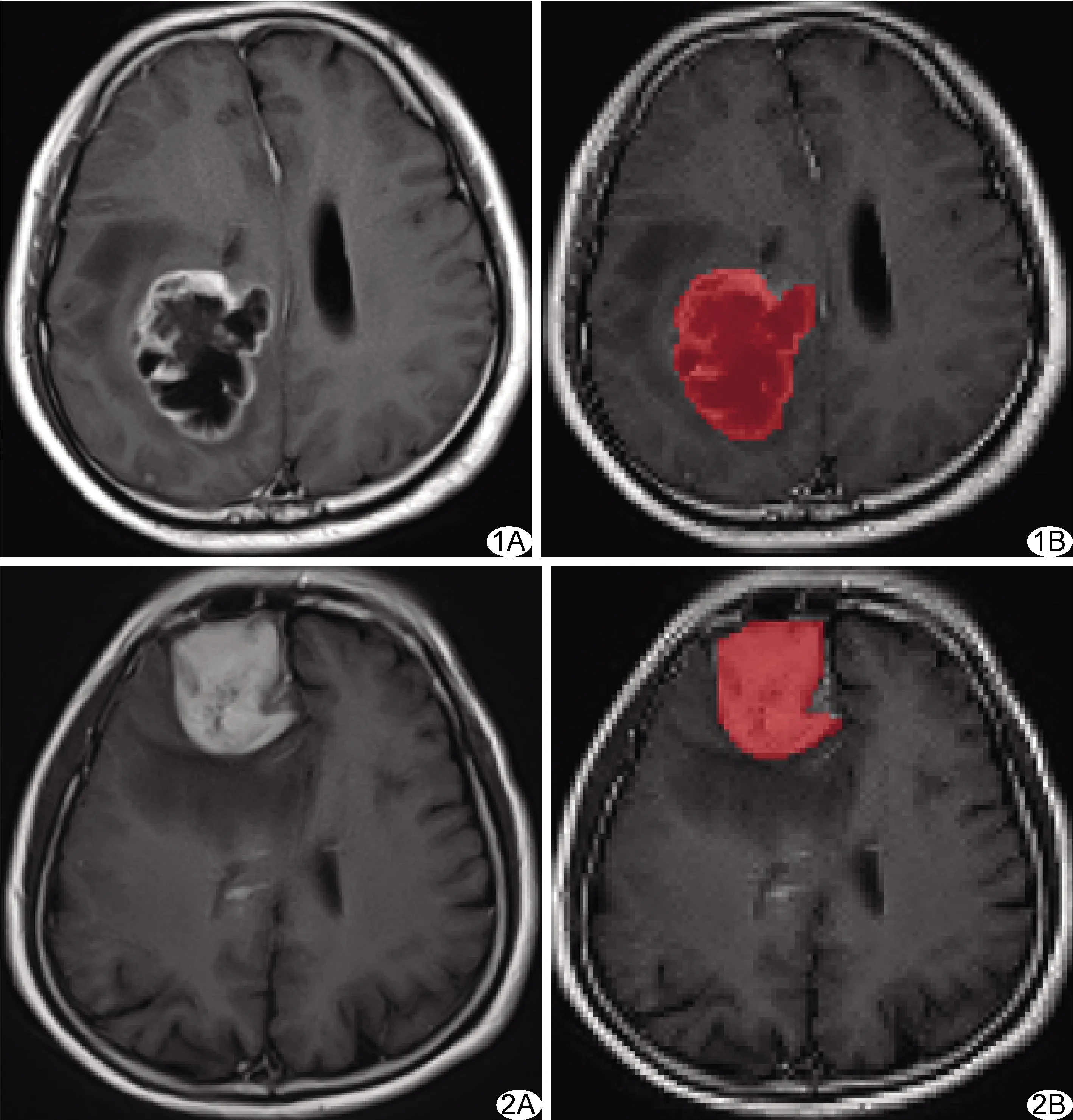
图1 患者男,55岁,GBM A.轴位增强T1WI; B.手动勾画ROI 图2 患者女,64岁,PCNSL A.轴位增强T1WI; B.手动勾画ROI
3 讨论
GBM是恶性程度最高的胶质瘤,多发生于50岁以上的中老年人。PCNSL是少见且高度恶性的非霍奇金淋巴瘤,发病高峰年龄为40~50岁。对于GBM,首选治疗方法为最大限度将肿瘤安全切除后给予替莫唑胺化学治疗并辅助放射治疗[5];而对PCNSL,手术对预后的改善并不明显,还可能增加神经功能损害风险[6],通常首先采用氨甲蝶呤为主的化学治疗联合放射治疗[7],但缓解持续时间通常较短。明确鉴别诊断对于选择治疗方案意义重大。
GBM和PCNSL的生物学行为使其具有不同的影像学特征,但存在部分重叠,常规MRI难以区分。GBM血供丰富,肿瘤进展快,增强扫描多呈不规则花环样强化;实性、无明显坏死者可与PCNSL相似。PCNSL T1WI可表现为脑灰质样等信号或稍低信号,T2WI等信号或稍高信号,类似脑膜瘤样脑灰质信号,增强扫描可见握拳征、开环征、脐凹征、棘征及蝶翼征等;病灶中心出现囊变、坏死时,可与GBM相似。
纹理分析技术不依赖影像学医师的经验及主观判断,可全方位、客观、稳定及无创分析肿瘤固有的生物学特征,检测人类视觉系统无法观察到的脑肿瘤异质性变化。纹理参数是病灶的固有属性特征,可反映组织生理病理变化;不同病灶的病理类型不同,即便影像学表现相似,其纹理特征也存在差异[8-9]。随着纹理分析技术的推广及应用,目前基于MRI的纹理分析已用于颅内肿瘤分级[10]、鉴别诊断[11]和治疗后效果评估[12]等方面。GLCM为灰度级空间依赖矩阵,除反映图像灰度信息外,还可表达特定像素值在给定空间关系中的出现频率。本研究基于GBM与PSNCL肿瘤生物学行为及病理类型不同,尝试通过纹理分析技术加以鉴别。本研究增强T1WI中的能量、熵、对比、相关,ADC图像中的能量、相关、熵组间差异有统计学意义,提示增强T1WI能提取更多纹理特征信息。增强T1WI中能量和熵对鉴别诊断GBM与PSNCL的AUC分别为0.76、0.81,均高于ADC图像能量和熵的AUC(分别为0.69、0.72),可能是因为增强图像具有灌注及强化特征等信息,且组织间对比度更为明显。

表1 2组增强T1WI纹理特征参数比较

表2 2组ADC纹理特征参数比较
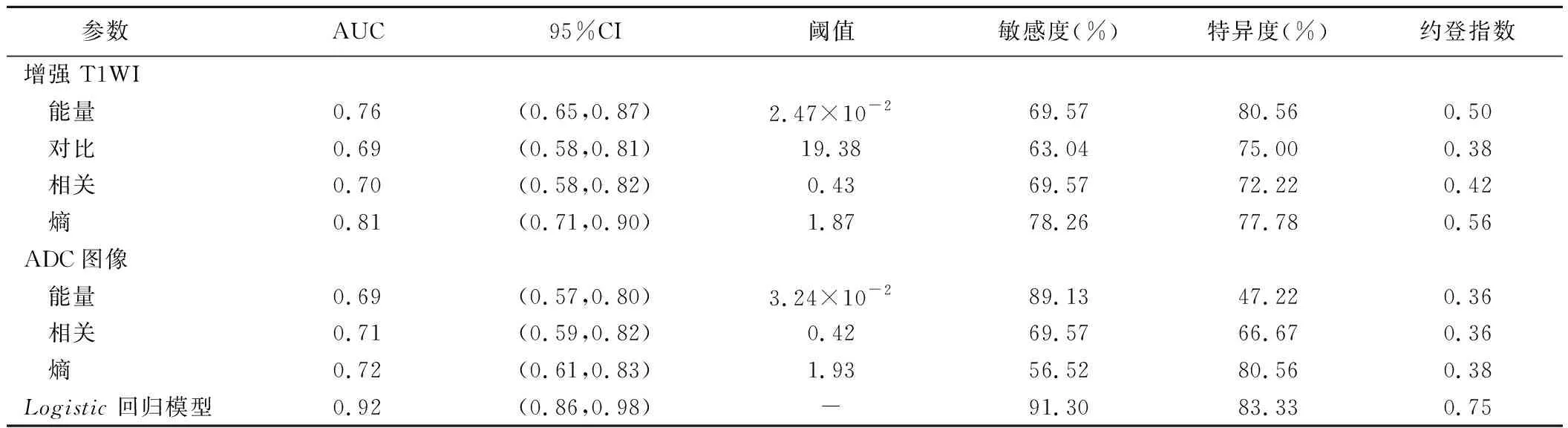
表3 纹理参数及回归模型鉴别诊断GBM与PCNSL的ROC曲线结果

图3 纹理参数及回归模型鉴别诊断GBM与PCNSL的ROC曲线
能量反映图像灰度均匀分布度及纹理粗细度,灰度分布均匀、规则且颗粒较粗时,能量值大,反之则小。对比反映相邻像素灰度反差程度和纹理沟纹深浅度,纹理沟纹越深,其值越大。相关用于评估图像纹理局部变化,反映图像中局部纹理灰度的相似性和一致性,即纹理趋势。熵代表灰度分布的不可预测性及复杂性,熵值较大意味着其内元素分布比较分散、紊乱,提示肿瘤内纹理信息越复杂。本研究增强T1WI纹理参数中,GBM组的能量小于PCNSL组,GBM组的对比、相关、熵大于PCNSL组;ADC图像纹理参数中,GBM组的能量小于PCNSL组,GBM组的相关、熵大于PCNSL组,多数纹理参数值并未随图像采集方式改变而改变。GBM常发生囊变、坏死及出血,灰度分布不均匀、反差大,且纹理相对紊乱、复杂,恶性度高、异质性强;而PCNSL纹理相对均质,异质性较低;故2种肿瘤的相关纹理参数存在差异。
本研究中以单项纹理参数鉴别GBM与PCNSL的敏感度及特异度均不高,以增强T1WI中熵的AUC最大,为0.81,提示纹理参数熵可提供较多诊断信息,与王敏红等[13]研究结果一致;基于各项纹理参数的Logistic回归模型鉴别2种肿瘤的诊断效能均高于各单项纹理参数,鉴别诊断GBM与PCNSL的AUC为0.92,敏感度为91.30%,特异度为83.33%。
本研究的主要不足之处:①仅分析肿块最大层面图像,未纳入肿块全部信息;②样本量偏小,可能存在选择偏倚;③采用手动勾画ROI,而部分肿块边界难以界定,影响到勾画的准确性,可能使纹理参数测量值存在偏差;④仅针对增强T1WI及ADC图像进行分析,未分析其他序列的MR图像;⑤应用对比剂, 增加了不良反应风险。
综上所述,基于GLCM的纹理特征分析有助于鉴别诊断GBM与PCNSL。随着人工智能的开发及应用,纹理分析技术的价值将进一步得到体现。