腹腔镜胰十二指肠切除术单中心73 例经验总结
林先盛,黄强,杨骥,孙毅,王程
(中国科学技术大学附属第一医院/安徽省立医院 普外胆胰外科/肝胆胰安徽省重点实验室,安徽 合肥 230001)
自 从Whipple 等[1]最早于1935 年 报 道 世 界上的第1 例胰十二指肠切除术(pancreaticoduodenectomy,PD)以来,作为腹部外科最大的手术之一,PD是胰头占位、胆管下段占位以及壶腹部周围肿瘤的标准外科手术术式,人们对于P D 技术的探索一直都未停止,随着医疗技术的进步,目前在大的胰腺外科中心PD 术后的病死率控制在2%以内,致命性的并发症发生率相对较低[2-4]。1994年Gagner等[5]报道腹腔镜下的PD术(LPD),由于初期开展LPD在手术时间与并发症等方面的原因,其发展缓慢[6];2007年印度Palanivelu等[7]报道42例LPD获得良好的手术效果,自此进入了LPD快速发展期;国内卢榜裕等[8]于2003年报道LPD,2012年国内各大胰腺外科中心逐渐开展LPD[9-11],中国科学技术大学附属第一医院自2016年1月开展LPD以来[12-13],目前共完成73例。本文总结改组LPD手术经验,分析其安全性和可行性。
1 资料与方法
1.1 一般资料
自2016年1月—2018年12月,中国科学技术大学附属第一医院胆胰外科共完成PD手术300例,其中,实施LPD 73 例。期间完成的腹腔镜辅助PD(LAPD)与中转开腹病例均未被纳入分析 。所有纳入分析的73例病例资料完整:男31例,女42 例;平均年龄(55.6 6±11.70)岁(年龄>70岁5例);所有患者术前影像学诊断明确为壶腹部周围占位,CT检查无肿瘤远处转移,无手术禁忌证。术前合并黄疸48例,CA19-9增高患者47例(64.4%),有上腹部手术史7例,合并心、脑血管疾病(高血压、冠心病、脑梗塞)11例。患者术前资料见表1。
1.2 手术流程
麻醉满意后,仰卧位,常规消毒铺巾,脐下置入10 mm Trocar作观察孔,于左侧及右侧锁骨中线脐上作12 mm Trocar孔,左右侧腋前线肋缘下分别置入5 mm Trocar孔,其中左侧锁骨中线脐上点为主操作孔,其余三孔作为辅操作孔。超声刀离断胃结肠韧带进入大网膜囊,分别向左侧至结肠脾区,右侧至结肠肝区,完整显露胰腺。提起胃窦部下缘,分离并夹闭胃网膜右血管。作Kocher切口,完整的游离十二指肠及胰头部,充分显露右侧肾前筋膜。于左肾静脉起始部上方分离出肠系膜上动脉(SMA)根部,清扫第16组淋巴结。解剖胰颈部下缘,显露肠系膜上静脉(SMV),并建立胰后隧道。游离胃大弯和胃小弯,用直线切割闭合器离断胃,清扫第7组淋巴结,显露腹腔干和肝总动脉,清扫第8组淋巴结,进一步裸化肝十二指肠韧带并清扫第12组淋巴结;裸化胃十二指肠动脉和胃右动脉;于SMV左侧离断胰腺;距Treiz韧带15 cm处用超声刀沿肠管边缘离断其系膜及Treiz韧带,用直线切割闭合器离断空肠;将胃窦和胰头向右牵拉暴露门静脉/SMV右侧壁和胰腺钩突系膜,循SMA右侧完整切除胰腺钩突及其系膜;分离胆囊三角并离断肝总管,完整切除标本。消化道重建:全腔镜下消化道Child 方法重建,重建顺序为胰肠吻合(胰管空肠黏膜对黏膜吻合,可吸收缝线,双层法,吻合口常规放置支撑管)、胆肠吻合(间断缝合)、胃肠吻合(倒刺线缝合)。胰肠吻合均采用4-0 Prolene线进行胰管空肠黏膜吻合,常规置入胰管支架。胆肠吻合采用4-0 Prolene线间断缝合胆肠吻合口后壁,倒刺线连续单层缝合胆肠吻合口前壁。胃肠吻合采用直线切割闭合器吻合(图1)。
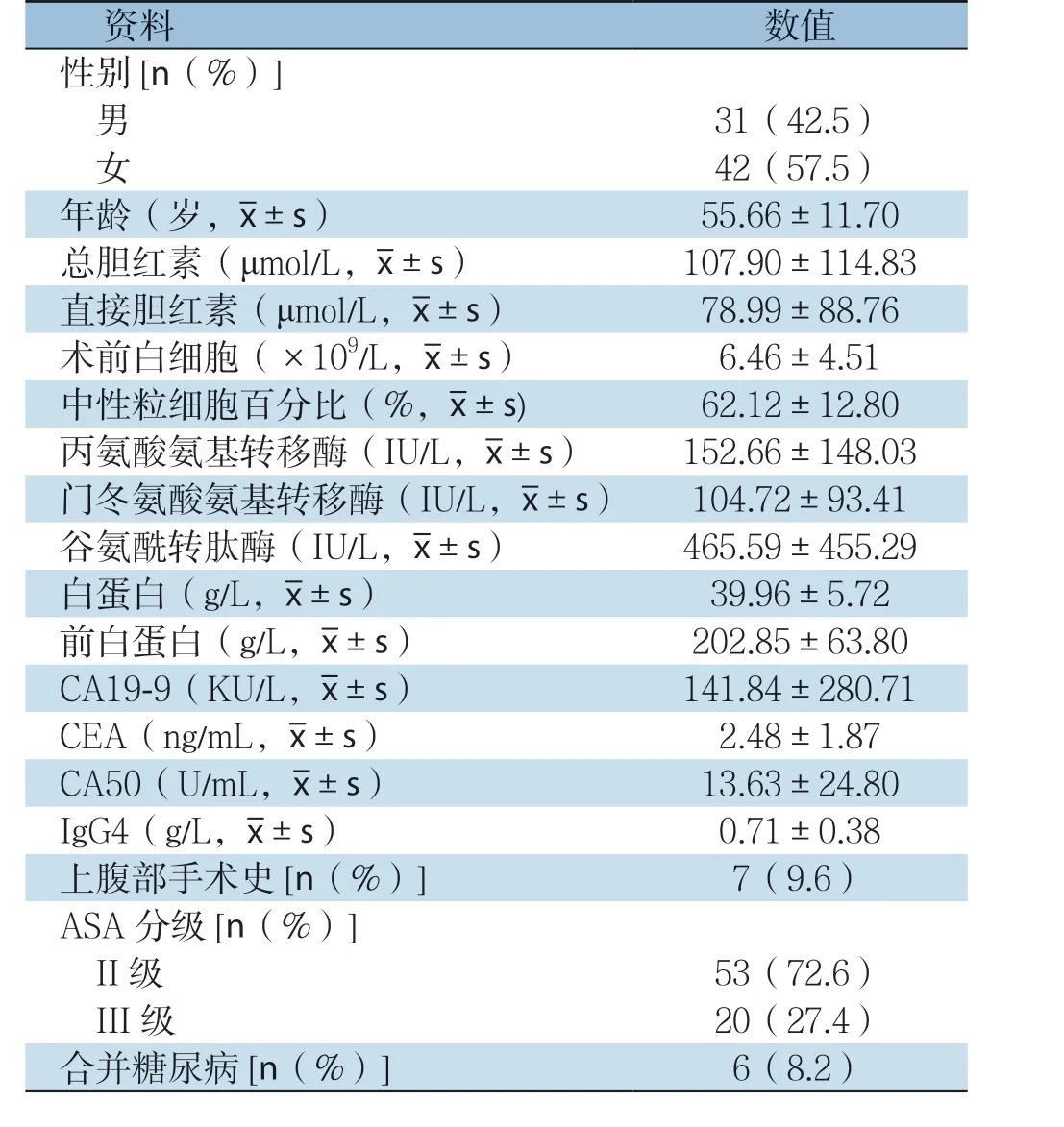
表1 73 例患者的术前一般资料Table1 The preoperative general data of the 73 patients

图1 LPD 手术步骤 A:腹腔探查;B:离断胃;C:切除钩突;D:钩突完整切除;E:胰肠吻合;F:胃肠吻合Figure 1 The operation process of LPD A: Laparoscopic exploration; B: Division of the Stomach; C: Resection of the unciform process;D: Complete excision of the unciform process; E: Pancreaticojejunostomy; F: Gastrointestinal anastomosis
1.3 术后管理
术后禁食水;予抗感染、抑酸、抑酶、肠外营养支持等治疗措施;严密监测和调控术后血糖水平;术后1~3 d查血常规、生化、炎症相关指标(C反应蛋白、降钙素原等);术后第1天即开始检测引流液淀粉酶,保持引流管通畅。将快速康复理念应用于LPD术后:早期下床活动,促进胃肠道排气;术后12~24 h拔除尿管;48~72 h拔除胃管。对于引流液淀粉酶含量升高的患者,予以适当冲洗引流,延长抑酸、抑酶药物使用时间,加强营养支持。
1.4 术后并发症诊断标准
术后胰瘘诊断分级标准参照2016年国际胰瘘研究组(ISGPF)制定的胰腺手术术后胰瘘的标准[14]。胃排空延迟诊断分级标准参照国际胰腺外科研究组(ISGPS)2007年制定的胃排空延迟诊断标准[15]。术后胆汁漏、出血、腹腔感染及脓肿诊断标准参照中华医学会外科学分会胰腺外科学组定义[16]。
1.5 统计学处理
采用SPSS 18.0统计学软件处理。定量资料的比较应用t检验,定性资料的检验采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 手术情况以及术后病理情况
平均手术时间(601.3±100.0)min,平均术中出血量(448.6±313.3)mL,术中平均输红细胞(2.4±1.7)U,输血浆(3.5±1.8)U,术后平均住院(21.2±9.5)d,住院平均花费(84 982.4±28 723.2)元。术后病理学诊断:恶性肿瘤63例(86.3%),其中十二指肠乳头癌31例,胆总管下段癌13例,壶腹部恶性肿瘤14例,胰头癌5例;良性占位10例(13.7%),其中胰腺实性加乳头状瘤6例,胰头部黏液性囊腺瘤3例,胰腺神经内分泌瘤1例。
2.2 术后并发症情况
73 例LPD 中,48 例发生术后并发症,分别为:按2016 版ISGPF 胰瘘诊断指南,术后胰瘘27例(36.9%),其中生化漏16例(21.9%),B级6例(8.2%),C级5例(6.8%),对于B级C级胰瘘,处理方法是:保持通畅有效引流、延长抑酶药物使用时间、如合并腹腔包裹性积液,必要时超声引导下穿刺、加强营养支持。本组中所有B、C级胰瘘患者均经过加强冲洗引流保守治愈。按ISPGS胃排空延迟诊断标准,胃排空延迟共发生46例(63.0%),包括A级35例(47.9%),B级9例(12.3%),C级2例(2.7%),对B、C级胃排空延迟者,放置鼻肠管,加强肠内营养,并辅以促胃动力药物、针灸和心理治疗等措施,肠动力恢复 好转。腹腔感染11例(15.0%),根据引流液培养和药敏结果选择性使用抗生素,感染得到控制。术后出血6例(8.2%),其中消化道出血2例(2.7%),1例经保守治疗止血;另1例诊断胃肠吻合口出血,经再次手术止血。术后腹腔出血2 例,1例诊断胃十二指肠动脉动脉瘤出血,予以血管介入止血;1例诊断小肠肠系膜动脉出血,再次剖腹止血;另2 例分别为胰腺下缘肠系膜上静脉分支以及钩突后方系膜出血,均再次手术止血。本组患者均无术后胆汁漏发生。术后再手术者4例(5.4%),均为术后出血患者,围手术期死亡1例(1.4%),死因为术后急性心肌梗死。
2.3 术后随访情况
所有患者术后门诊或电话随访,术后半年1个月1次,以后3个月1次。随访时间4~35个月,平均11.5个月,随访期间未出现死亡病例。
3 讨 论
LPD作为腹部微创外科复杂手术之一,起步较晚,初始存在着很多的争议。1994年Gagner等[5]第1 次报道LPD 后,其后又有例数较少的零星报道,这一时期报道的LPD手术时间长、难度大,并发症多,LPD发展相对缓慢[17];2007年,印度Palanivelu等[7]报道了42例LPD,出血量平均仅65 mL,平均手术时间370 min,术后并发症发生率28.6%,病死率4%,取得了较为满意的手术效果,至此,LPD进入了快速发展时期。牟一平团队[9-11]于2012 年率先开展国内LPD。自2016 年1 月—2018 年12月,中科大附一院普外科共完成PD近300例 ,其中实施LPD73例。所有患者消化道重建顺序均采用Child式。手术时间(601.3±100.0)min,术中出血量(4 4 8.6±3 1 3.3)m L、输红细胞(2.4±1.7)U,术后住院(21.2±9.5)d,住院花费(84 982.4±28 723.2)元。术后并发症发生率为65.7%,其中,胰瘘(B级+C级)15%,胃排空延迟63%,出血8.2%;再手术5.4%;病死率为1.4%。与同期我科开展的开放PD并发症相似[18];胰瘘与出血发生率 与美国约翰霍普金斯医学院Cameron等[3]报道的术后并发症也大致相同。对于如何减少术后胰瘘以及胰瘘的处理,笔者认为:⑴ 对于术中胰腺质地较硬的患者术后胰瘘的发生率相对较低,而对于术中胰腺质地偏软的患者,术后胰瘘发生率相对较高;⑵ 术中胰肠吻合方式:我科采用的胰肠吻合方法为胰管-空肠黏膜对黏膜(胰腺空肠导管对黏膜吻合),该种吻合方式可保证胰腺实质与消化液未直接接触,这样可以最大程度较少因消化液刺激而对胰腺残端的胰液刺激导致的胰瘘,从而减少术后的胰瘘;⑶ 在胰肠吻合时,使用可吸收缝线(强生PDSII、“薇乔“等)进行缝合,这样可以最大程度减少缝线针眼产生的胰瘘;⑷ 对于术中胰管直径<5 mm的,术中根据情况放置胰管支撑管;⑸ 经验是胰肠吻合口前方后方均放置腹腔双套管保证通畅引流。另外对于术后DGE,笔者目前认为:⑴ D G E 的诊断标准相对宽泛,D G E 的发生率较高;⑵ DGE可能由多种因素导致,术前的高龄、黄疸、术前机体一般情况较差、术中麻醉不平稳、手术时间较长等因素可能导致术后胃排空延迟;⑶ 目前国内的胃管拔除的时机以及理念相对陈旧,近年来快速康复外科的理念正在逐渐的改变传统的治疗理念;⑷ 对于DGE患者,我科的治疗方法是胃肠减压,并放置鼻肠管以及及时的营养支持促进胃肠道的蠕动,同时需排除腹腔感染导致的胃肠动力延迟,不建议早期对于DGE进行手术干预。减少术后的出血发生可从以下几个方面入手:⑴ 术后对于重要血管的处理,如对于胃十二指肠动脉、胰腺下缘血管的处理需要保证确切,术中一般都是缝扎止血保证确切止血;⑵ 对于术后早期(术后24~48 h内)的出血多数与术中的处理有关,对于此类患者,如合并血红蛋白进行性下降,心率加快甚至出现休克等情况,建议积极早期的再手术进行止血;⑶ 对于术后晚期出血(术后48 h后),出血高峰期一般发生在术后的5~7 d。多数患者合并胰瘘,胆瘘或腹腔感染等情况,如为单纯的消化道出血,可早期保持引流管通畅止血治疗,必要时内镜下诊断并止血,对于严重后期腹腔引流管的出血,此时介入是首选的治疗方法,可在介入下超选血管进行栓塞,如上述处理方法均无明显效果时,再考虑再次的手术探查止血。
笔者的经验总结:⑴ 基于胰腺解剖位置深、暴露困难,周围毗邻众多血管,腹腔镜下消化道重建的难度大等因素,LPD有着非常明显的学习曲线[19]。多中心研究发现,学习曲线的第一阶段需完成40例LPD[20],这期间手术时间长,术后住院时间长,术后并发症发生率高;完成40~104例这一期间手术时间逐渐缩短;此阶段之后,手术时间显著缩短。本中心已完成73例LPD,后期的手术时间比初始20例缩短不明显,仍处在学习曲线中。⑵ 对于病例选择方面,最初开展4 0 例L P D,笔者选择十二指肠占位与壶腹部周围肿瘤等疾病;后期选择胰头癌病例实施LPD。手术应遵循由易到难的原则,严格按照指南进行淋巴结清扫[21]。⑶ 我中心常规采用Child法重建消化道,其中重建中最重要的是胰肠吻合,目前国内主流的胰肠吻合方式有多种方案,目前主流吻合方式为导管对黏膜吻合、套入式吻合,我中心常规的吻合方案为胰管空肠导管对黏膜吻合,我中心采用的是4-0 Prolene缝线进行常规2层吻合,并放置胰管支撑管。胰肠吻合的确切与否与术后胰瘘的发生有着重要的关系。对于胆肠吻合我科主要采用可吸收缝线间断或倒刺线缝合。对于胃肠吻合,吻合后仔细检查吻合口有无出血,再以倒刺线间断缝合[22-24]。⑷ 术后精细管理十分重要,及时发现和处置各种并发症,对于术后的恢复尤为重要。
综上所述,本文总结分析我科近年来开展的73例LPD经验,与我中心前期发表的文章相对比,术后并发症以及远期情况与开腹手术相当[18],选择恰当的病例开展LPD是安全可行的[25-29];LPD手术可达到根治性目的。

