经鼻蝶入路显微镜与神经内镜切除垂体腺瘤临床分析
赵亚军 娄平阳 吴中华 李天晓 王 斌 李永明
河南省人民医院神经外科 郑州大学人民医院 河南大学医学院,河南 郑州 450003
垂体腺瘤是常见的颅内良性肿瘤,发病率高,约占神经系统肿瘤的15%,手术切除是目前主要的治疗方案[1]。经鼻蝶显微镜下切除垂体腺瘤技术较为成熟,但术野狭窄,鼻腔结构破坏等缺点限制其发展。JANKOWSKI等[2]于1992年首次报道神经内镜下经鼻蝶垂体腺瘤切除术后,此手术方式已经风行于欧美[3-4],近年来国内才开始大力推广神经内镜技术。本文总结河南省人民医院2017-01—2018-11治疗的垂体腺瘤患者的临床资料,并分析显微镜及不同时期神经内镜下切除垂体腺瘤的疗效。
1 资料与方法
1.1临床资料回顾性分析2017-01—2018-11河南省人民医院治疗的158例垂体腺瘤患者的临床资料,将经鼻蝶显微镜下切除垂体腺瘤纳入对照组,经鼻蝶神经内镜下切除术纳入观察组,其中早期手术(前3个月)患者纳入早期观察组,晚期手术(3个月以后)纳入晚期观察组。纳入标准:术前影像学诊断,术后病理证实为垂体瘤患者,首次接受手术治疗的患者。排除标准:巨大侵袭性垂体腺瘤,位于鞍上者、合并重要脏器功能不全者,多次手术患者,合并鼻腔疾病患者。对照组52例,男23例,女29例,年龄(46.9±7.9)岁,肿瘤直径(2.91±1.21)cm;Hardy分型:Ⅱ型22例,Ⅲ型19例,Ⅳ型11例。早期观察组22例,男8例,女14例,年龄(51.2±11.3)岁,肿瘤直径(3.21±1.13)cm;Hardy分型:Ⅱ型9例,Ⅲ型8例,Ⅳ型5例。晚期观察组84例,男39例,女45例,年龄(49.2±8.5)岁,肿瘤直径(3.02±1.41)cm;Hardy分型:Ⅱ型31例,Ⅲ型38例,Ⅳ型15例。3组患者性别、年龄、肿瘤大小及位置等一般资料比较差异无统计学意义(P>0.05)。
1.2方式
1.2.1 手术方式:患者采用全身麻醉,显微镜组手术方式:置入窥鼻器扩张鼻中隔,显微镜下寻找蝶窦入口,确定蝶窦前壁,剥除蝶窦黏膜,确定鞍底位置,骨凿凿开,分块切除肿瘤组织,肿瘤刮圈盲刮显微镜死角区域肿瘤组织。
神经内镜组手术方式(图1所示内镜下垂体大腺瘤切除术中所见):均采用“双人四手”操作,双鼻孔入路,取仰卧位,头后仰150°,右偏100°,早期观察组采用头架固定,晚期观察组绝大部分不再应用头架固定,部分鞍底发育不良者采用术中导航辅助。早期观察组均制作鼻中隔黏膜瓣,必要时切除中鼻甲,晚期观察组视具体情况决定是否制作鼻中隔黏膜瓣。神经内镜辅助下高速磨钻磨除蝶窦前壁骨质及骨性鼻中隔后下部,开放蝶窦腹侧壁,磨除鞍底骨质,剪开硬膜,切除肿瘤组织,不同角度内镜探查“死角”,术中注意保护鞍隔、视神经、颈内动脉、残余垂体、垂体柄等重要结构,术后鞍底重建。
1.2.2 观察指标与随访:观察比较3组基本临床资料情况、手术时间及手术并发症(脑脊液瘘、颅内感染、尿崩、垂体功能低下、术后出血)。随访6个月,观察肿瘤全切率、垂体功能恢复率等。

2 结果
与显微镜组比较,早期内镜组手术时间明显较长,但手术并发症及随访结果差异无统计学意义(P>0.05)。随着内镜技术熟练,晚期内镜组手术时间较早期内镜组明显缩短,但仍长于显微镜组,差异有统计学意义(P<0.05),而脑脊液漏、尿崩、垂体功能低下等明显低于显微镜组及早期内镜组手术,肿瘤全切率高于另两组,差异有统计学意义(P<0.05)。晚期内镜手术颅内感染发生率与显微镜组比较无明显降低,但与早期内镜组比较明显降低,差异有统计学意义(P=0.033)。见表1。
3 讨论
除部分泌乳素腺瘤的治疗首选药物外,目前手术切除垂体腺瘤仍是主要治疗方法[5]。经鼻蝶入路显微镜下切除垂体腺瘤已有50年历史,作为传统手术具有操作简单、容易学习等优点,但由于应用鼻窥器对鼻腔结构损伤较大,且显微镜下单一管状视野使得照明受限,不利于观察解剖标志及肿瘤全貌,使得肿瘤残余率较高[6-7]。近年来神经内镜技术不断发展[8],相关手术器械快速更新,凭借内镜下视野全面、成角观察、高强度照明、鼻腔结构损伤小等优点,经鼻蝶入路内镜下垂体腺瘤切除受到多数神经外科医师追捧,为提高垂体腺瘤全切率提供了更多可能[9]。然而内镜技术要求“手眼协调”,很多医师由显微镜下转换为内镜操作过程较慢,同时“双人四手”技术应用使得助手与主刀医师熟练配合要求增高,也使得部分神经外科医师对神经内镜技术望而却步[10]。本研究发现,早期内镜手术时间较长,手术并发症与显微镜手术相当,并未体现内镜优势,这可能是部分神外医师不愿更改手术方式的部分原因。
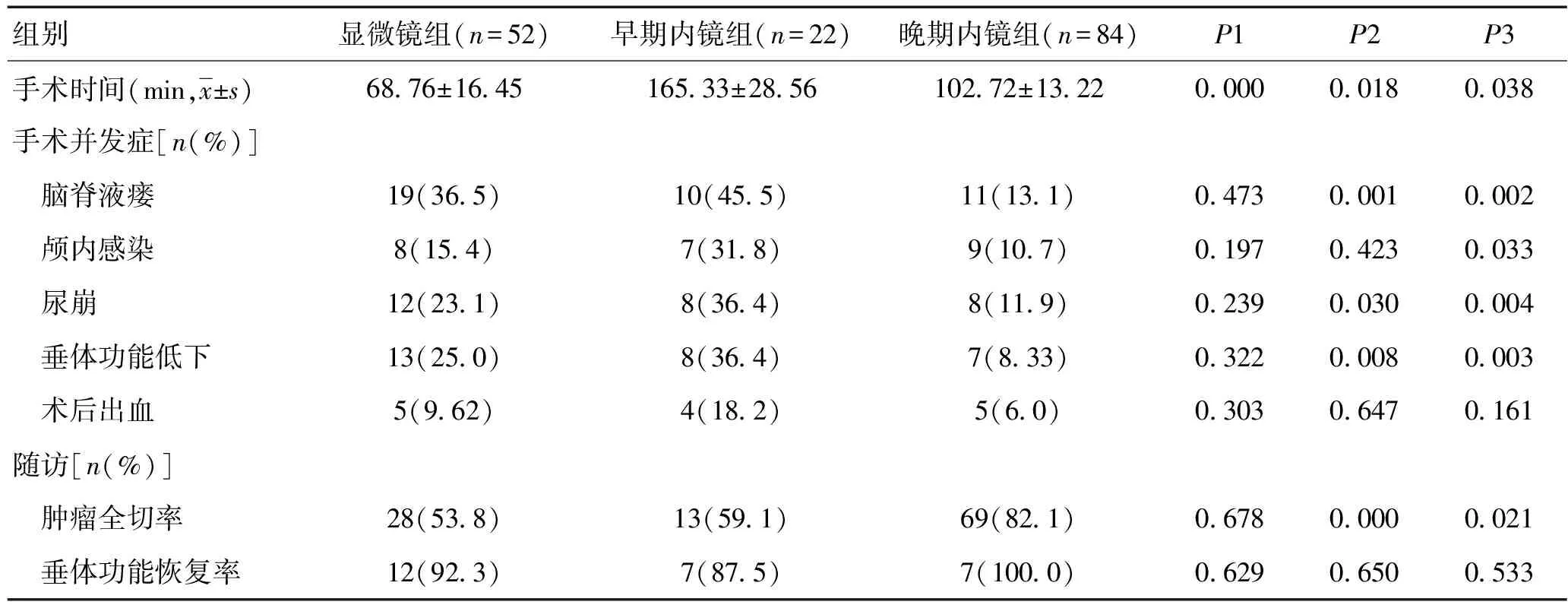
表1 不同组别手术时间、手术并发症及随访结果
注:P1为早期内镜组与显微镜组比较;P2为晚期内镜组与显微镜组比较;P3为晚期内镜组与早期内镜组比较

图1 57岁女性,头晕伴视物模糊1月余入院 A、B:鞍区MRI分别示鞍区及鞍上巨大垂体腺瘤;C:内镜下打开鞍底,暴露鞍底硬膜;D:鞍内肿瘤,色灰黄,质软;E:鞍内肿瘤切除完毕后鞍上肿瘤,质地稍硬,沿假包膜分离肿瘤可见鞍隔菲薄;F:肿瘤切除完毕后残余垂体及完整鞍隔塌陷Figure 1 A 57-year-old woman with dizziness and blurred vision who was admitted to hospital for more than a month A,B:MRI of the saddle region shows a giant pituitary adenoma in the saddle region and the saddle;D:Tumor in saddle,grayish yellow,soft;E:Tumor on saddle after resection of tumor in saddle,slightly harder texture,the saddle septum can be seen along the pseudocapsular;F:Residual pituitary collapse of complete saddle septum
本研究表明,经鼻蝶显微镜下垂体腺瘤手术时间明显低于内镜组,但晚期内镜组手术时间较早期内镜组手术时间明显缩短,且有接近显微镜组趋势,与部分研究报道的内镜手术时间明显低于显微镜组时间不一致[11]。笔者通过阅读文献分析其原因如下:本组内镜手术全部采用“双人四手”技术,助手与主刀配合的熟练程度会影响手术时间,且早期内镜手术组大部分应用术中导航技术,术中制作鼻中隔黏膜瓣,延长了手术操作时间。另外,由于内镜需要置入鼻腔深部,容易沾染异物污染镜头,镜头雾化问题及磨钻、吸引器与内镜“打架”等也消耗了手术时间[12]。部分研究认为内镜组手术时间显著低于显微镜组的可能原因:手术采用“单人双手”操作,熟练操作之后进行报道,术中不应用导航技术及不制作鼻中隔黏膜瓣等。本研究显示,随着经验的积累,熟练程度增加,内镜组与显微镜组手术时间会不断接近,且内镜组手术时间可能会低于显微镜组。
本研究显示,晚期内镜手术组脑脊液漏、尿崩、垂体功能低下等发生率明显低于显微镜组及早期内镜组手术,肿瘤全切率高于另两组,而早期内镜手术组与显微镜组比较无明显差异[13]。术后脑脊液瘘可引起低颅压、气颅、颅内感染,严重时危及生命,因此,降低脑脊液瘘发生率非常重要[14]。研究表明,术后脑脊液瘘多为术中鞍隔撕裂或鞍隔孔蛛网膜破裂所致。显微镜手术虽然三维成像,空间立体感强,但管状视野使其可视范围有限,术中盲目牵拉瘤体与鞍隔粘连之处容易造成鞍隔破裂,引起脑脊液瘘,部分医师为避免撕破鞍隔,残留部分粘连紧密肿瘤,也导致肿瘤残留率较高。内镜手术视野广阔,同时可通过抵近观察,小心仔细分离,减少鞍隔破裂风险[15]。另外,即使鞍隔破裂,内镜下可及时探查破口,观察流量大小,及时制定术中修补方案,“鼻中隔黏膜瓣”技术大大降低了术后脑脊液瘘的风险[16-17]。成角内镜辅助可增加肿瘤切除程度,保护残留垂体、垂体柄、颈内动脉等重要结构,提高肿瘤全切率[18];另外,内镜下“假包膜外切除术”也提高了肿瘤全切的可能。本研究提示,早期内镜组手术风险及肿瘤全切与显微镜组无明显差别,可能与内镜的二维视野及操作不熟练、解剖标志识别不准等有关,内镜平面视野使得解剖术野呈现“鱼眼效应”而导致图像与实际解剖有差别,随着内镜技术的熟练,更加适应内镜二维视野之后,手术并发症及肿瘤全切率明显改善[19]。
神经内镜技术的掌握需要一个学习曲线[20],早期手术时间及并发症稍高,技术成熟后较经鼻蝶显微镜手术优势明显,创伤小,术野宽广,操作简便,肿瘤全切率高,并发症少[21]。但对于Hardy分级较高的垂体腺瘤,神经内镜也无法显示其优势,仍需进一步积累内镜技术经验,改进辅助技术,寻求更大的突破。

