自体移植的大鼠骨髓间充质干细胞在脊髓损伤处的存活及分化
沈忠杰,李 亮,吴石奇,廖文波
1.广西壮族自治区第二人民医院脊柱外科,桂林 541002
2.遵义医科大学附属医院脊柱外科,遵义 563003
脊髓损伤(SCI)可造成损伤平面以下运动和感觉功能不同程度丧失[1-2],损伤后脊髓微环境的改变可导致轴突回缩及再生低下[3]。虽然SCI 不会显著影响患者寿命,但可能导致患者产生生理和心理问题,高昂的治疗费用也给患者家庭及社会带来沉重负担[4]。SCI 的治疗现仍是世界医学难题[5]。目前干细胞移植治疗SCI 已成为组织工程研究的热点。骨髓间充质干细胞(BMSC)具有来源丰富、易于培养扩增、免疫排斥反应弱且在特定条件下可向神经细胞分化等优点[6-12],是SCI 研究中比较理想的种子细胞。本研究采用改良Allen 撞击装置制备T9SCI 模型后,立即通过微量注射将自体BMSC 移植到损伤处,观察自体移植的BMSC 存活及向神经细胞分化情况,为临床应用自体BMSC 治疗SCI 提供实验依据。
1 材料与方法
1.1 动物和试剂
雄性SD 大鼠36 只,由陆军军医大学实验动物中心提供,动物生产许可证号:SCXK(渝)2017-0002。随机分为PBS 注射组(PBS 组)和BMSC自体移植组(BMSC 组),每组18 只。主要试剂:L-DMEM培养基(Gibco,美国);胎牛血清(Hyclone,美国);Ficoll-Paque 分离液(Pharmacia,美国);胰蛋白酶、Hoechst33342、小鼠抗大鼠胶质纤维酸性蛋白(GFAP)单克隆抗体(Sigma,日本);兔抗大鼠微管相关蛋白2(MAP-2)多克隆抗体(Abcam,英国);羊抗小鼠FITC-IgG 及羊抗兔TRITC-IgG(武汉博士德公司,中国);抗大鼠CD29、CD45、CD90 单克隆抗体(BioLegend,美国)。
1.2 BMSC 的分离培养、鉴定及标记
用3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉大鼠,用脱毛剂对大鼠后肢进行脱毛处理,之后进行严格消毒铺巾。在无菌条件下,用装有肝素钠生理盐水的注射器从双侧大鼠股骨处抽取骨髓液,得到混有肝素生理盐水的骨髓液1.5 ~ 2.0 mL,之后加入10.0 mL PBS 混匀,1 000 r/min(离心半径为15 cm)离心5 min 后弃上清;沉淀物用5 mL L-DMEM 液重悬后缓慢叠加到等量的Ficoll-Paque 分离液上层,2 000 r/min(离心半径为6 cm)离心20 min;收集单核细胞层,即为BMSC。用含10%胎牛血清的L-DMEM 重悬后按3×104/mL 的密度接种于底面积为25 cm2的培养瓶中,细胞接近70%融合时进行传代。用流式细胞术检测第4 代BMSC 细胞膜抗原CD90、CD29、CD45。待第4 代BMSC 接近80%融合时,按照谢兴文等[13]的方法使用终浓度为5 μg/mL的Hoechst33342 避光孵育30 min,消化、离心后收集细胞,制成细胞密度为5×106/mL 的细胞悬液,4℃保存备用。待建立SCI 模型(用时15 ~ 20 min)后立即进行自体移植。
1.3 SCI 模型的建立及细胞移植
36只SD大鼠均用3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,麻醉生效后俯卧位固定,术区消毒、铺巾,以T9棘突为中心做1个长约4 cm的切口,暴露T8~10棘突和椎板,咬除T9棘突和椎板以暴露该节段的脊髓,采用改良Allen法[14](40 g重物自5 cm高度垂直打击)制备SCI模型。评价造模成功的标准[15]:大鼠双后肢及躯体回缩样扑动后双后肢瘫痪,尾部出现痉挛性摆动,局部脊髓表面迅速水肿并淤血。
建立模型后,即刻使用微量注射器在BMSC 组大鼠损伤中心处微量注射细胞悬液5 μL,PBS 组在相同位置注射等量PBS。注射过程应尽量缓慢。彻底止血后依次缝合肌肉、皮下、皮肤。术后2 周内因协助排尿膀胧破裂死亡及术区感染死亡大鼠各2 只,均予补齐进行实验。在术后2、3、5 周采用 Basso-Beattie-Bresnahan(BBB)评分法[16]对大鼠双后肢运动功能恢复情况进行评分。
1.4 脊髓标本的制备
每组分别于移植后2、3、5周各取6只大鼠,用3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,用300 mL预冷4%多聚甲醛经左心耳灌注固定(灌注速度宜先快后慢),切取以T9损伤处为中心、向头尾端共长1 cm 的脊髓,于4℃ 4%多聚甲醛中固定12 h 后进行连续冠状冰冻切片,片厚10 μm,每隔4 张取1张,每个标本各留取40 张。切片直接贴于经多聚赖氨酸处理过的载玻片上,置于暗盒-20℃保存。
1.5 损伤处BMSC 存活计数
BMSC 组每只大鼠移植后2、3、5 周各取5 张切片,在荧光显微镜下(400 倍),在每张切片的细胞移植区随机选取2 个视野,计数每只大鼠10 个视野中被Hoechst33342 标记的BMSC 总数,取其均值作为BMSC 组每只大鼠每个视野BMSC 存活数量。计数时以发蓝色荧光、呈椭圆形或圆形、大小较均一的细胞核作为存活BMSC 的细胞核。
1.6 损伤处BMSC 分化情况及组织学变化
BMSC组每只大鼠移植后2、3、5周各取5张切片,室温复温10 min,用0.01 mol/L PBS清洗3次,每次5 min;加入体积分数为3%的H2O2作用10 min,用0.01 mol/L PBS清洗3次,每次5 min;加入体积分数为0.3%的TritonX-100 作用30 min,用0.01 mol/L PBS清洗3次,每次5 min;滴加10%正常山羊血清室温封闭30 min,甩掉血清;分别滴加稀释的小鼠抗大鼠GFAP 单抗(1∶400)及兔抗大鼠MAP-2 多抗(1∶200)一抗,4℃湿盒中过夜,用0.01 mol/L PBS 清洗3 次,每次5 min;分别滴加稀释的羊抗小鼠IgG-FITC(1∶64)及羊抗兔IgG-TRITC(1∶64)二抗,湿盒中37℃孵育1 h,用0.01 mol/L PBS 清洗2次,每次5 min;用抗荧光衰减剂封片后,在荧光显微镜下观察、拍照。细胞核发蓝色荧光、胞质发红色荧光的细胞表示移植存活的BMSC 分化为神经细胞,细胞核发蓝色荧光、胞质发绿色荧光的细胞表示移植存活的BMSC 分化为星形胶质细胞。
于移植后2、3、5 周,取BMSC 组和PBS 组大鼠脊髓组织切片进行HE 染色,观察脊髓组织学变化。1.7 统计学处理
采用SPSS 20.0 软件对数据进行统计学分析,计量资料以s 表示,组间比较采用独立样本t 检验;以P < 0.05 为差异有统计学意义。
2 结 果
2.1 BMSC 分离培养及鉴定
分离的细胞接种24 h 内逐渐贴壁,72 h 后贴壁细胞增多,细胞形态以长梭形和多角形为主(图1a)。随着培养时间的延长,大部分贴壁细胞伸展开,边缘伸出较长的突起,与周围细胞相连接,至第5 天时细胞数量明显增多,有形成细胞集落的趋势,细胞形态以短梭形为主(图1b)。流式细胞术检测提示第4 代BMSC 细胞膜抗原CD90、CD29 表达阳性,CD45 表达阴性(图2),表明分离培养的目标细胞主要是BMSC。
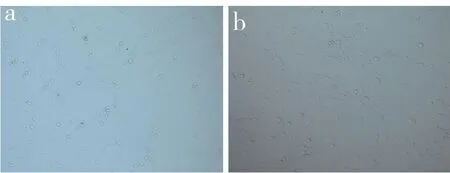
图1 BMSC 形态学观察(×100)Fig. 1 Morphology of BMSC(×100)
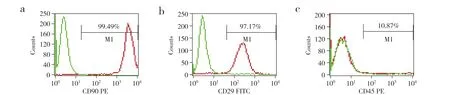
图2 流式细胞术检测第4 代BMSC 表面标志物的表达Fig. 2 Flow cytometry detecting expression of surface markers of 4th generation BMSC
2.2 移植后各时间点2组大鼠BBB 评分的比较
移植后2、3、5 周,BMSC 组大鼠BBB 评分均高于PBS 组,差异有统计学意义(P < 0.05,表1)。
2.3 BMSC 在损伤处的存活和分化情况
荧光显微镜下可观察到BMSC 组大鼠损伤处脊髓有不同数量Hoechst33342 标记的细胞存活,移植后2、3、5 周BMSC 存活数量分别为40.58±6.67、25.32±4.34、7.56±4.13,其中2 周时细胞存活较多,5 周时细胞存活较少。移植后2、3 周时未检测到BMSC 组大鼠损伤处移植存活的BMSC MAP-2及GFAP 免疫反应阳性,而在5 周时检测到少量移植存活的BMSC MAP-2 及GFAP 免疫反应阳性(图3)。
表1 移植后各时间点2组大鼠BBB 评分Tab. 1 BBB scores in 2 groups at each time point after transplantation
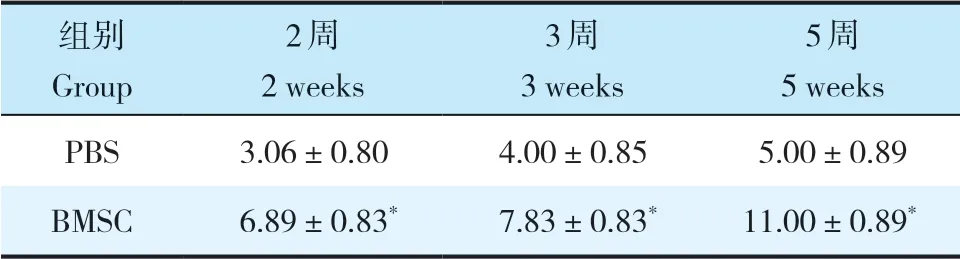
表1 移植后各时间点2组大鼠BBB 评分Tab. 1 BBB scores in 2 groups at each time point after transplantation
注:*与PBS 组比较,P < 0.05。Note:* P < 0.05,compared with PBS group.
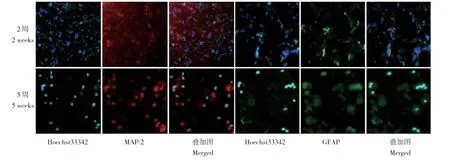
图3 移植后BMSC 在损伤处的存活和分化情况(×400)Fig. 3 Survival and differentiation of BMSC in SCI site after transplantation(×400)
2.4 2 组损伤处脊髓组织学变化
HE 染色结果显示,PBS 组大鼠注射后2 周,损伤处脊髓组织结构紊乱明显,神经细胞变性坏死,有较多炎性细胞浸润;注射后5 周,脊髓有明显的空洞及胶质瘢痕形成。BMSC 组大鼠移植后2 周,损伤处脊髓组织结构较规整,轻度充血水肿,神经细胞浑浊但未见变性和坏死,有少量炎性细胞浸润;移植后5 周,脊髓无明显的空洞形成,有少量胶质瘢痕形成(图4)。

图4 2 组大鼠损伤处脊髓组织学变化(HE染色,×200)Fig. 4 Histological changes of SCI site in 2 groups(HE staining,×200)
3 讨 论
作为组织工程的种子细胞,BMSC 在细胞替代治疗、基因治疗以及组织器官的再造中具有重要的研究意义及临床应用价值,被广泛应用于组织工程研究中[17-18]。Hofstetter 等[19]于大鼠SCI 1 周后对损伤处脊髓进行BMSC 移植,5 周后观察到少许移植细胞表达神经元标志物NeuN,通过BBB 评分及组织学检测证明BMSC 移植后可在一定程度上改善SCI 后截瘫动物的预后。Huang 等[20]在大鼠SCI 1 周后于损伤处脊髓移植BMSC 和神经生长因子混悬液,2 个月后观察到植入损伤部位的BMSC 不仅能够分化为神经元和星形胶质样细胞,而且表达神经元和星形胶质细胞的蛋白标志物NeuN 和GFAP,并在SCI 部位形成细胞导向引导神经纤维的再生,起到桥接作用,使再生的神经轴突可以顺利地通过损伤处。陈秉耀等[21]在大鼠损伤脊髓处注射异体BMSC,结果发现在损伤处存活下来的细胞中有少量细胞表达神经元标志物MAP-2或星形胶质细胞标志物GFAP。高瑞等[22]将GFP 转基因大鼠的BMSC异体移植于SCI 大鼠体内,通过体内示踪和免疫荧光共定位发现,外源性BMSC 能聚集于SCI 部位并分化为神经元、神经胶质细胞和神经前体细胞。Ye等[23]的研究发现,在体外诱导BMSC 向神经细胞分化后,再移植到大鼠损伤脊髓处,能促进损伤脊髓修复。上述异体移植BMSC 的实验研究表明,BMSC移植于中枢神经系统损伤处后,部分移植细胞可存活并有少量细胞表达神经元和星形胶质样细胞标志物,并在一定程度上改善SCI情况。本研究在建立大鼠SCI模型后立即在损伤部位移植自体BMSC,移植后2、3及5周在损伤处脊髓均观察到移植细胞存活,并且BMSC自体移植组BBB评分均高于PBS注射组,显示部分移植的BMSC能在SCI后不利的局部微环境下存活,对SCI后运动功能的恢复有一定作用。
本研究结果显示,移植细胞于2周时存活较多、5 周时存活较少,提示自体移植的BMSC 在损伤脊髓内存活的数量随着时间的延长而减少。分析其原因:①标记细胞的Hoechst33342 荧光染料随着细胞分裂其荧光强度逐渐递减或消失[24];②SCI 2 周后,损伤处仍可见炎性细胞浸润,而炎性细胞所分泌的一些有害细胞因子可使前期存活下来的BMSC死亡;③SCI 5 周时,损伤处及其附近形成少量的瘢痕组织及空洞,会造成局部血供不足,影响了BMSC 的存活;④术后大鼠进食欠佳,至术后5 周时大鼠极为消瘦,营养不良亦会影响BMSC的存活。
在BMSC 移植后第5 周,采用免疫荧光染色法检测到少量的移植细胞表达MAP-2 及GFAP,这说明移植细胞在局部微环境作用下,存活的BMSC 可向神经元和星形胶质样细胞方向分化。但目前尚无证据证实这些分化细胞就是功能成熟的细胞。有学者认为,MAP-2 及GFAP 等标志物并非是神经元和星形胶质样细胞的特异性标志物,因为发育过程中的肌纤维和心肌细胞等非神经细胞亦可表达这些标志物[25]。目前的实验研究大多停留在分化的BMSC具有神经元或星形胶质样细胞的形态特征和表达神经元或星形胶质样细胞的特异性标志物这一层面,而缺少具有神经元或星形胶质样细胞的结构和电生理学特征的证据。本实验亦缺少这方面的证据,故不能证实这些分化细胞就是功能成熟的细胞。至于这些分化后的细胞能否真正有效地取代受损的神经元、促进神经纤维的再生进而促进大鼠脊髓功能的恢复,需进一步的实验研究予以阐明。
目前,关于SCI 后BMSC 移植时机的选择尚未达成共识。本研究选择在SCI 后立即进行BMSC 移植,能避免SCI 后一段时间进行局部移植BMSC 再次麻醉的不良作用及再次手术的打击,保证大鼠的存活率,利于后续实验的进行;且在SCI 后急性炎性反应期进行移植可能通过改善损伤后脊髓的内部环境阻断某些恶性循环,分泌有利神经再生的因子,填充损伤脊髓区域的空腔,从而减轻SCI 早期出现的大量神经细胞凋亡及减轻脊髓继发性损伤,加速大鼠后肢功能的恢复[26-28]。在此基础上,后续实验拟对比SCI 后在损伤处脊髓即刻移植BMSC,与损伤后3、7 及14 d 移植BMSC 的结果进行对比,进一步摸索自体BMSC 移植治疗SCI 的最佳时机。
本研究结果显示,仅少量存活细胞分化为神经细胞,而多数存活的细胞是否分化为其他细胞,并且这些细胞对损伤脊髓功能的修复起到促进还是阻碍的作用,这些问题有待进一步深入研究。本研究通过对细胞移植5 周后的损伤处脊髓组织进行HE染色,观察到BMSC 移植组损伤处脊髓有少量胶质瘢痕组织形成,推测这些胶质瘢痕组织可能是由BMSC 分泌的类胶原细胞外基质形成的,提示存活下来的BMSC 可向结缔组织方向分化,这一推测有待进一步实验研究予以证实。

