后路经皮内窥镜下颈椎椎间盘切除术治疗神经根型颈椎病
陈元元,徐建广,张 涛,蔡 斌,连小峰
上海交通大学医学院附属第六人民医院骨科,上海 200233
颈椎病是骨科常见疾病,是颈椎椎间盘退行性变及继发性改变刺激或压迫邻近组织并引起的一系列临床症候群,严重影响患者的生活质量[1]。神经根型颈椎病(CSR)发生率占颈椎病的 60% ~ 70%,常表现为根性疼痛、麻木甚至无力等。目前,前路颈椎椎间盘切除融合术(ACDF)是颈椎病治疗中应用最广泛的手术方式,可经前路间隙到达椎体前方及椎间盘,直接解除脊髓及神经根压迫,临床效果得到普遍认可[2]。ACDF 具有减压彻底、骨性融合牢固的优点,但同时也存在一系列问题,如术中暴露过程中可能损伤颈椎前部神经、血管,导致术后声音嘶哑、吞咽困难等,同时该术式需融合颈椎的一个或多个运动节段,可能出现融合邻近节段退行性变等问题[3]。近年来,随着脊柱微创手术的发展[4-6],经皮内窥镜下颈椎椎间盘切除术(PECD)因其创伤小、可最大限度保留组织结构、术后恢复快等优点逐渐受到医师和患者的关注。本研究组2016年1月—2017年12月采用后路PECD治疗CSR患者31 例,中期临床疗效满意,现报告如下。
1 资料与方法
1.1 一般资料
纳入标准[7]:①顽固根性疼痛,经12周以上正规非手术治疗症状无缓解或进行性加重;②CT或MRI检查证实为颈椎单节段椎间盘突出或脱出;③病变范围C4/C5/C6/C7;④椎间盘后方高度≥4 mm;⑤既往无颈椎手术史。排除标准:①突出椎间盘钙化;②手部精细动作障碍;③下肢行走不稳;④突出为宽基底型及中央型椎管狭窄;⑤影像学示颈椎不稳;⑥颈椎畸形。根据以上标准纳入2016年1月—2017年12月接受后路PECD治疗的CSR 患者31 例,其中男18 例、女13 例,年龄39 ~ 62(49.0±4.5)岁;病变节段:C4/C57 例,C5/C615 例,C6/C79 例。
1.2 手术方法
患者全身麻醉,取俯卧位,调整头架使颈部略前屈,双上肢固定于躯干两侧,并予以宽胶布固定头部及肩部。C 形臂X 线机透视定位手术节段,确定椎间隙、关节突和侧块,并画线标记。常规消毒铺巾并定位关节突关节内侧缘、上下椎板交界处,切开皮肤约8 mm 并放置扩张器、通道及内窥镜系统(直径4.3 mm,SPINDOS,德国)。内窥镜下再次确定上下关节突关节内侧缘及椎板交界处,持续生理盐水冲洗,小心磨除5 ~ 6 mm上下椎板及1 ~ 3 mm关节突关节骨质,并小心去除椎板间隙部分黄韧带组织,充分显露硬膜囊、神经根及突出的椎间盘髓核组织,用髓核钳取出突出的椎间盘组织。反复探查确定神经根松弛良好、无残余突出或脱出髓核后,静脉丛出血予以彻底止血,移除内窥镜及通道,可吸收线缝合切口,无菌辅料覆盖。
1.3 术后处理
术后常规应用脱水及激素药物治疗,术后3 ~ 6 d即可出院。术后1 d 佩戴颈托下床活动,颈托佩戴1周,1 周后可参与轻度劳动及运动,2 周后可基本恢复正常工作生活。
1.4 疗效评估
记录手术时间、术中出血量(出血量=手术结束所收集液体总量-冲洗生理盐水量)。术前,术后1 d、1 周、1 个月及6 个月采用疼痛视觉模拟量表(VAS)评分[8]评估颈部及上肢疼痛情况,采用日本骨科学会(JOA)评分[9]评估神经系统功能。手术前后拍摄颈椎正侧位、过伸过屈位X 线片,评估相邻节段相对滑移距离、颈椎曲度(C2~7Coob 角)、手术节段活动度(ROM)。相邻节段相对滑移距离均>3 mm[10]为节段性不稳。手术节段ROM 为过伸过屈位X 线片上病变节段Cobb 角差值,ROM>10°为节段性不稳。
1.5 统计学处理
采用SPSS 19.0 软件对数据进行统计学分析。计量资料以表示,手术前后颈椎曲度和手术节段ROM 比较采用配对样本t 检验;手术前后VAS评分和JOA评分采用方差分析进行多组样本与同一对照组的比较,应用Dunnett t 检验;以P < 0.05 为差异有统计学意义。
2 结 果
所有手术顺利完成,手术时间41 ~ 76(57.9±8.6)min,术中出血量12 ~ 30(19.7±4.0)mL,住院时间3 ~ 6(3.6±0.6)d,术后随访(33.9±8.1)个月。术中无神经根损伤、硬膜囊破裂等并发症发生。术后颈椎曲度、手术节段ROM 与术前相比无明显改变,差异无统计学意义(P > 0.05,表1)。末次随访时动力位X线片相邻节段相对滑移距离< 3 mm,未见局部颈椎不稳。术后上肢VAS 评分及JOA 评分均较术前明显改善,差异有统计学意义(P < 0.05,表2)。术后发生手术侧上肢一过性麻木2 例、手术侧手部一过性无力1 例,至末次随访时上述症状均消失;术后发生手术侧颈部疼痛4 例,术后1 个月时疼痛消失;以上病例均未作特殊处理。典型病例影像学资料见图1。
表1 颈椎曲度和手术节段ROMTab. 1 Cervical curvature and ROM of operative segment N=31
表2 手术前后VAS 和JOA评分Tab. 2 Preoperative and postoperative VAS and JOA scores
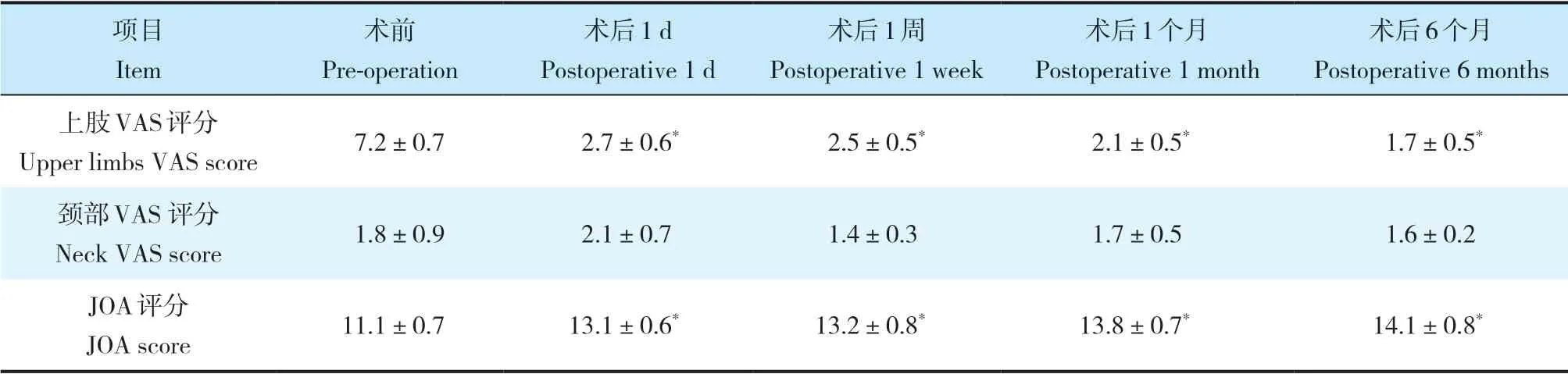
表2 手术前后VAS 和JOA评分Tab. 2 Preoperative and postoperative VAS and JOA scores
注:*与术前相比,P < 0.05。Note:* P < 0.05,compared with pre-operation.
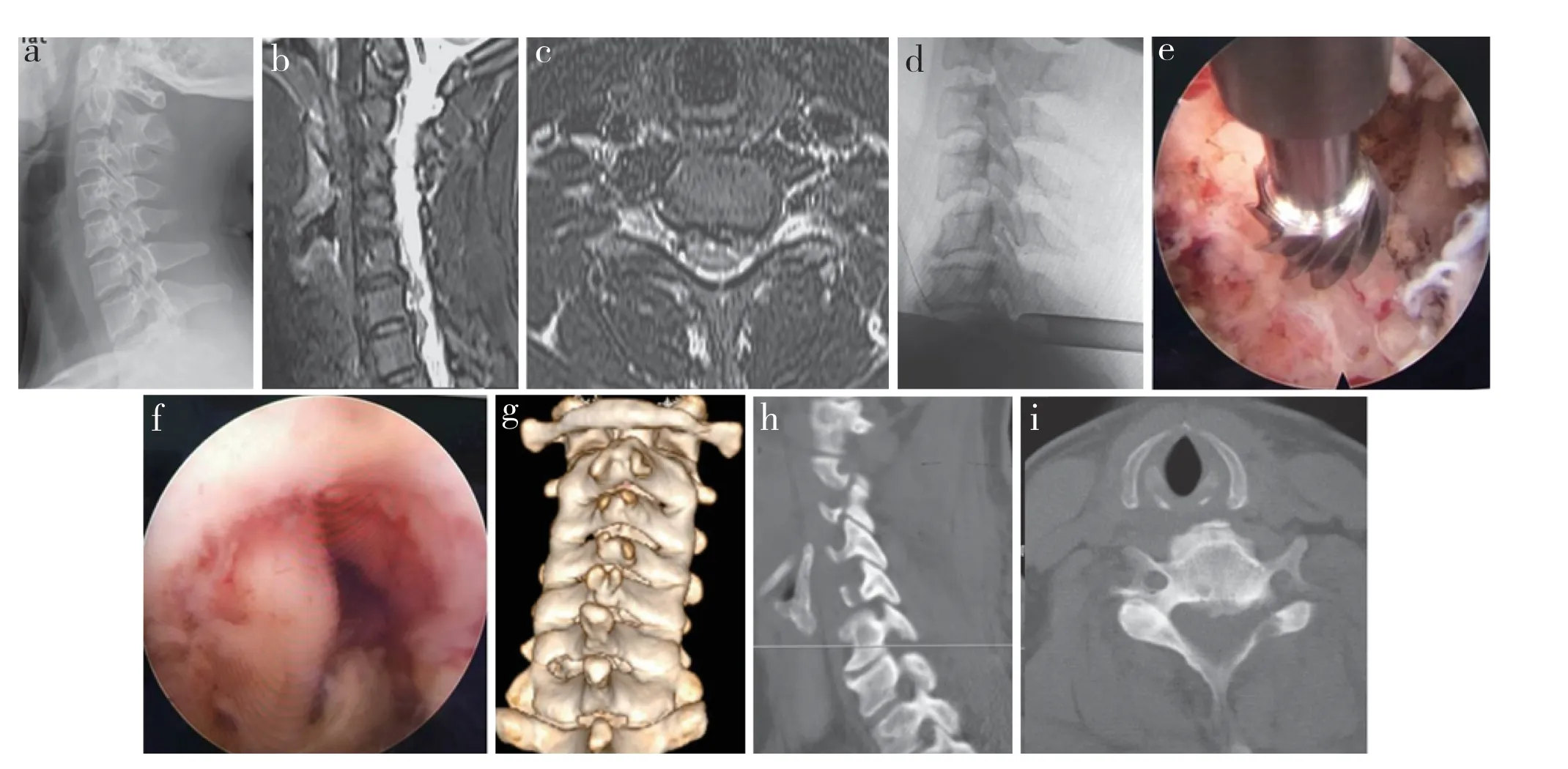
图1 典型病例影像学资料Fig. 1 Imaging data of a typical case
3 讨 论
近年来,随着脊柱生物力学研究的不断深入,脊柱外科微创技术日益受到重视,其应用范围不断扩展。Roh等[11]在尸体标本上对显微内窥镜下椎间盘切除术(MED)治疗颈椎疾病进行研究,并获得与传统手术相近的手术疗效。Burke等[12]采用改良MED 治疗颈椎椎间盘疾病,也取得较好的临床效果。前路PECD因工作套管经过椎间盘,不可避免地对椎间盘和上下软骨终板造成一定损伤,使椎间盘高度下降[13]。而George 等[14]和Umebayashi 等[15]提出的经椎体入路及Jho 等[16]提出的经钩椎关节入路PECD 均存在一定的创伤和不确定的远期疗效。内镜下颈椎后路椎间孔切开髓核摘除术治疗颈椎椎间盘突出症是一项安全、有效的脊柱微创技术,Ruetten 等[17]于2008 年首次报道后路PECD,通过逐层扩张颈后软组织钝性分离肌肉组织建立工作通道,有效避开重要血管和神经,不切除棘突、不破坏椎板和椎间盘之间的固有结构,较好地保留了侧块关节,保留了颈椎的运动节段及脊柱稳定性,具有创伤小、保留术后脊柱ROM、出血量少、费用低等特点。与后路开放手术相比,后路PECD 较好地保留了椎旁肌、棘突韧带的完整性,术后死腔小、积血少,术后感染和轴性症状的发生率低,整个手术过程对脊柱骨性结构破坏较小,对脊柱稳定性影响较小[18-21]。Kim 等[22]研究对比了扩张通道椎间盘摘除术与后路PECD 的疗效,发现两者均能获得较好的预后,且无严重并发症出现或随访时间内的二次手术。在本研究中,有4 例患者术后发生手术侧颈部轻度疼痛,均未予以治疗,术后1 个月随访时疼痛症状均消失,且无轴性疼痛症状出现。有文献报道,随着时间延长,后路椎间盘切除术的再手术率可达16.4%[23],该结论有待于更长时间的随访和深入的研究证实。
理论上,突出的椎间盘可从神经根的腋下去除并不侵犯关节突关节,但有研究表明,后路PECD有38%的情况下会磨除关节突关节[24-27]。由于内窥镜和工作通道的可旋转性,如术中需行椎间孔成形而磨除骨质,其范围一般不会受皮肤小切口的限制[22]。本组术中首先定位关节突与椎板交界处,并采用镜下磨钻对关节突关节表层骨质进行磨除,由内向外的磨除长度为1 ~ 3 mm,磨除上下椎板范围约5 ~ 6 mm,不磨透整层骨质,留一薄层,以免损伤下方脊髓或神经根,再用镜下枪钳去除残余内层皮质骨,术中轻柔操作并辅助神经电生理监测,逐步显露神经根和硬膜囊,避免出现脊髓损伤等灾难性的并发症。本组患者术后上肢VAS 评分和JOA 评分均较术前明显改善,表明患者术后症状有效缓解,神经功能明显改善;末次随访时,颈椎曲度及手术节段ROM 无明显改变,相邻节段相对滑移距离< 3 mm,证实无颈椎失稳发生。
目前,ACDF 仍为治疗CSR 的最常用术式。后路PECD 作为一种补充治疗手段,其学习曲线平坦,但须在严格掌握手术适应证的前提下,同时需要熟练掌握内窥镜下手术操作技巧以避免医源性神经损伤。对于颈椎后凸、颈椎不稳、宽基底型椎间盘突出、椎间隙严重塌陷等患者而言,ACDF 仍是首选术式。后路PECD 是一种具有发展潜力的微创技术,用于治疗CSR 安全、有效,术中操作对部分骨质的切除不会明显破坏颈椎生物力学稳定性,术后颈椎曲度无明显变化,具有创伤小、出血量少、不影响颈椎活动、术后康复快等优点,且也有极其严格的适应证。本研究纳入病例数量较少,未来仍需要进行高质量的队列研究进一步总结评估其长期临床疗效。

