AD细胞模型的建立及评价方法研究进展
邓 婷,余志杰,徐 颖,李劲松,孙 涛
(1.成都中医药大学 中药材标准化教育部重点实验室 西南特色中药资源国家重点实验室,四川 成都 611137; 2.广元市第一人民医院,四川 广元 628017)
阿尔茨海默病(Alzheimer’s disease,AD)是一种中枢神经系统的退行性疾病,它是以记忆力下降、认知功能障碍,并出现语言和运动障碍、人格改变等为临床特征。据2016年流行病学统计,全球AD患者已超过4 700万,预计到21世纪中期将增加到1.31亿以上,同时估计全球治疗AD总费用为8 180亿美元[1],因而AD的防治已成为当前社会亟待解决的重大医学、社会和经济问题。AD主要病理特征包括神经元胞外老年斑(senile plaques,SPs)、神经原纤维缠结及神经元丢失等。目前,AD的机制涉及多种假说,主要有β淀粉样蛋白(β-amyloid,Aβ)毒性、氧化应激、Tau蛋白异常磷酸化等。尽管AD已被广泛研究,但该疾病的发病机制尚不清楚,妨碍有效治疗的发展。因此,我们需要适当的模型来研究AD的发病机制和治疗方法。
目前,研究AD的方法主要包括动物模型和细胞模型。动物模型能真实模拟动物体内AD的病理特征;而细胞模型能在微观层面研究AD的发病机制,并可根据研究目的的不同选择构建适宜的细胞模型。然而,目前总结AD细胞模型方法的文献报道较少。因此,本文将从造模试剂、细胞模型建立方法及评价指标等方面对建立AD细胞模型的方法进行综述,进一步梳理各细胞模型的特点,并根据造模物质的神经毒性、氧化应激、Tau蛋白异常磷酸化等作用机制方面对其进行分类总结,旨在为后续研究AD的发病机制及相关药物开发提供参考。
1 造模试剂
1.1 神经毒性损伤
1.1.1Aβ Aβ来自于其前体淀粉样蛋白前体蛋白(amyloid precursor protein,APP)第672~711残基裂解片段,APP经β-和γ-分泌酶连续剪切后形成长度在39~42个氨基酸的短肽。APP表达量增多时,导致Aβ过量产生,从而造成Aβ积聚形成SPs。据报道,Aβ可直接或间接对线粒体结构及功能造成损伤,进而诱发氧化应激、激活凋亡信号通路等级联反应,导致大量的神经元细胞损伤[2]。此外,Aβ积聚也会导致Tau蛋白过度磷酸化、突触连接障碍、炎症反应等。目前研究常采用20 μmol·L-1浓度的Aβ1-42、Aβ25-35诱导细胞建立AD细胞模型。
1.1.2谷氨酸 谷氨酸(glutamate,Glu)是大脑中主要的兴奋性神经递质,同时也被认为是新皮质和海马锥体神经元的主要神经递质,涉及认知功能等方面。研究表明,谷氨酸能神经元位于AD中受影响的区域,其作用是通过控制突触中谷氨酸的浓度,将神经冲动转化为化学刺激,并在突触前神经元中通过2个囊泡谷氨酸转运蛋白(vesicular glutamate transporter,VGLUT)1和VGLUT2维持储存在囊泡中的谷氨酸水平[3]。当神经元去极化时,过量的谷氨酸被释放到突触间隙,导致突触前和突触后神经元上的谷氨酸受体过度刺激,造成钙大量涌入、活性氧(reactive oxygen species,ROS)产生,引起氧化应激反应及最终的神经细胞死亡[4]。目前谷氨酸常采用10 μmol·L-1的浓度诱导细胞建立AD模型。
1.1.3甲醛 甲醛(formaldehyde,FA)是毒性最强的有机化合物之一,广泛分布于生物体和环境中。研究发现,AD患者尸检的海马中FA水平显着升高,因此AD的发病机制与甲醛密切相关。文献报道FA异常升高与认知障碍有关,如学习能力下降和记忆丧失;其也可促进AD的主要病理特征形成,包括Aβ沉积、Tau蛋白过度磷酸化和神经元丢失,同时伴有细胞功能障碍甚至细胞凋亡[5]。研究采用0.35 mmol·L-1的FA诱导N2a细胞,导致细胞凋亡率增高,Tau蛋白过度磷酸化[5]。
1.1.4甘油醛 甘油醛(glyceraldehyde,GA)呈剂量依赖性地促进神经细胞中GA衍生晚期糖基化终末产物(GA-AGEs)的产生。GA-AGEs主要存在于海马和海马旁回的神经元中,具有强烈的神经毒性,研究表明,经0.7 mmol·L-1GA诱导的SH-SY5Y细胞出现凋亡;另外,细胞内产生GA引起甘油醛-3-磷酸脱氢酶失活,进一步增加SH-SY5Y细胞内GA浓度,导致GA-AGEs产生和神经细胞毒性增强[6]。
1.1.5硅胶纳米粒子 硅胶纳米粒子(silica nanoparticles,SiNPs)是工业中最广泛使用的纳米粒子之一,并且已经用于中枢神经系统中的细胞和非病毒基因的递送。研究表明,SiNPs具有神经毒性,可诱导SK-N-SH和N2a细胞凋亡,并提高细胞内ROS水平;另外,经SiNPs处理的细胞内Aβ1-42沉积增加和Tau蛋白Ser262和Ser396磷酸化[7]。
1.2 氧化应激损伤
1.2.1过氧化氢(hydrogen peroxide,H2O2) H2O2是一种强氧化剂,可诱导体外细胞产生ROS,抑制细胞增殖,并氧化脂质、蛋白质和DNA等细胞内大分子,产生过量的脂质氧化物及自由基等,导致组织损伤和细胞死亡。此外,研究显示H2O2可通过c-Jun N-末端激酶诱导β-分泌酶的启动子活性,导致APP表达增加和Aβ积聚[8],从而诱导神经细胞凋亡。
1.2.2晚期糖基化终末产物 晚期糖基化终末产物(advanced glycation end-products,AGEs)主要是由蛋白质等大分子物质的游离氨基与还原糖的醛基经过非酶促糖基化反应产生不可逆的终末产物。AGEs积累后能诱导神经元产生大量ROS,从而引发氧化损伤;同时,高水平的AGEs和ROS将导致AGEs受体(receptor for advanced glycation end products,RAGE)过表达[9]。AGEs与其受体RAGE结合是其致病的主要途径,两者相结合后,通过激活烟酰胺腺嘌呤二核苷酸磷酸-氧化酶产生ROS,增强机体氧化应激,最终导致神经元凋亡[9]。此外,AGEs累积也与炎症反应、细胞凋亡等机制相关。
1.3 Tau蛋白过度磷酸化大量研究证明,Tau蛋白过度磷酸化在AD疾病中起着重要作用。冈田酸(okadaic acid,OA)是一种蛋白磷酸酯酶抑制剂,能抑制磷酸酯酶活性,使蛋白高度磷酸化。体外研究表明[10],经OA处理的神经细胞,Tau蛋白Ser-262位点磷酸化水平明显升高;同时,OA具有神经毒性,引起神经元细胞突触损伤。因此,OA可用于制备Tau蛋白过度磷酸化的AD细胞模型。
2 细胞模型的建立及评价指标
2.1 人神经母细胞瘤细胞人神经母细胞瘤细胞系SK-N-SH和SH-SY5Y常用于研究AD发病机制。SK-N-SH细胞系来源于一名4岁女性的转移性神经母细胞瘤的骨髓活检组织,该细胞系在体外培养状态下的生长特性类似神经元,具有神经元酶表达的多能性,如多巴胺-β-羟化酶、胆碱乙酰转移酶(choline acetyltransferase,ChAT)、乙酰胆碱酯酶、丁酰胆碱酯酶[11]。同时,研究表明SK-N-SH细胞经10 μmol·L-1全反式维甲酸诱导分化后细胞突触明显伸长、突触素表达明显升高等典型的神经元特征[10]。而SH-SY5Y细胞系应用最为广泛,是SK-N-SH细胞系的一个亚系,并经历3次克隆选择产生(SK-N-SH→SH-SY→SH-SY5→SH-SY5Y)[11]。该细胞系表现出多巴胺能神经元的特性,可表征多巴胺能标志物,如:多巴胺-β-羟化酶、酪氨酸羟化酶(tyrosine hydroxylase,TH)和多巴胺转运蛋白,具有合成和降解多巴胺的能力;同时,该细胞经诱导剂维甲酸诱导分化后,引起多巴胺能神经元特征加强,具有高表达的囊泡单胺转运体1(vesicular monoamine transporter1,SLC18A1)、多巴胺受体D2(dopamine receptorD2,DRD2)[12]。
目前,常用于诱导人神经母细胞瘤细胞建立AD模型的造模试剂包括:Aβ、H2O2、AGEs、GA、OA、SiNPs等,其诱导时间大多为24 h或48 h。检测指标主要有细胞活力、凋亡率及相关凋亡蛋白表达、氧化应激相关指标、Tau蛋白磷酸化水平等,具体详情见Tab 1。因此,该类细胞模型主要体现AD疾病的细胞凋亡、氧化应激、Tau蛋白磷酸化等病理特征。
2.2 NG108-15细胞株NG108-15细胞株是由小鼠神经母细胞瘤(neuroblastoma)和大鼠神经胶质瘤(glioma)细胞杂交形成的神经肿瘤细胞。Tojima等[13]发现该细胞株经分化剂丁酰环磷酸腺苷(dibutyryl cyclic adenosine monophosphate,db-cAMP)刺激分化后,表现出神经元样形态,具有神经突结构;同时,通过比较研究发现未分化和分化的NG108-15细胞株均能不同程度表达神经元蛋白和神经胶质蛋白,但未分化的细胞仅能表达神经胶质蛋白,如波形蛋白,而极少表达神经元蛋白,如神经丝蛋白(neurofilament,NF)200、磷酸化NF200,因此认为未分化的NG108-15细胞株不是神经元样细胞;此外,分化后的NG108-15细胞株也能表达ChAT蛋白,揭示该细胞能合成神经递质乙酰胆碱。
NG108-15细胞株常应用于AD等与认知、记忆相关的体外研究。研究常采用Aβ25-35[14]、OA[15]等诱导NG108-15细胞株,其模型主要机制涉及细胞凋亡、Tau蛋白异常磷酸化等,与AD病人脑组织中的病理特征一致,可作为研究AD的细胞模型。具体造模方法见Tab 1。
2.3 小鼠神经母细胞瘤细胞克隆的小鼠神经母细胞瘤细胞(mouse neuroblastoma cells,N2a/Neuro-2a)是从A株白化鼠的自发性肿瘤而建立,该肿瘤系被命名为C1300。该细胞多数呈神经元样,具有轴突样结构,部分细胞间可见突起交织成网络样结构。研究显示N2a细胞表达核受体相关因子1并产生低水平的TH和多巴胺;但经0.5 mmol·L-1db-cAMP处理后,N2a细胞中TH和多巴胺水平均显著增强,从而促进多巴胺能神经元的形成[16]。
目前,N2a细胞作为体外研究AD发病机制的常见细胞模型。研究常采用Glu、FA、SiNPs等物质诱导N2a细胞建立AD模型,其模型的诱导物质处理时间大多为24 h。N2a细胞经造模试剂诱导后常出现Aβ沉积、Tau蛋白过度磷酸化、氧化损伤、细胞凋亡等AD样的病理学特征[4-5,7]。具体造模方法见Tab 1。
2.4 大鼠肾上腺嗜铬细胞瘤细胞系大鼠肾上腺嗜铬细胞瘤细胞系(rat phcochromocytoma cell,PC12)来源大鼠肾上腺髓质嗜铬细胞瘤,是一种研究神经细胞生理、病理及药理的理想细胞。该细胞具有一定的神经内分泌属性,其细胞能合成多巴胺及去甲肾上腺素等儿茶酚胺类神经递质,并储存于细胞囊泡中通过胞吐作用释放[17]。同时,PC12细胞膜上具有神经生长因子(nerve growth factor,NGF)受体,经NGF诱导刺激后可转化为具有神经元特性的神经元样细胞,如:PC12细胞突起明显延长、交织,呈现典型神经元形态;细胞抗神经元分化标志微管相关蛋白(microtubule associated protein,MAP)2染色呈强阳性[18]。
PC12细胞常用于神经系统疾病的体外研究。学者常采用Aβ25-35[19]、Glu[4]、H2O2[9]等诱导PC12细胞建立AD细胞模型,其药物处理时间为24 h或48 h。PC12细胞经造模试剂诱导后主要涉及氧化损伤、细胞凋亡等方面。具体造模方法见Tab 1。
2.5 小鼠海马神经元细胞系小鼠海马神经元细胞系(hippocampal neuronal cell line,HT22)是HT4细胞的亚系,HT4细胞是用温度敏感的SV40病毒为抗原筛选出来的永生化的神经细胞,来源于小鼠海马神经元组织[20]。该细胞系具有胆碱能神经元特性,研究发现未分化的HT22细胞也表达了一些胆碱能标志物,如ChAT、胆碱转运蛋白、囊泡乙酰胆碱转运蛋白和毒蕈碱乙酰胆碱受体,但分化的HT22细胞在形态学和神经化学水平上更类似于胆碱能神经元;同时,分化的HT22细胞具有明显的神经突生长,形态上与神经元细胞相似[21]。故研究宜选用分化的HT22细胞建立AD细胞模型。Aβ25-35、Glu、OA常用于诱导HT22细胞系建立细胞凋亡模型,其机制可能与氧化应激、细胞凋亡有关。具体造模方法见Tab 1。
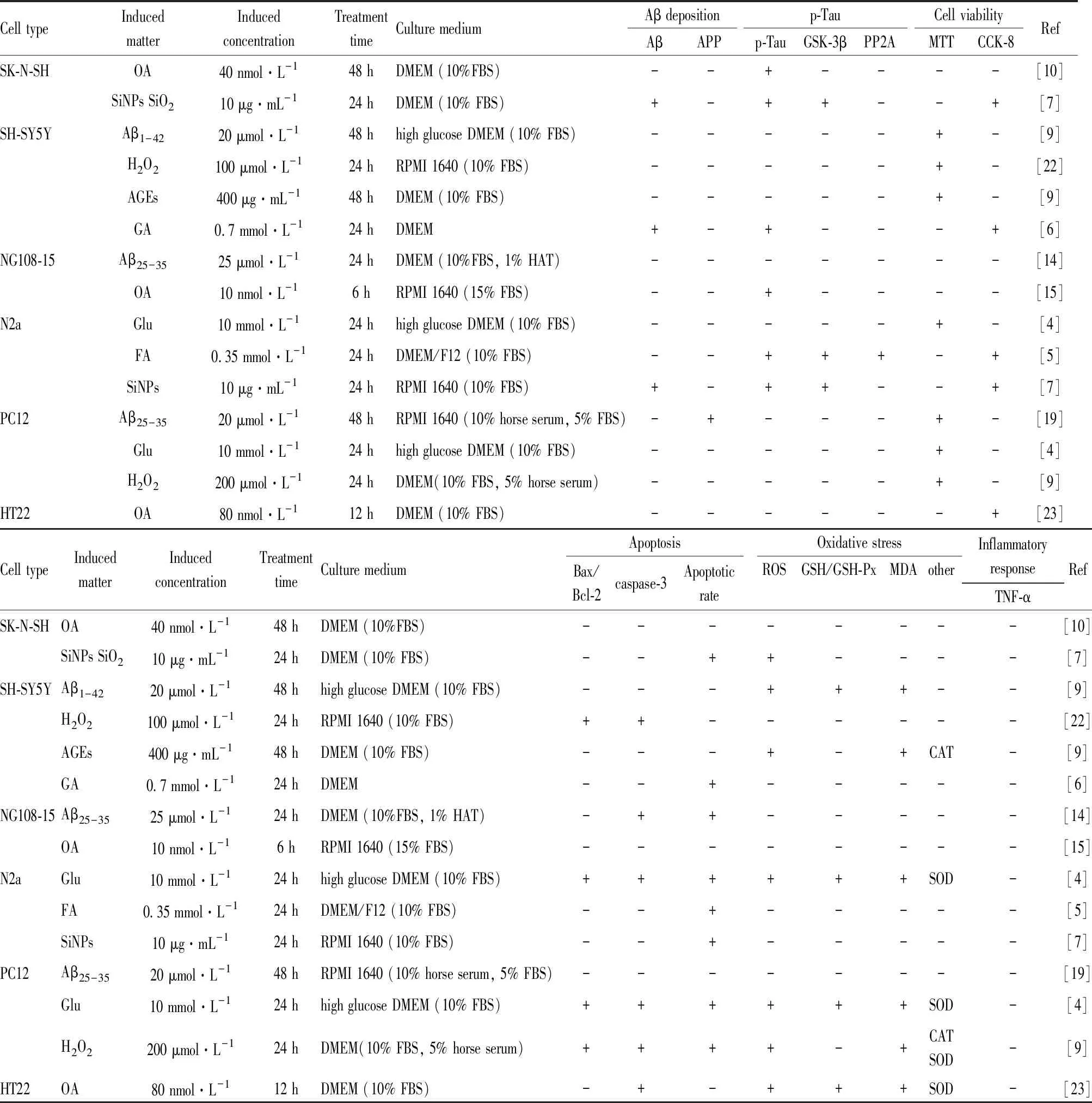
Tab 1 Establishment of AD cellular models and evaluation indicators

Tab 2 Characteristics of AD modeling cells before and after differentiation
3 总结
综上,AD细胞模型是目前研究神经生物学及神经药理学的重要方法,具有来源丰富、干扰因素小、实验条件易控制且评价机制灵活等特点。AD细胞模型可供选择的造模试剂和细胞株种类较多,其造模试剂依据诱导机制的不同分为神经毒性损伤、氧化应激损伤及Tau蛋白过度磷酸化,包括:Aβ、Glu、FA、H2O2等;细胞主要包括人神经母细胞瘤细胞、NG108-15细胞、N2a细胞、PC12细胞等。各细胞来源不同,其常规培养基主要采用DMEM(Dulbecco’s Modified Eagle Medium)、RPMI(Roswell Park Memorial Institute) 1640及DMEM/F12。查阅大量文献研究发现,该类细胞模型主要研究以下机制:(一)细胞调亡,检测其调亡蛋白、凋亡率;(二)细胞氧化应激损伤,检测细胞ROS、GSH、GSH-Px、MDA以及其它氧化指标;(三)炎性反应,检测细胞炎症因子,如TNF-α。
笔者认为,学者可根据研究基础和目的,选择适宜的细胞株和造模试剂建立AD细胞模型。研究常采用Aβ、Glu、H2O2诱导SH-SY5Y和PC12细胞建立AD细胞模型,揭示AD的细胞凋亡、炎性反应、氧化应激损伤等机制。另外,也采用OA诱导细胞模拟AD的Tau蛋白磷酸化机制。目前,未分化和分化的细胞均已用于AD的体外实验。研究发现NG108-15细胞经分化剂分化后表达神经元蛋白和神经胶质蛋白等神经元特性,此外大部分细胞经分化剂分化后神经元特性表达进一步增强,如:SK-N-SH细胞突触伸长;N2a细胞多巴胺能神经元特性增强,具体见Tab 2。因此,当确定是否应将未分化细胞或分化细胞用于特定实验时,应考虑上述性质。笔者认为分化后细胞的形态结构、生化特点及功能特征更接近神经元。同时,分化后的细胞生长更容易培养,如:PC12细胞在分化前贴壁性较差,聚集成团状,呈半漂浮状态,且细胞形态易发生改变;而分化后细胞完全贴壁而不聚集成团状。因此,笔者推荐采用分化后的该类细胞用于研究AD。
此外,基因工程技术也可用于AD细胞模型的构建。目前,基因转染技术转染细胞应用广泛,在一定程度上提高了细胞病理表达的准确性。如人胚肾上皮细胞(HEK293)是一种可表达外源基因的细胞株,常用于转染试验,具有容易转染和容易培养的特点。另外,学者通过APP595/596质粒转染SH-SY5Y细胞建立APP高表达的AD细胞模型,转染后检测到细胞内APP和Aβ的表达均增加[24]。笔者认为将来可基于分子生物学、分子细胞生物学、基因工程等新技术综合构建能快速转染,又最大限度完善表达神经元的生理特点,并能长期稳定生长及培养的细胞模型。除基因转染技术外,诱导性多能干细胞(induced pluripotent stem cells,iPSCs)技术也发展迅速。研究发现iPSCs也用于AD细胞模型的建立,Shi等[25]从AD患者体细胞重新编程产生iPSCs,经分化后获得的神经元表征出了Aβ以及Tau蛋白过度磷酸化等AD早期病理特征;同时,研究发现干细胞也可用于治疗AD或延迟其疾病的发生。
基于所述,目前应用体外构建AD细胞模型的方法较为广泛,但仍有部分问题亟待解决,如:细胞培养过程中各种代谢中间体、离子、血清成分和底物如何影响细胞的生长和分化有待进一步研究;AD细胞模型目前仅采用单一因素诱导细胞,不符合AD病因及病机的复杂性;尚缺乏与临床微观病理特点完全契合的细胞模型建立方法和统一的模型标准评价体系。因此,笔者认为学者在进一步深入研究中应优化现有AD细胞模型建模方法,系统地引入多维度、多致病因素复合的AD细胞模型构建方法,以期为模型标准化评价及基于神经细胞靶向治疗AD的有效途径以及策略提供思路与借鉴。