NLRP3基因敲除增强芹菜素对triton-WR 1339所致高脂血症的降血脂及抗炎作用研究
李钰婷,蔡大可, 郑柳怡,胡子旋,占心佾,刘昌辉,甘海宁,黄雪君,黄丹娥,陈玉兴
(1. 广州中医药大学第五临床医学院,广东 广州 510405;2. 广东省中医药工程技术研究院, 广东 广州 510095;3. 广东省中医药研究开发重点实验室,广东 广州 510095;4. 广州中医药大学临床药理研究所, 广东 广州 510405)
高脂血症是常见的慢性疾病症状,以高胆固醇和高甘油三酯为特征,常见于糖尿病、肥胖、非酒精性脂肪肝等代谢紊乱疾病当中。同时,高脂血症也是动脉粥样硬化和心脑血管病的危险因素[1]。因此,深入了解机体脂质代谢,特别是肝脏脂质代谢机制和关键调控靶点,对于开发降血脂药物具有创新意义。目前的研究表明,高脂血症以及炎症两者关系密切,亦互为因果,共同促进各类代谢性疾病的发生发展[2-3]。换言之,脂质代谢紊乱引起的无菌性炎症,能够进一步引发脂质代谢受阻。点头样受体3(NACHT、LRRand PYD domains-containing protein 3,NLRP3)是炎症小体形成的关键蛋白,能够被脂质代谢紊乱及脂质过氧化物触发激活[4];由此可见,NLRP3是脂质代谢引发疾病发展的关键蛋白,其生物学意义受到国内外学者的关注和探讨[5]。目前,NLRP3介导的内源性炎症对于肝脏脂质代谢的研究越来越深入,已有较多的研究报道NLRP3的激活会导致肝脏细胞脂质转运和代谢的紊乱[3,4,6]。胆固醇 7α-羟化酶(cholesterol 7 alpha-hydroxylase,CYP7A1)是肝脏脂质代谢的关键代谢酶,该代谢酶能够将胆固醇代谢转化为胆汁酸,通过外排至肠道代谢体外。由此可见,CYP7A1是胆固醇逆向转运过程的关键代谢酶,其具有代谢体内胆固醇的作用[7]。在临床研究上,CYP7A1基因突变与血液中低密度脂蛋白和肝脏胆固醇含量过高、胆汁分泌减少等疾病症状有密切关联。由此可见,CYP7A1与脂代谢疾病及后续的心脑血管疾病密切相关,调控CYP7A1的药物也成为国内外学者关注点[8]。但是该代谢酶是否会受到内源性炎症的影响尚未明确。肝脏CYP7A1表达水平主要受到上游肝X受体(liver X receptor,LXR)的调控,由于LXR既是药物调控靶点,又可能会受NLRP3炎症小体的干扰。因此,NLRP3炎症小体能够干预调脂类药物的药理作用,换言之,NLRP3是药物疗效的干扰因素,为了促进调脂药物的研发,NLRP3炎症小体是否干预降血脂药物的机制亟需进一步阐明。
芹菜素(apigenin)具有抗氧化、抗炎和调血脂多种药理作用,提示其在心脑血管疾病中具有一定的科学探讨价值[9],且其具有调控LXR/CYP7A1的潜在作用[10]。最新报道表明,剂量为50 mg·kg-1的芹菜素能够调控高脂血症所致的NLRP3相关信号通路[11]。鉴于NLRP3对于心脑血管疾病有重要意义,该基因是否会影响芹菜素降血脂和抗炎药理作用值得深入探讨。因此,本研究采用低剂量(6.25 mg·kg-1)的芹菜素进行野生型(wildtype,WT)和NLRP3基因敲除小鼠(NLRP3-/-)高脂血症模型进行对比研究。鉴于Triton-WR1339(tyloxapol,TWR)急性动物模型具有致炎和致脂质代谢紊乱的特点,比较适合本课题的研究需求,所以采用该急性模型验证本研究的科学假设。综上所述,本研究拟通过基因敲除手段,探讨炎症小体关键蛋白NLRP3对芹菜素降血脂药物降血脂和抗炎作用的影响。
1 材料与方法
1.1 实验动物SPF级野生型(WT)C57BL/6小鼠30只,♀♂各半,6~8周龄, 体质量(20±2)g;SPF级 NLRP3基因敲除(NLRP3-/-)小鼠30只,♀♂各半,6~8周龄,体质量(20±2)g。C57BL/6小鼠购自于广东省实验动物中心,实验动物质量合格证号:No.44007200054626;NLRP3-/-小鼠受赠于广州中医药大学,在广州中医药大学实验动物中心自行繁殖(购买合同:VRS18005-1),实验操作符合广东省第二中医院实验动物伦理要求及国家相关法律规定。
1.2 药物及试剂芹菜素(成都瑞芬思生物科技有限公司,纯度≥98%);总胆固醇(totalcholesterol,TC)、总甘油三脂(totaltriglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒(A110-1-1,南京建成生物工程研究所);Triton-WR 1339(MKCC6730,USA);4%组织细胞固定液(80G001370,北京鼎国昌盛生物技术有限责任公司);总RNA提取试剂TRIzon(康为世纪生物科技有限公司);ELISA试剂盒(433180409,天津安诺瑞康生物技术有限公司);EB替代品(北京普利来基因技术有限公司);琼脂糖(111860,Gene Company Ltd);电泳缓冲液;SYBRgreen试剂盒(TaKaRa,Japan)。
1.3 仪器JJ3000动物电子秤,G&G公司产品;显微镜(Olympus DP72);BS224S电子天平(1/万),德国SARTORIUS产品; 5424型小型高速离心机,德国 Eppendorf 公司产品;-80 ℃ 超低温冰箱,美国Thermo公司产品;Bio-RAD 全自动酶标仪,美国伯乐公司产品;, IQ5 荧光定量 PCR仪,均购自美国伯乐公司;水平电泳仪,ChemiDoc XRS+凝胶成像系统(上海天能公司);微波炉。
2 方法
2.1 药物配置按照小鼠给药量(200 kg·L-1)称取相应量的Triton WR 1339,加入相应量的生理盐水,用玻璃棒直接搅拌溶解成浓度为120 g·L-1的溶液。
2.2 实验动物分组及给药剂量实验动物分组:将30只C57BL/6小鼠和30只NLRP3基因敲除小鼠分别随机分为3组,每组10只,♀♂各半。分别为正常组(control)、模型组(TWR)、芹菜素组(APG,6.25 g·L-1)。APG组连续灌胃给药5 d,其他组小鼠灌胃给予蒸馏水,每天1次。在给药d3下午除正常组外,均肌肉注射TWR溶液(0.12 g·L-1),36 h后收集样本。样本收集前12 h禁食,在最后1次给药后1 h,小鼠眼眶取血收集血样,后处死小鼠,取约50 mg肝脏置于4%组织细胞固定液中用于HE染色;取约200 mg肝脏置于1.5 mL EP管中用于检测相关指标。
2.3 血清生化指标检测将血样离心,10 000 r·min-1,离心5 min,取上清置于1.5 mL EP管中。根据试剂盒说明书步骤检测血清中TC、TG、HDL-C、LDL-C含量,通过全自动酶标仪进行测定。
2.4 肝脏组织切片将置于4%组织细胞固定液的肝脏进行切片,包埋,进行HE染色,切片在显微镜下检查,观察肝脏切片病理变化。
2.5 ELISA检测血清炎症指标根据ELISA说明书步骤测定血清中单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、白细胞介素-1β(interleukin-1β,IL-1B)、白细胞介素-6(interleukin-6,IL-6)含量,用全自动酶标仪测定D450值,并根据所绘制的标准曲线计算相应浓度值。
2.6 琼脂糖凝胶电泳验证NLRP3基因敲除小鼠0.8 g琼脂糖加入80 mL DNA电泳缓冲液,微波炉加热1 min,冷却到50~60 ℃加入EB替代品,将溶液倒入模具制胶,将胶放入电泳槽,在孔中加入NLRP3基因扩增后产物,电压110V电泳30 min。在紫外灯灯下读取结果并拍照。
2.7 RT-qPCR法检测相关基因的表达根据总RNA提取试剂盒步骤提取肝脏总RNA,逆转录合成cDNA,以cDNA为模板,荧光定量PCR检测各基因的表达。PCR引物由上海捷瑞生物工程有限公司合成。序列如Tab 1所示。

Tab 1 Primer sequences for related genes in RT-qPCR
3 结果
3.1 琼脂糖水平电泳验证NLRP3基因敲除小鼠由Fig 1可见,与WT小鼠相比较,在200 bp附近,NLRP3-/-小鼠肝脏组织未能扩展出明显的电泳条带。而WT小鼠肝脏cDNA中能够扩展出相应的条带;该实验验证NLRP3-/-小鼠。
3.2 芹菜素对WT和NLRP3-/-急性高血脂模型小鼠的抗炎作用如Tab 2~4所示,芹菜素明显降低NLRP3-/-模型血清炎症相关指标IL-1β、IL-6和MCP-1的含量(P<0.05),而在WT模型中未见明显差异。

Fig 1 Agarose electrophoretogram of PCR amplified products
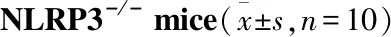

GroupDose/g·L-1IL-1β/ng·L-1WTNLRP3-/-Control-438.04±59.25422.29±28.91TWR-490.93±40.94∗450.24±34.31∗APG6.25471.15±52.93382.62±17.32#
*P<0.05vscontrol;#P<0.05vsTWR
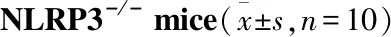

GroupDose/g·L-1IL-6/ng·L-1WTNLRP3-/-Control-68.46±6.9674.62±4.55TWR-84.19±10.40∗89.93±11.29∗APG6.2584.7275.29±9.61#
*P<0.05vscontrol;#P<0.05P<0.01vsTWR
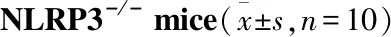
GroupDose/g·L-1MCP-1/ng·L-1WTNLRP3-/-Control-268.07±31.56263.09±39.63TWR-296.32±42.03∗297.43±62.91∗APG6.25255.31±38.42198.65±40.01##
*P<0.05vscontrol;##P<0.01vsTWR
3.3 芹菜素对WT和NLRP3-/-急性高血脂模型小鼠的降血脂作用如Fig 2所示,TWR显著性地升高两个模型的血脂水平(P<0.01),且在NLRP3-/-模型中,芹菜素可逆转这一现象,明显降低血清中TC、TG、LDL-C的含量(P<0.05),升高HDL-C的含量(P<0.05)。但在WT模型组并未见明显变化。
3.4 芹菜素对WT和NLRP3-/-急性高血脂模型小鼠肝脏病理的影响如Fig 3所示,TWR可导致WT模型和NLRP3-/-模型小鼠肝脏细胞排列不规律,细胞空泡样病变,炎性细胞浸润等变化;但在给予芹菜素后,NLRP3-/-模型小鼠的肝脏细胞形态明显改善,细胞空泡样病变和炎性细胞浸润均明显减少。

Fig 2 Effect of APG on serum IL-1β, IL-6, HDL-C and LDL-C in WT and NLRP3-/-
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsTWR
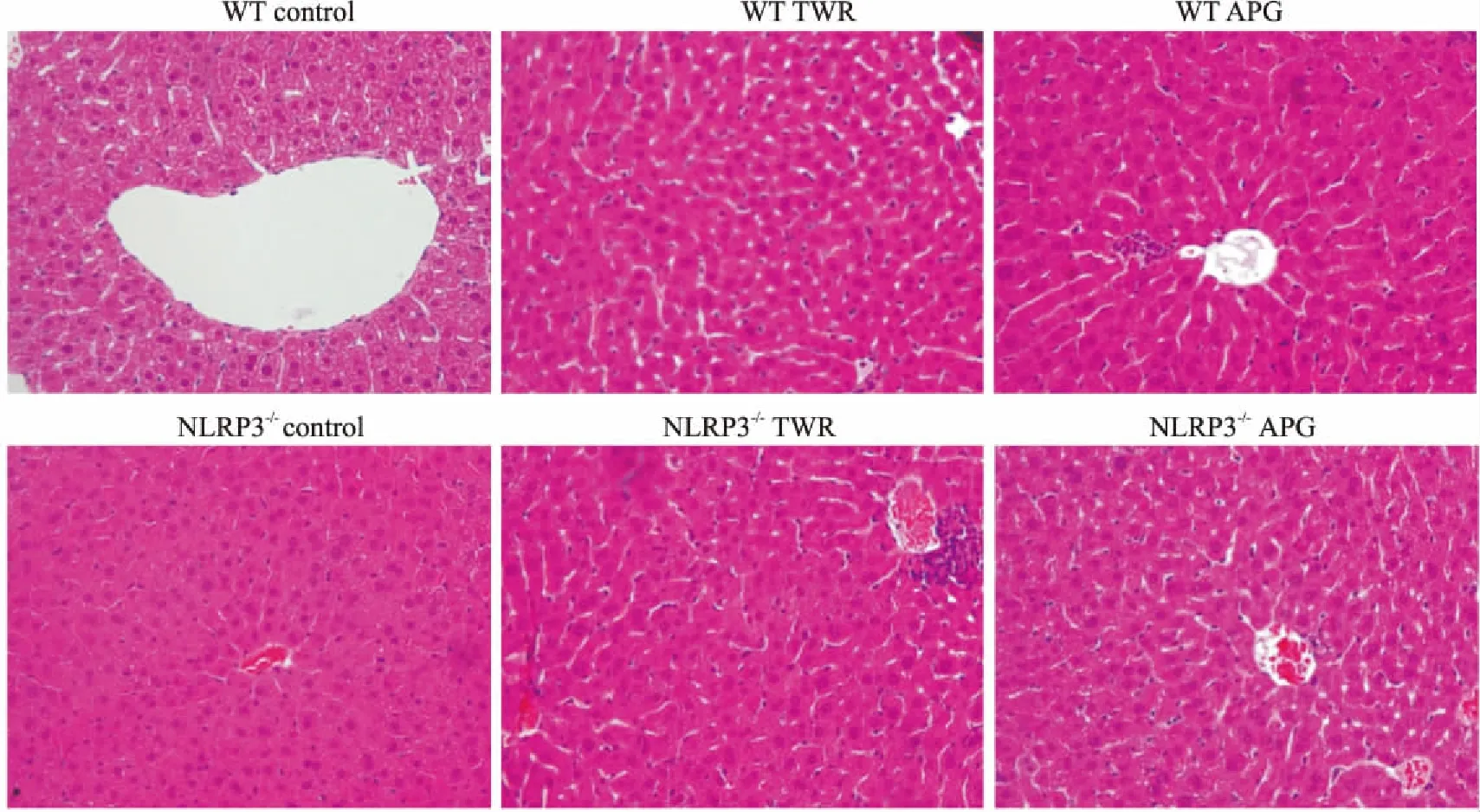
Fig 3 Effect of APG on hepatic pathology in WT and NLRP3-/- mice
3.5 芹菜素对WT和NLRP3-/-急性高血脂模型小鼠肝脏炎症及脂质代谢基因表达的调控如Fig 4所示,TWR明显升高两个模型炎症相关因子和降低脂质相关转运蛋白mRNA表达水平(P<0.05);在给予芹菜素后, 明显降低NLRP3-/-模型小鼠肝脏中IL-4、ASC、FGF21和升高CYP7A1、vLDLR和CD36的mRNA表达水平(P<0.05);而在WT模型中,芹菜素仅降低ASC和升高vLDLR、CD36的mRNA表达水平(P<0.05),对IL-4、FGF21和CYP7A1并无明显作用。
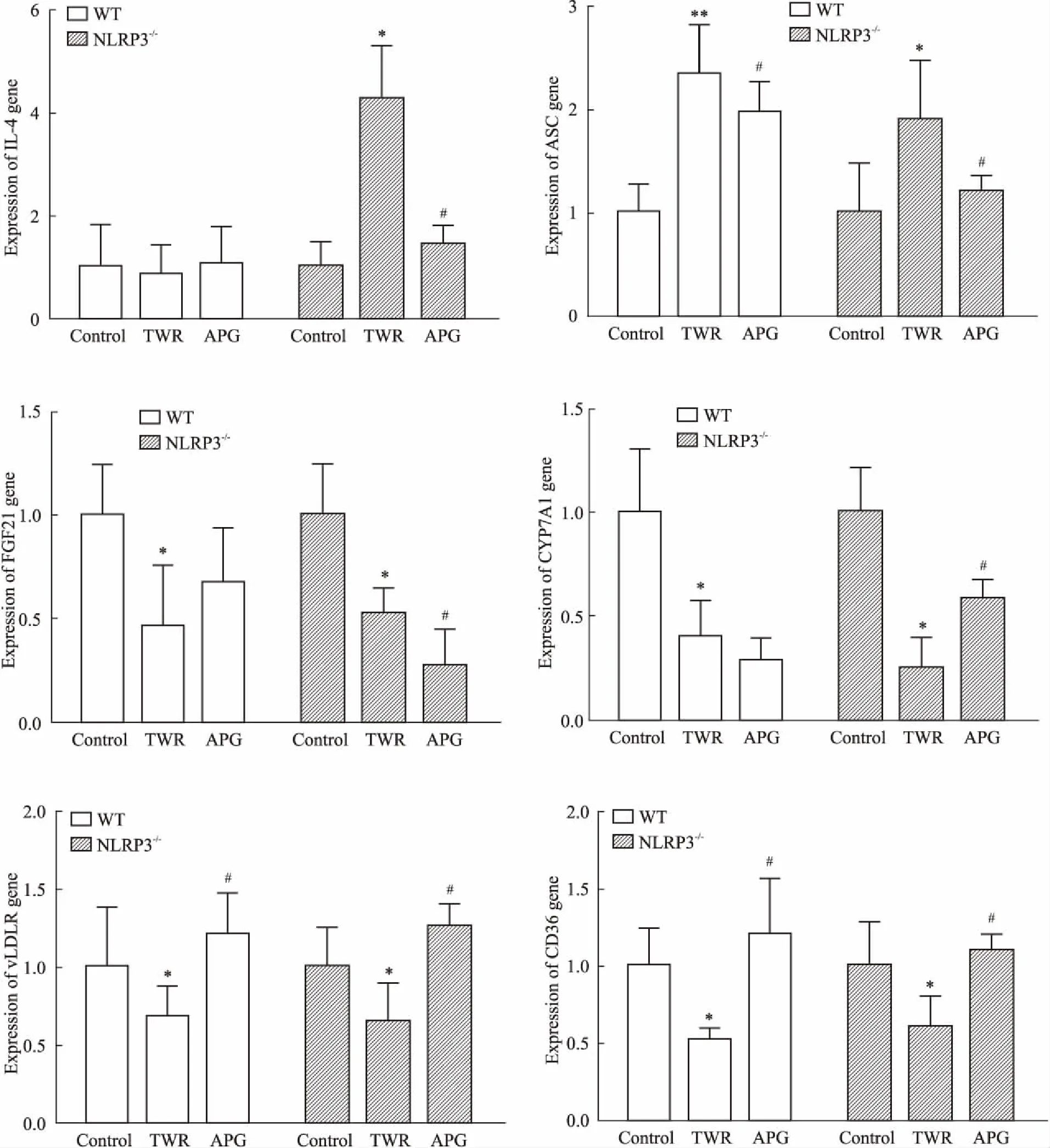
Fig 4 Effect of APG on hepatic mRNA expression of inflammation and lipid metabolism in
*P<0.05,**P<0.01vscontrol;#P<0.05,##P<0.01vsTWR
4 讨论
芹菜素作为国内外学者研究报道较多的化合物,具有多种药理活性及调控多种信号转导通路的特点,特别是调血脂及抗炎的药理作用,被应用于阐述其治疗代谢性疾病的关键机制。但是对于其确切的疗效和优越性,目前仍存在着较多的争议。本研究分别采用TWR致高脂血症WT和NLRP3-/-小鼠模型,对低剂量的芹菜素(6.25 mg·kg-1)呈现差异性的作用。低剂量的芹菜素只有在NLRP3敲除小鼠才能呈现显著的降血脂及抗炎作用,说明NLRP3或者其生理功能干预低剂量芹菜素的降血脂药效。鉴于炎症与降脂药物调血脂作用有相互作用,NLRP3介导的炎症及纤维细胞生长因子21(fibroblast growth factor 21,FGF21)对负性调控芹菜素药效有关。
相对已有文献报道,本研究采用的芹菜素(6.25 mg·kg-1)为较低的给药剂量,所以对TWR所致的高脂血症模型的降血脂作用并不显著。PCR结果提示,虽然该剂量对肝脏摄取脂蛋白(如极低密度脂蛋白受体,vLDLR)和胆汁酸外排相关的基因(如脂肪酸转运蛋白CD36)都有上调作用,但却未能改善TWR所致血清中高TC和高TG。芹菜素未能恢复造模所致的胆固醇关键代谢酶CYP7A1表达抑制,鉴于CYP7A1在胆固醇逆向转运(reverse cholesterol transport,RCT)中关键的脂质代谢酶,能够将胆固醇代谢为胆汁酸,促进血脂胆固醇在肝脏代谢并以胆汁酸排到肠。因此,CYP7A1的表达抑制导致其降血脂作用受到一定程度上的限制。在NLRP3敲除后,芹菜素能够上调模型所致的CYP7A1的表达,同时呈现显著的降血脂作用。这些结果充分说明,CYP7A1的表达水平或其活性与芹菜素降脂作用有密切相关。反之,芹菜素调控CYP7A1的作用会被NLRP3介导炎症小体抵消。NLRP3介导的炎症小体很可能通过肝脏固有免疫细胞(例如kupffe细胞),从而影响肝细胞的脂代谢功能。具体而言,固有免疫细胞通过NLRP3分泌细胞因子,包括本研究促炎因子(MCP-1、IL-1B、IL-6)和抗炎调控因子(IL-4),影响CYP7A1的转录水平及药物调控作用。芹菜素具有多种药理作用,具有降血脂作用是当中一个药理活性,但由于其对多种脂质代谢靶点(胆固醇逆向转运过程)的调控作用不强,其作用会受到机体其他因素(例如炎症、内源性代谢物FGF21)的影响,使得其药效未能如非诺贝特类或者他汀类降脂药物的明显。本研究的结果提示,对NLRP3具有一定抑制作用的天然化合物与芹菜素配伍,可能发挥药物的协同增效作用,从而体现中药多成分的优势。
本研究发现[12],NLRP3基因敲除后,芹菜素下调成纤维生长因子21(FGF21)表达水平,同时上调CYP7A1的表达。芹菜素对于这两个基因的调控仅在NLRP3敲除模型可见,一方面说明NLRP3对于CYP7A1的调控属于负性调控机制,该发现与现有文献报道一致。另外一方面,低剂量的芹菜素未能抵消Triton-1339W所致的NLRP3激活,导致在WT模型小鼠无明显的降血脂效果。因此,我们推测NLRP3的激活、FGF21的分泌以及CYP7A1表达抑制主要是由肝脏固有免疫细胞Kupffer细胞通过NLRP3信号通路分泌炎症因子及FGF21类激素物质[13],进而调控肝细胞脂质代谢、炎症、修复的发生。因此,调控Kupffer细胞免疫中的NLRP3将是调脂药物和消除炎症的新靶点。
本研究仅限于对NLRP3敲除基因后芹菜素降血脂药效、抗炎及调控CYP7A1的转录水平的探讨,继而初步验证NLRP3在芹菜素药效的干预作用,但是具体参与调控细胞以及NLRP3相关的机制还有待深入挖掘。