G蛋白信号调节因子6对心肌细胞肥大的作用及机制研究
舒婧娴,陆 瑶,蔡菁菁,鄢光宇,陈子莹,刘媛媛,袁 洪
(1. 中南大学湘雅三医院临床药理中心,湖南 长沙 410013;2.中山大学附属第五医院药学部,广东 珠海 519000;3. 中南大学湘雅三医院心内科,湖南 长沙 410013)
心肌肥厚是不同病因所致进展性心衰共同的病理生理环节,是增加心衰等心血管疾病死亡的独立危险因子[1]。《中国心血管病报告2018》显示我国心血管疾病的患病人数2.9亿人,由其引发的死亡占居民疾病死亡构成的40%以上、居首位[2]。心肌肥厚的主要原因包括心肌细胞变性、肥大等,在心肌细胞病理变化的过程中,不同的胞膜受体启动相应信号通路,构成细胞内复杂的信号调控网络[3],引起肥大相关基因和心肌细胞表型的变化。
目前研究发现,G蛋白信号调节因子(regulators of G-protein signaling,RGS)家族成员通过RGS结构域与G蛋白结合,加速G蛋白的活性降解而发挥生理病理调节作用[4],其中部分RGS因子通过该结构域发挥抑制心肌细胞肥大的作用[5]。RGS6是RGS蛋白家族重要成员之一,它包含3个主要结构域:RGS、DEP/DHEX和GGL。RGS结构域具有G蛋白信号调节的作用,DEP与RGS6的细胞质膜定位有关,GGL结构域使G蛋白复合物与跨膜受体迅速解离,因此它是RGS蛋白家族中唯一具有G蛋白信号调节和非G蛋白信号调节双重功能的成员[6]。RGS6在心脏中可通过负性调控毒蕈碱受体偶联的G蛋白使其失活,发挥调节心脏自律性的作用[7]。Yang等[8]发现RGS6通过调控线粒体中活性氧(reactive oxygen species,ROS)-共济失调毛细血管扩张突变基因/p53基因(非G蛋白信号通路)介导多柔比星的心肌毒性反应。近年研究发现线粒体在心肌细胞肥大的病理过程中发挥关键作用,线粒体通过产生ROS并激活下游丝裂原活化蛋白激酶家族(mitogen-activated protein kinase,MAPK)促进心肌细胞肥大[9]。细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)、c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK1/2)、p38均属于MAPK家族成员,可以传递ROS对心肌细胞肥大的调控作用,但不同刺激因素激活的具体MAPK信号通路仍有待研究[10-11]。
本研究前期用血管紧张素Ⅱ(angiotensin II,Ang Ⅱ)构建心肌细胞肥大模型,发现RGS6表达明显增加,提示RGS6可能是另一个RGS家族中与心肌细胞肥大相关的重要成员,但RGS6致心肌细胞肥大的作用有待进一步证实,其调控心肌肥厚的作用机制目前亦不清楚。本研究拟围绕RGS6调控心肌细胞肥大的作用及机制,通过慢病毒构建RGS6过表达和抑制表达的细胞模型,研究RGS6表达对心肌细胞肥大的影响,探讨RGS6调控ROS-MAPK信号通路中ERK1/2、JNK1/2、p38的变化,为干预心肌肥厚的新靶点提供实验依据。
1 材料与方法
1.1 主要材料和试剂特级胎牛血清(Gibco,10099-141)、DMEM/高糖培养基(HyClone,SH30022.01)、0.25%胰蛋白酶Trypsin-EDTA(Gibco,25200056)、AdRGS6和AdGFP慢病毒(汉恒生物科技有限公司,15011243)、AdshRGS6和AdshRNA慢病毒(汉恒生物科技有限公司,11090124)、血管紧张素Ⅱ(Sigma,A9525)、二联苯碘DPI (Sigma,D2926)、二甲基亚砜DMSO(Sigma,D2650)、兔抗RGS6抗体(Abcam,ab128943)、兔抗ERK1/2抗体(Abcam,ab184699)、兔抗p-ERK1/2抗体(Signaling Antibody,12082)、兔抗p38抗体(Abcam,ab170099)、兔抗p-p38抗体(Abcam,ab195049)、兔抗JNK1/2抗体(Signaling Antibody,21504)、兔抗p-JNK抗体(Signaling Antibody,12345)、兔抗GAPDH抗体(Bioworld Technology,AP0066)、山羊抗兔IgG抗体(Abcam,ab6721)、鬼笔环肽(Invitrogen,F36924)、DAPI(Invitrogen,S36939)、活性氧检测荧光探针-DHE(北京百奥莱博科技有限公司,KFS377)。
1.2 主要仪器生物安全柜(苏州苏净安泰AIRTECH有限公司)、实时荧光定量PCR仪和凝胶成像系统(美国伯乐Bio-Rad公司)、PCR扩增仪(Applied Biosystems公司)、恒温培养箱(美国Thermo公司)、倒置荧光显微镜(奥林巴斯IX71)、电泳仪(上海天能科技有限公司)、冷冻离心机和移液枪(艾本德Eppendorf公司)、CLARIOstar全波长扫描荧光酶标仪(德国BMG LABTECH公司)
1.3 心肌细胞培养与肥大刺激取大鼠H9C2心肌细胞,加入胰蛋白酶消化、离心后取底部细胞团块并加入新鲜培基,六孔板接种细胞,培养过夜。分配好实验组和对照组后,次日在实验组中加入终浓度为0.1 μmol·L-1Ang Ⅱ,对照组加入等量的PBS。
1.4 慢病毒感染细胞及其干预采用携带大鼠RGS6基因的慢病毒(AdRGS6)、携带ZsGreen绿色荧光蛋白基因的慢病毒(对照组:AdGFP)、携带大鼠RGS6短发卡序列的慢病毒(AdshRGS10)和带空白RNA序列的慢病毒(对照组:AdshRNA)对心肌细胞进行感染。取培养好的心肌细胞并加入polybrene使其终浓度为6 mg·L-1,孵育,替换新鲜培养基后加入100 μL对应病毒感染。
1.5 实验分组① AdGFP/PBS组;② AdRGS6/PBS组;③ AdGFP /Ang Ⅱ组;④ AdRGS6/Ang Ⅱ组;⑤ AdshRNA/PBS组;⑥ AdshRGS10/PBS组;⑦ AdshRNA/Ang Ⅱ组;⑧ AdshRGS6/Ang Ⅱ组。
1.6 细胞免疫荧光染色和细胞大小检测取1.4中的心肌细胞,用质量分数为4%的多聚甲醛固定15 min,弃去并洗净后加入5 mg·L-1的鬼笔环肽室温染色60 min,等渗溶液清洗细胞,再用DAPI染细胞核10 min,封片,荧光显微镜下观察细胞形态和大小,Image J软件统计心肌细胞面积。
1.7 心肌细胞内ROS测定取1.4中各组细胞,采用活性氧检测荧光探针-二氢乙啶(DHE)检测各组细胞中ROS含量。加入稀释后的荧光探针,使探针的终浓度为10 μmol·L-1,避光、孵育60 min,采用酶标仪检测细胞ROS水平。
1.8Westernblot提取1.4中各组心肌细胞的总蛋白,用10 μL蛋白上样、电泳,电转移蛋白至PVDF膜,用质量分数为5%的脱脂奶粉封闭,缓冲盐溶液(TBST)洗涤后孵相应的一抗过夜。TBST洗涤3次后,加入二抗、室温孵育2 h,清洗膜后加ECL 超敏发光液进行蛋白条带显影,用Image Lab分析各条带的灰度值。
1.9RT-PCR采用TRIzol法提取各组心肌细胞中的总RNA并检测总RNA的浓度。使用逆转录试剂合成cDNA,取各组cDNA进行ANP、BNP和GAPDH的RT-PCR反应。引物序列见Tab 1。

Tab 1 RT-PCR primers
1.10 逆转实验将感染AdRGS6和AdGFP慢病毒的心肌细胞用终浓度为0.1 μmol·L-1的二联苯碘DPI处理2 h(对照组加入等量二甲基亚砜处理2 h),然后各组加入终浓度为0.1 μmol·L-1的Ang Ⅱ处理24 h。分为四组:AdGFP/Ang Ⅱ/二甲基亚砜(DMSO)、AdRGS10/Ang Ⅱ/DMSO、AdGFP/Ang Ⅱ/ROS抑制剂(DPI)、AdRGS10/Ang Ⅱ/DPI。
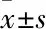
2 结果
2.1 RGS6过表达/抑制表达对心肌细胞大小的影响用Ang Ⅱ和PBS分别处理已转染慢病毒的心肌细胞,于荧光显微镜(×400)下观察细胞面积,随机圈出各组20个细胞,计算细胞面积并取平均值。与AdGFP/PBS组相比,AdRGS6/Ang Ⅱ组和AdGFP/Ang Ⅱ组细胞面积均明显增加(1 889±182vs4 761±232、1 889±182vs3 520±407,n=20,P<0.05);AdRGS6/Ang Ⅱ组心肌细胞面积明显大于AdGFP/Ang Ⅱ组(4 761±232vs3 520±407,n=20,P<0.05)(Fig 1)。

Fig 1 Effects of RGS6 overexpression on cardiomyocyte surface areas

与AdshRNA/PBS组相比,AdshRNA/Ang Ⅱ组细胞表面积明显增加(1 899±94vs3 720±717,n=20,P<0.05)。AdshRGS6/Ang Ⅱ组与AdshRNA/Ang Ⅱ组相比细胞表面积降低(2 097±83vs3 720±717,n=20,P<0.05)(Fig 2)。提示RGS6会促进Ang Ⅱ诱导的心肌细胞面积增加。
2.2 RGS6过表达/抑制表达对心肌细胞肥大相关因子的影响Ang Ⅱ处理后,AdGFP/Ang Ⅱ组和AdRGS6/Ang Ⅱ组相比对照组AdGFP/PBS肌肥厚相关因子表达均明显上调(ANP: 4.21±0.30vs1.02±0.07及6.41±0.42vs1.02±0.07,n=3,P<0.05;BNP:3.93±0.55vs0.95±0.05及5.33±0.32vs0.95±0.05,n=3,P<0.05);与AdGFP/Ang Ⅱ 相比,AdRGS6/Ang Ⅱ组中ANP和BNP的表达均明显增加,P<0.05(Fig 3)。

Fig 2 Effects of RGS6 knockdown-expression on cardiomyocyte surface areas

AdshRNA/Ang Ⅱ组相比对照组AdshRNA/PBS,ANP和BNP表达均明显上调(4.33±0.32vs0.96±0.05,n=3,P<0.05;3.92±0.31vs0.97±0.05,n=3,P<0.05);与AdshRNA/Ang Ⅱ 相比,AdshRGS6/Ang Ⅱ组中ANP和BNP的表达均明显降低(4.33±0.32vs2.34±0.30,n=3,P<0.05;3.92±0.31vs1.79±0.18,n=3,P<0.05)(Fig 3)。结果表明RGS6会促进心肌细胞肥大相关因子的表达。

Fig 3 Effects of RGS6 over/knockdown-expression on hypertrophic factors

2.3 RGS6过表达/抑制表达对信号通路的影响AdRGS6/Ang Ⅱ组和AdGFP/Ang Ⅱ组中ROS(5.77±0.22vs0.99±0.11、2.72±0.25vs0.99±0.11,n=3,P<0.05)和p-JNK1/2蛋白(2.17±0.06 vs 1.00±0.05、1.68±0.11vs1.00±0.05,n=3,P<0.05)均明显高于对照组AdGFP/PBS,且差值有统计学差异;与AdGFP/Ang Ⅱ组相比,AdRGS6/Ang Ⅱ组中ROS(2.72±0.25vs5.77±0.22,n=3,P<0.05)和p-JNK1/2蛋白(1.68±0.11vs2.17±0.06,n=3,P<0.05)明显升高,p38和ERK1/2总蛋白和磷酸化蛋白表达无差异(各组ROS含量如Fig 4,各组信号通路蛋白水平如Fig 5)。
Ang Ⅱ刺激48 h后,AdshRNA/Ang Ⅱ组ROS(3.16±0.15vs1.05±0.10,n=3,P<0.05)和p-JNK1/2蛋白(2.03±0.13vs1.02±0.08,n=3,P<0.05)明显高于对照组AdshRNA/PBS,且差值有统计学差异;与AdshRNA/Ang Ⅱ组相比,AdshRGS6/Ang Ⅱ组中ROS(3.16±0.15vs1.71±0.11,n=3,P<0.05)和p-JNK1/2蛋白(2.03±0.13vs0.71±0.07,n=3,P<0.05)水平明显降低。(各组ROS含量如Fig 6,各组信号通路蛋白水平如Fig 7)。结果表明RGS6会促进心肌细胞中ROS和p-JNK1/2蛋白水平的增加,提示RGS6可能通过激活ROS/JNK1/2信号通路介导心肌细胞肥大。

Fig 4 Effects of RGS6 overexpression on reactive oxygen species(ROS) levels

2.4 ROS抑制剂干预后RGS6对心肌细胞肥大和信号通路的影响AdRGS6/DPI组心肌细胞表面积较AdRGS6/ DMSO组明显降低(2 995±84vs4 670±288,n=20,P<0.05)。DPI处理后的AdGFP组和AdRGS6组,心肌细胞表面积无统计学差异(2 889±84vs2 995±84,n=20,P<0.05),表明抑制ROS水平可以降低RGS6过表达导致的心肌细胞面积增加(Fig 8)。

Fig 5 Effects of RGS6 overexpression on MAPK signaling pathway

AdRGS6/DPI组的p-JNK1/2蛋白较AdRGS6/ DMSO组明显降低(1.39±0.09vs2.13±0.06,n=3,P<0.05),两组间p-p38和p-ERK1/2蛋白差异无显著性。DPI处理后的AdGFP组和AdRGS6组,p-JNK1/2蛋白无统计学差异(1.25±0.05vs1.39±0.09,n=3,P>0.05)(Fig 9),表明抑制ROS水平可抑制其下游JNK1/2信号通路的激活,提示RGS6通过调控ROS/JNK1/2通路介导心肌细胞肥大。
3 讨论
心肌肥厚是增加心血管疾病死亡率和发病率的独立危险因子[1]。抑制心肌肥厚的发生发展可明显降低心衰等心血管疾病导致的死亡率。近年来,RGS家族因子作为G蛋白活性的调节因子备受关注,研究显示其通过加速G蛋白的失活、阻断G蛋白下游心肌细胞肥大相关信号通路,发挥抑制心肌细胞肥大的作用[5,12]。

Fig 6 Effects of RGS6 knockdown-expression on ROS levels

RGS6除具有RGS家族的G蛋白活性调节功能外,还具有细胞质膜定位、调控G蛋白与跨膜受体解离等功能,因此RGS6具有G蛋白和非G蛋白双重信号调节功能[6]。本研究发现RGS6通过调控ROS/JNK1/2信号通路来介导心肌细胞肥大。我们的推断思路为:与RGS其他家族因子相比,RGS6对心肌细胞肥大的调控作用完全相反(RGS6促进心肌细胞肥大),提示RGS6不是通过G蛋白信号调节作用介导心肌肥厚。相关文献表明,RGS6在肿瘤疾病领域中能通过调控氧化应激反应,介导肿瘤细胞的凋亡[8]。而且,在心肌肥厚的相关机制中也存在氧化应激介导的相关反应,再通过氧化应激等作用刺激下游MAPK家族的成员,完成心肌细胞中整个肥大反应过程。因此我们检测了心肌细胞中ROS以及MAPK信号通路成员(JNK1/2、ERK1/2、p38)的表达,再通过烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide—adenine dinucleotide phosphate, NADPH)氧化酶抑制剂降低ROS表达,检测细胞肥大表型和下游MAPK家族的成员的变化,进一步验证RGS6通过调控ROS/JNK1/2信号通路介导心肌细胞肥大。

Fig 7 Effects of RGS6 knockdown-expression on MAPK signaling pathway

ROS是细胞内一系列氧化反应的产物,近年来研究证明ROS可作为第二信使,参与心肌细胞肥大和凋亡、肿瘤细胞的增殖等多种信号的传导。在心肌细胞中,ROS通过多重途径调节细胞的增殖与凋亡,并且在心肌肥厚到心衰的病理过程中发挥关键作用[13]。研究发现在肥大心肌细胞中 NADPH氧化酶活性增加且会激活敏感型激酶MAPK中的各亚家族,目前的众多研究显示心肌细胞中ROS主要通过触发心肌肥厚相关的以下几条通路发挥作用:① Ang Ⅱ激活的细胞MAPK信号通路[10]和NF-κB信号通路;② 肾上腺素和Ang Ⅱ激活的ERK1/2通路[14];③ 机械刺激诱导的MAPK家族中各亚型变化[5]。综合以上研究表明NADPH酶源性ROS在心肌细胞的肥大和凋亡中发挥重要作用,同时本研究也发现RGS6过表达能增加心肌细胞内ROS的释放,促进Ang Ⅱ刺激的心肌细胞肥大和心肌肥厚相关蛋白ANP、BNP的表达。关于ROS的下游信号通路,我们亦通过检测MAPK家族成员总蛋白和磷酸化蛋白的表达情况,发现ROS会调控下游JNK1/2蛋白的变化。
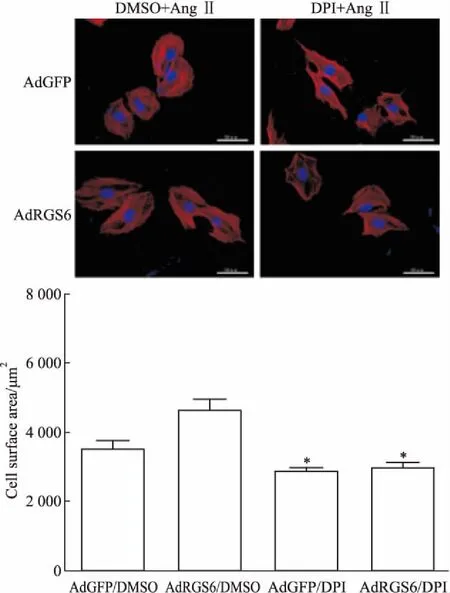
Fig 8 Effects of diphenyleneiodonium(DPI) on RGS6 overexpression cardiomyocyte surface
Twenty cells were measured for each group. DPI was the inhibitor of ROS, dimethyl sulfoxide(DMSO) was the control group.*P<0.05vsthe AdRGS6/DMSO group.
在心肌细胞肥大信号通路中,ROS-MAPK信号通路近年逐渐被重视。研究发现G蛋白偶联受体激动剂如Ang Ⅱ和肾上腺素等与细胞膜上受体结合、刺激ROS的产生,从而参与激活MAPK家族成员。Guo等[15]研究发现在心肌细胞肥大过程中ROS/JNK1/2信号通路发挥重要作用。基于以上研究报道和我们的信号通路检测中发现,在Ang Ⅱ诱导的心肌细胞肥大病理过程中,RGS6通过激活ROS/JNK1/2信号通路促进心肌细胞肥大。本研究为干预心肌细胞肥大的新靶点提供理论和实验依据,有助于研究心肌肥厚的新型发病机制。
Fig 9 Effects of diphenyleneiodonium(DPI) on MAPK signaling pathway of RGS6 overexpression cardiomyocytes after Ang Ⅱ
The results are representative of three independent experiments. DPI was the inhibitor of ROS, and DMSO was the control group.*P<0.05vsthe AdRGS6/DMSO group. n.s. represents that there were no significant difference between the two groups.