荧光腹腔镜下小鼠胃癌可视化成像的实验研究*
刘长旭 贺 余 刘 昶
(哈尔滨医科大学附属第四医院普外科,哈尔滨 150001)
胃癌是常见的恶性肿瘤,预后较差。我国是胃癌高发国家,发病和死亡数均约占世界的50%[1]。尽管医学水平在不断进步,腹腔镜胃癌根治术也日趋成熟[2,3],但由于淋巴管是胃癌转移的常见途径,如果淋巴结清扫不彻底,极易发生复发与转移[4],腹腔镜手术胃癌的复发率、转移率较开腹手术并未显著下降[5]。
人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)蛋白在胃癌组织中高表达,且胃癌的原发灶与转移的淋巴结中HER-2蛋白所表达的状态具有高度的一致性[6,7],因此,HER-2可以为胃癌的靶向治疗提供良好的依据[8]。量子点作为新兴的纳米荧光探针材料,因优良的光学特性被广泛地应用于生物学标记[9,10]。若将HER-2作为胃癌的治疗靶点,利用量子点纳米荧光探针对其进行标记,癌肿范围以及转移的淋巴结便可以准确地被标记出来。利用改装后的荧光腹腔镜直视下根据组织散发的荧光更好地辨认肿瘤及转移的淋巴结,还可以显示常规腹腔镜难以觉察的其他组织转移,最终可以在术中荧光导航辅助下精准切除肿瘤。Metildi等[11]进行小鼠胰腺肿瘤的荧光腹腔镜成像,Murayama等[12]应用5-盐酸氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)标记人体胃癌进行荧光腹腔镜下分期。本研究旨在找到能与胃癌组织特异性结合的荧光探针,在术中实时观察肿瘤形态,为肿瘤精准切除提供导航辅助。
1 材料与方法
1.1 实验材料
胃癌细胞株NCI-N87购买于武汉普诺赛生命科技有限公司。由量子点和HER-2单克隆抗体结合制成的量子点纳米荧光探针由杭州纳晶科技有限公司提供),裸鼠(18~22 g)购买自北京维通利华实验动物技术有限公司[批文号:SCXK(京)2016-0006]。
1.2 组建荧光腹腔镜系统
以Olympus公司VISERA OTV-S190作为主机,匹配VISERA CLV-S190光源和OEV262H显示器,使用天津博朗科技发展有限公司腔镜镜头(直径2.7 mm)作为观察裸鼠腹腔的成像设备,与主机连接,在镜头与光源线连接处安置一个特制滤光片(FU-532LGP-Y7,深圳市富喆科技有限公司),该滤光片滤光波长范围450~500 nm,符合量子点纳米荧光探针的激发波长要求,连接光源,荧光腹腔镜系统初步组建完成。
1.3 裸鼠胃癌模型的制备
将20只3~4周龄,体重20 g左右的裸鼠在无特定病原体(specific pathogen free,SPF)级动物饲养间饲养3~5 d后进行实验。取2只裸鼠,用1 ml注射器吸取配制好的胃癌细胞悬液0.2 ml,固定裸鼠,在裸鼠右后肢进针,针尖斜面向上,确定位置合适后缓慢推进全部胃癌细胞悬液,皮下形成皮丘,拔针后用医用棉球按压针眼数秒以确保液体全部进入,放回笼内,裸鼠皮下种瘤完成。取12只裸鼠,每只肌肉注射舒泰1 mg给予全身麻醉,观察无麻醉反应后,在裸鼠腹中线旁约0.2 cm处取切口开腹后,充分游离暴露胃部,将同等剂量的胃癌细胞悬液注射于胃黏膜下,注意不要将细胞悬液漏入腹腔,关闭腹腔,缝合皮肤,碘伏棉球消毒后敷料固定,待其清醒后放入笼内继续饲养,裸鼠胃内肿瘤种植完成。余6只为健康裸鼠。由于胃内接种不便于观察成瘤情况,可以每日观察裸鼠的背部成瘤情况进行初步对照,1周后当瘤体直径达到1 cm左右即可进行下一步实验观察。
1.4 动物分组和实验操作
将12只胃内种植胃癌细胞的裸鼠模型分为A、B组(每组6只),正常生长的健康裸鼠作为C组。将浓度为1 μmol/L的量子点荧光探针从4 ℃冰箱取出,用PBS溶液稀释20倍[13],使浓度变为0.05 μmol/L,避光保存,用于尾静脉注射备用。1 ml注射器吸取稀释后的量子点纳米荧光探针100 μl推入A组裸鼠尾静脉,B组裸鼠尾静脉先缓慢推入100 μl 0.5 μmol/L Her-2基因自身抗体进行抗体封闭,1 h后于尾静脉推入同A组完全相等剂量的量子点荧光探针。向C组正常生长的裸鼠尾静脉同样推入相等剂量的荧光探针,观察15 min左右待探针完全进入血液循环并与肿瘤相结合后将裸鼠进行全身麻醉(舒泰1 mg/只,肌肉注射),麻醉全程注意裸鼠保暖。将裸鼠固定于操作台上,下腹正中开一约0.2 cm切口,钩镊提起腹壁,将改装后的荧光腹腔镜设备进入裸鼠腹腔观察,在胃区及周围脏器和淋巴结进行集中照射,激发探针使其发光,随即将光源亮度调至最低,观察有无发光区域。根据前期实验结果,量子点荧光探针的荧光强度呈现抛物线变化,1 h后荧光强度达到最高,以后逐渐衰减,30 h后荧光全部消失,我们按照15、30 min,1、2、4、8、12、24、30 h时间点进行观察研究。观察结束后,将裸鼠全部处死,解剖裸鼠,将发光组织进行切片处理,送检切片行HE染色和免疫组化,以证实发光组织是否为胃癌组织,以及是否高表达HER-2蛋白。
2 结果
A组裸鼠注射探针后在白光和荧光腹腔镜下成像对比,白光下虽然亮度足够,但不易观察到肿瘤的位置,降低光源亮度后,发荧光的肿瘤可以清晰地辨认出来(图1)。B组裸鼠由于提前注射单克隆抗体,抗体与肿瘤结合,导致探针无法聚集于癌肿部位,荧光腹腔镜下未见明显发光(图2)。C组裸鼠由于体内未种植胃癌细胞,探针经尾静脉入血后无法大量聚集,腹腔镜下未见其发光(图3)。如图4所示,A、B、C、D分别为被探针标记的胃癌组织在1、4、8、12 h后荧光显像,随着时间的延长量子点荧光探针的荧光强度在逐渐减弱。将裸鼠处死后解剖胃部,取发光组织切片进行HE染色,镜下证实发光组织即为胃癌(图5)。将发光的胃癌组织切片进行细胞角蛋白免疫组化染色,证实该胃癌高表达HER-2蛋白(图6)。
3 讨论
胃癌是全球范围内较为常见的恶性肿瘤,患病率和死亡率一直居高不下[14],许多患者在确诊时即已处于晚期。胃癌由于复发转移导致难以根治,肿瘤准确切除以及转移淋巴结的清扫可以使复发转移率大大降低。目前,手术是治疗胃癌的主要手段。随着医学水平的进步,腹腔镜胃癌根治术已经广泛被应用[15],尽管创伤小,术后恢复快[16],在手术过程中仍无法对癌肿位置进行准确判断,常常需要联合胃镜或者术前定位,使胃癌的切除不够精准。本研究利用量子点荧光探针能与胃癌细胞结合并发光的特性,组建量子点荧光腹腔镜系统,能够术中实时观察癌肿部位以及是否有其他脏器及淋巴结转移,为胃癌的精准治疗提供理论基础与实践支持。
HER-2在胃癌组织中的高表达为荧光腹腔镜的靶向治疗提供新的思路。HER-2在很多癌症中存在高表达或过表达,如乳腺癌、结直肠癌、膀胱癌及卵巢癌等,在胃癌中也同样存在过表达[17],而且通常会导致预后不良。本研究选用高表达HER-2的NCI-N87胃癌细胞进行培养,将生长状态良好的细胞接种于裸鼠体内。量子点由于独特的荧光特性,已逐渐应用于生物医学研究中[18]。相比于其他有机染料(如5ALA、ICG),量子点激发光谱宽,荧光时间长、强度高[19],在活体生物成像方面具有很大的优势。本研究选用硒化镉(CdSe)作为内部核心结构,外部包裹硫化锌(ZnS)制成量子点,结合HER-2单克隆抗体制备成量子点纳米荧光探针。利用硫化锌作为外壳既可以减少镉离子的释放,也可以避免量子点发生氧化,减少自由基的产生[20],从而进一步减轻量子点的毒性。将该探针与胃癌细胞进行体内结合,再利用荧光腹腔镜设备进行观察,即可对量子点荧光探针的光学特性以及荧光腹腔镜的优势进行进一步验证。
在NCI-N87细胞的培养过程中,细胞的生长速度较快,复苏后第1天即可铺满培养瓶底部。传代几次后,将生长状态良好的细胞注射于裸鼠胃壁内,为保证成瘤率,建议将胃癌细胞悬液注射于裸鼠胃大弯侧,近胃窦处,注射完毕后用4-0小儿胃肠外科丝线缝合皮肤。此方法操作简单,安全性高,但由于肿瘤种植于胃内不便于观察是否成瘤以及瘤体大小,而且成瘤周期长,成瘤率也比组织块法低[21],所以在裸鼠右后肢皮下以同法种植进行对照观察,这样可以证实胃癌细胞的活性。且一旦悬液接种法成瘤失败,可以解剖裸鼠皮下的肿瘤进行组织块包埋法使实验顺利进行。Sprague等[22]研究表明将细胞悬液与胶原溶液混合共同注射于裸鼠体内可提高成瘤率。在上述操作中,均要严格遵守无菌原则,在SPF级动物饲养间内的通风橱中进行,避免裸鼠发生切口感染等并发症。
裸鼠种瘤7 d后,裸鼠背部肿瘤直径已经达到1 cm,少数已达2 cm,甚至出现破溃。根据前期实验表明,此时胃内肿瘤的直径可以达到0.5 cm,可以进行实验观察。由于荧光探针中含有镉离子,所以我们将其稀释20倍以减轻毒性反应,尾静脉注射后观察15 min,裸鼠无明显不良反应发生,同时在此期间,也可以让荧光探针充分进行血液循环,与胃癌组织进行有效的结合。麻醉选用诱导时间短,安全性高且不抑制呼吸肌的全身麻醉药物[23],同时麻醉过程中应注意裸鼠的保暖,在裸鼠下面可以放置纱布,防止热量散失过快。腔镜进入后可以清晰地观察到裸鼠的腹腔脏器,但胃部形态无明显异常,在白光照射下无法准确地判断出肿瘤的具体位置,在胃区和周围脏器、淋巴结进行充分照射,激发探针发出荧光,然后将光源亮度调至最低,可以看到小鼠胃部出现较为明显的荧光。B、C组由于探针无法聚集,并未出现荧光显像,验证前期实验中量子点荧光探针无法结合正常胃组织的结论,同时也排除A组假阳性的可能。由于量子点半衰期长,所以我们注射探针后在不同时间点进行了荧光强度的观察。可以看到15 min后荧光强度逐渐增高,在1 h时可以看到发光的肿瘤组织荧光强度很高,肿瘤的部位、大小以及形状均可以较好的辨认出来,同时也可以在这个时间点判断有无其他脏器或淋巴结的转移;4 h后荧光强度开始衰减,但仍能较清晰地看见肿瘤的形态;8 h后荧光强度继续减弱,12 h后肿瘤组织的荧光仍未消失,足以满足一台腹腔镜胃癌手术的时间需要,直到30 h后荧光才全部消失,而且可以证实荧光探针可以在裸鼠体内与胃癌组织稳定结合。观察完成后对裸鼠进行解剖,取发光组织进行病理学检查及免疫组化检测,证实发光组织即为与探针结合的胃癌组织且高表达HER-2蛋白。
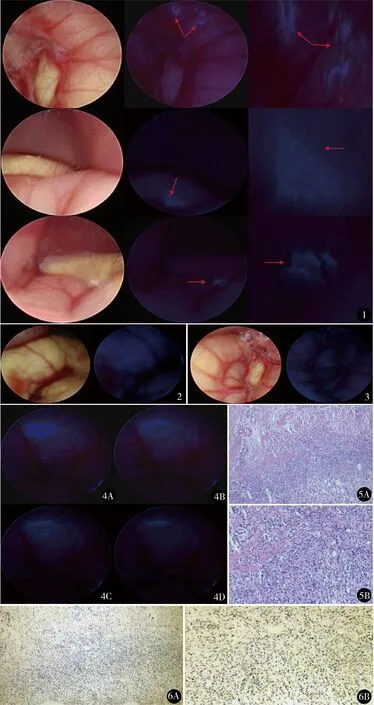
图1 白光与荧光腹腔镜下胃癌组织的成像比较,荧光状态下肿瘤可以清晰地辨认出来(最后一列为局部放大3倍后的成像效果) 图2 抗体封闭后的胃癌组织成像比较,抗体封闭后荧光腹腔镜下未见明显发光 图3 正常裸鼠注射探针后胃癌组织的成像比较,由于探针未大量聚集,腹腔镜下未见发光 图4 胃癌组织的荧光衰减,随着时间延长,荧光强度逐渐减弱,12 h后荧光强度衰减至1/3,足以满足一台腔镜胃癌手术的时间要求 A.1 h后荧光图像;B.4 h后荧光图像;C.8 h后荧光图像;D.12 h后荧光图像(20 h后荧光完全消失) 图5 显微镜下胃癌组织革兰氏染色,可见中分化异型腺体(A. ×80;B. ×200) 图6 显微镜下胃癌角蛋白免疫组化染色,证实为HER-2阳性胃癌细胞(A. ×80;B. ×200)
本研究成功应用量子点和HER-2单克隆抗体完成荧光探针的制备,并证实其能与高表达HER-2蛋白的胃癌组织进行特异性结合,初步完成荧光腹腔镜的改造,制备出合适尺寸和波长范围的玻璃滤光片,使量子点荧光探针成功发光,完成胃癌在量子点荧光腹腔镜下的可视化成像,验证了荧光腹腔镜较普通腹腔镜更容易发现肿瘤组织以及其它不易被察觉的转移。未特异性结合的量子点会进入到其他器官引发毒性效应[24],主要为肾毒性,虽然有硫化锌作为封盖材料,但是其本身的镉离子毒性也应考虑在内,因此,量子点荧光探针的生物毒性限制其广泛地应用于人体,合适的探针浓度和剂量还需要进一步在实验中探索。如果解决它的毒性问题,必将产生巨大的医疗前景,对量子点荧光腹腔镜应用于胃癌的精准治疗产生推动作用。综上所述,量子点荧光腹腔镜可以为消化道肿瘤患者术中导航精准切除肿瘤、辅助化疗以及判断预后奠定基础,为胃肠道肿瘤的治疗提供新的思路。

