肺癌患者血清miR-200a的表达水平及意义
戚永超 缪 劲 郑 琳 张爱平
原发性支气管肺癌简称肺癌,依据生物学特性可将其分为小细胞肺癌(small cell lung cancer,SCLC)与非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC约占所有肺癌90%[1]。肺癌的发生发展为1个多步骤、多因素的过程,涉及较多基因与蛋白,而微小RNA(microRNA,miRNAs)为一类长度在19~25个核苷酸的单链非编码小RNA,广泛存在于真核生物体内,在转录后水平调控基因的表达,其通过与靶基因mRNA3’-非翻译区(3’-untranslated region,3’-UTR)结合,降解靶基因mRNA或抑制其翻译,从而调控多种细胞行为[2],miR-200a为miR-200家族成员之一,研究发现其在多种恶性肿瘤中均表达异常,且有一定肿瘤特异性,如miR-200a在乳腺癌[3]、胰腺癌[4]等肿瘤中表达下调,而在结直肠癌[5]中表达上调,但目前关于miR-200a在肺癌中的表达及其临床意义研究甚少。本文主要分析肺癌患者中miR-200a的表达水平及其临床意义,并开展体外研究实验,为NSCLC的发病机制与治疗策略提供理论依据,结果报告如下。
1 材料与方法
1.1 一般资料
选取2016年2月至2018年12月南京医科大学附属南京医院收治的肺癌患者50例,纳入标准:①均接受肺癌根治术治疗,术后病理证实为肺癌;②家属或患者本人对本研究内容知情,签署知情同意书,本研究获得院伦理委员会批准。排除标准:①合并其他严重心、脑血管疾病患者;②合并严重精神性疾病患者;③合并严重认知与视听障碍者。其中男性27例,女性23例;年龄47~80岁,平均(63.29±6.83)岁;肺癌类型:SCLC 2例,NSCLC 48例;病理分型:鳞癌15例,腺癌33例,小细胞未分化癌2例;国际联盟肺癌TNM分期:Ⅱa期17例,Ⅱb期12例,Ⅲ期21例;手术方式:全肺切除3例,肺叶切除40例,局部肺切除7例。取肺癌患者的癌组织及癌旁组织(距离癌组织边缘≥5 cm,且经病理证实为无癌变标本),另选择人肺癌细胞系A549与永生化支气管上皮细胞株16HBE。
1.2 方法
1.2.1 主要仪器与试剂 A549与16HBE均购自南方医科大学分子肿瘤病理重点实验室。miRNA提取试剂盒购自北京百泰克公司,Real Time PCR System购自美国Bio-Rad公司(型号Agilent 3000),酶标仪购自美国Bio-Rad公司(型号Bio-Rad550),PRIM1640、胎牛血清FBS与胰蛋白酶购自HyClone公司,逆转录试剂盒购自Thermo公司,转染试剂盒购自Invitrogen公司,miR-200a mimics、阴性对照RNA购自上海吉玛生物公司;RT-PCR检测试剂盒购自全式金公司;TRIzol购自Takara公司,CCK-8试剂盒购自Dojindo公司,Transwell小室购自Corning公司。
1.2.2 细胞培养与miRNA提取 将A549与HBE培养在5% CO2、37 ℃、10%含胎牛血清的培养基中。取106~107个肺癌细胞或50~100 mg的组织,采用miRNA提取试剂盒提取出miRNA。应用超微量核酸蛋白测定仪测定miRNAs的OD260与OD280吸收值,计算其比值,比值在1.8~2.1即为质量合格,放置在-80 ℃下保存备用。
1.2.3 检测miR-200a表达水平 采用Primer Premier 5 软件设计各miRNA与内参基因U6的引物序列,由上海生物工程有限公司合成。将质量合格的miRNA反转录为cDNA。反转录参数:16 ℃ 30 min;42 ℃ 30 min;80 ℃ 5 min。反转录体系:miRNA 5.40 μl,1 μmol/l茎环引物1 μl,2.5 mmol/l的dNTP 1 μl,1 U/μl的RNase抑制剂0.30 μl,60 U/μl的反转录酶M-MLV 0.3 μl,5×M-MLV缓冲液2 μl。应用RT-PCR法检测组织与细胞中3种miRNA的相对表达水平,严格依据试剂盒说明书进行操作。PCR反应体系:2×SYBR Premix Ex TaqTMⅡ12.5 μl,50×ROXⅡ0.5 μl,10 μmol/l的PCR正反引物各1 μl,cDNA 2 μl,ddH2O 8 μl。以荧光定量法测定目前miRNA及内参U6的Ct值,miRNA在细胞中相对表达采用2-△Ct表示,△Ct=CtmiRNA-CtU6,miRNA在组织中的相对表达以2-△△Ct表示,△△Ct=(CtmiRNA癌组织-CtU6癌组织)-(CtmiRNA癌旁组织-CtU6癌旁组织)。
1.2.4 miR-200a mimics的转染及其对A549增殖、迁移、凋亡的影响 ①miR-200a mimics的转染:将生长状态良好的A549细胞接种在6孔板培养24 h后进行细胞转染,转染miR-200a mimics作为实验组,转染miRNA negative control(miR-NC)作为阴性对照组,转染6 h后更换新鲜培养液进行后续实验。②采用CCK-8法检测A549细胞增殖能力:将转染24 h的A549细胞接种在96孔板培养板,100 μl/孔,设空白对照,分别培养1 d、2 d、3 d、4 d、5 d,每孔加入10 μl CCK-8,继续培养,酶标仪测定A450,以OD值表示增殖能力大小,重复测3次后取平均值,采用平板克隆实验测定A549克隆能力:将转染后的实验组及阴性对照组接种在6孔板,在37 ℃、5% CO2培养箱中培养2周,密切观察细胞生长状态,培养2周肉眼发现集落形成即终止培养。后加PBS洗涤3次,应用4%多聚甲醛固定10 min,应用吉姆萨染色法染色20 min,放置在空气中干燥,计数细胞克隆。③Transwell小室迁移实验评估A549迁移能力:取24孔板,放入60 μl RPMI与10%FBS培养基、Transwell小室,将转染后的实验组与阴性对照组细胞以0.25%胰蛋白酶消化,后进行接种,洗涤,4%多聚甲醛固定30 min,PBS洗涤3次,苏木精染色30 min,清洗培养板,计数,拍照。④采用流式细胞计数检测细胞凋亡率:转染48 h后收集细胞,离心,弃上清,预冷PBS洗涤细胞2次,以500 μl Binding Buffer悬浮细胞,加5 μl异硫氰酸荧光素(FITC)标记的Annexin Ⅴ,加10 μl PI,在混匀后室温避光孵育5 min,进行检测。
1.3 统计学方法
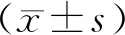
2 结果
2.1 肺癌患者miR-200a表达水平
肺癌患者癌组织中miR-200a水平低于癌旁组织(P<0.05),见表1、图1。
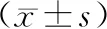
表1 肺癌患者miR-200a表达水平
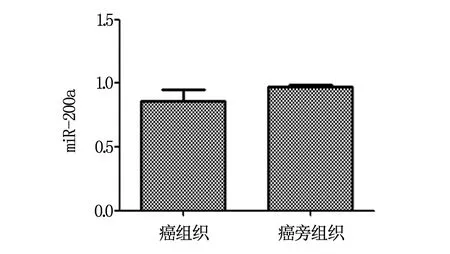
图1 肺癌患者miR-200a表达水平
2.2 A549及HBE细胞系中miR-200a表达水平
A549细胞系中miR-200a表达水平低于HBE细胞系,差异有统计学意义(P<0.05),见表2、图2。
2.3 转染miR-200a mimics对A549增殖、迁移、凋亡的影响
CCK-8实验显示,第2~5 d miR-200a mimics与miR-200a mimics的OD值明显增加,且miR-200a mimics第3 d、4 d、5 d的OD值低于miR-NC(P<0.01);平板克隆形成实验发现miR-200a mimics克隆形成率低于miR-NC(P<0.01);Transwell实验显示miR-200a mimics穿膜细胞数少于miR-NC(P<0.01);流式细胞技术检测显示,miR-200a mimics凋亡率高于miR-NC(P<0.01),见表3。
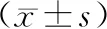
表2 A549及HBE细胞系中miR-200a表达水平

图2 A549及HBE细胞系中miR-200a表达水平
2.4 肺癌患者miR-200a表达水平与临床病理参数的关系
有淋巴结转移、临床分期Ⅲ期者miR-200a表达水平低于无淋巴结转移、临床分期Ⅱa~Ⅱb期者(P<0.05),miR-200a在其他临床病理参数间差异无统计学意义(P>0.05),见表4。
3 讨论
肺癌作为人类病死率最高的恶性肿瘤,其严重威胁着人类健康,而远处转移为肺癌患者主要死亡原因[6],因此提高肺癌的早期诊断水平对指导临床采取治疗方案与改善预后有积极意义。miRNA为一类在进化程度上高度保守的非编码小分子单链RNA,在正常状态下,miRNA的表达有严格组织与程序特异性,miRNA异常表达可导致疾病的发生[7],其中miR-200家族广泛参与多种癌症发生发展,且能抑制细胞上皮间质转化过程,在多种癌症中均可抑制肿瘤细胞侵袭转移,而miR-200a为miR-200家族成员,其定位在人1号染色体1p36.33,不仅能调控基因表达,也受上游基因、转录因子及表观遗传等的调控,有研究[8]显示,上调miR-200a可增强NSCLC细胞对吉非替尼的敏感性,为克服表皮生长因子受体(EGFR)酪氨酸激酶抑制剂治疗的耐药性提供了一种新型有效治疗方法。
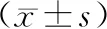
表3 转染miR-200a mimics对A549增殖、迁移、凋亡的影响
注:与第1 d比较,*为P<0.05。
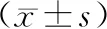
表4 肺癌患者miR-200a表达水平与临床病理参数的关系
本研究显示,肺癌患者癌组织中miR-200a水平低于癌旁组织,表明miR-200a在肺癌患者中表达下调,这与王勇等[9]的研究结果一致,而Zhen等[10]也报道miR-200a在非小细胞肺癌中表达下调,且通过靶向EGFR与c-Met抑制肺癌细胞侵袭。miRNA可对靶基因产生负性调控作用,正是这种负性调控作用使miRNA与肿瘤有着密切关系,影响肿瘤发生发展,在肿瘤发生发展中充当抑癌基因,miR-200a为miRNA中miR-200家族成员[11],有研究[12]报道miR-200a可通过抑制Yes相关蛋白1(YAP1)基因表达而对肺癌细胞增殖产生抑制作用,为临床治疗肺癌提供新思路。
A549为体外研究中人肺癌细胞系常用细胞株,本研究对比了A549与永生化支气管上皮细胞株16HBE中miR-200a表达水平,结果发现A549细胞系中miR-200a表达水平低于HBE细胞系,差异有统计学意义,因而miR-200a在肺癌细胞株A549中也呈低表达。同时本研究通过转染成熟体miR-200a mimics序列,上调miR-200a的表达,并对A549的细胞生物学行为进行检测,结果CCK-8实验显示,miR-200a mimics第3 d、4 d、5 d的OD值低于miR-NC,而平板克隆形成实验也发现miR-200a mimics克隆形成率低于miR-NC,这与刘曙光等[13]的报道结果一致,表明miR-200a可抑制肺癌细胞增殖,使用A549细胞生长受到抑制,细胞克隆率明显减少。王亚飞等[14]的研究也发现,miR-200a可通过抑制Wnt/β-catemin信号通路而增强A549对紫杉醇化疗药物的敏感性,其中Wnt/β-catemin信号通路的异常表达与NSCLC细胞增殖、分化与凋亡等生物学过程密切相关,β-catemin是Wnt/β-catemin信号通路调控的核心因子,为Wnt/β-catemin通路激活的重要标志。本研究Transwell实验也发现miR-200a mimics穿膜细胞数少于miR-NC,流式细胞技术检测显示,miR-200a mimics凋亡率高于miR-NC,表明miR-200a在肺癌中可发挥抑癌作用,能有效抑制肺癌细胞迁移,促进其凋亡,提示hsa-miR-200a有可能作为肺癌治疗的新靶点。李东亮等[15]的研究也发现,miR-200a可通过靶向调控硫酸酯酶2基因而抑制NSCLC细胞A549迁移,Shi等[16]的研究也证实miR-200a可通过抑制NF-κB等信号通路而参与肿瘤进展。因此miR-200a与肺癌细胞株A549的增殖、迁移和凋亡密切相关,可将其作为临床治疗的1个靶点。本研究也发现,有淋巴结转移、临床分期Ⅲ期者miR-200a表达水平低于无淋巴结转移、临床分期Ⅱa~Ⅱb期者,表明miR-200a的表达也与肺癌患者临床病理参数有密切关系,miR-200a可能对肺癌存在负性调控作用,可能是介导肺癌转移、侵袭与浸润的重要miRNA,但因条件限制,本研究未对miR-200a作用于肺癌的靶基因进行研究,临床可进一步开展研究以明确其作用机制。
综上所述,miR-200a在肺癌中呈低表达,且与淋巴结转移与否、临床分期有密切关系,体外实验也发现,miR-200a可能介导肺癌细胞株A549的增殖、迁移和凋亡等生物学过程,是临床治疗肺癌的新靶点。

