Slit2对甲状腺乳头状癌生物特性的影响
王警建 冯海波 罗春海
甲状腺癌是最常见的内分泌恶性肿瘤,虽然具有高度可治愈性,但是仍有约10%的甲状腺癌患者患有进行性疾病,另外还有约5%患有放射性碘难治性癌症[1]。因此寻找新的生物标志物及其作用机制对于甲状腺癌的诊断、预防及治疗仍旧极其重要。之前的研究认为轴突导向分子主要调控发育中脑神经元的生长和定位,但是近期的研究报道其在癌症的发生发展中也起重要的调控作用[2-3]。Slits(Slit1-3)是具有代表性的轴突导向分子,可调控Roundabout(Robo)跨膜受体(Robo1-4)[2],研究表明,在上皮恶性肿瘤中常常可检测到Slits表达的改变,而Slits中研究稍多的成员是Slit2。Slit2在乳腺癌、结肠癌、肺癌、肾癌和宫颈癌中表达缺失,且Slit2可抑制胰腺癌、乳腺癌、胃癌和肺癌的转移[4-5]。但是,迄今为止,Slit-Robo信号在甲状腺癌中的表达和功能尚未明确阐明。对甲状腺乳头状癌(PTC)高频发生家族的一项全基因组连锁分析鉴定出Slit-Robo Rho GTP酶活化蛋白1(SRGAP1)基因可成为PTC易感性的候选因子,并提出了Slit-Robo信号传导在PTC作用[6]。另一项研究表明,miR-218-2及其宿主基因Slit3在甲状腺癌中下调,并且它们对甲状腺癌细胞的侵袭、迁移和增殖起协同抑制作用[7]。本研究评估Slit2在甲状腺癌患者癌组织及癌旁组织中表达及其与甲状腺癌淋巴结转移的关系,并从体外研究Slit2对甲状腺癌细胞增殖、迁移和侵袭的影响及其机制,探讨Slit2在甲状腺癌生物特性中的重要性。
1 材料与方法
1.1 临床样本采集
选取2016年1月至2019年1月西安市第九医院收治的经外科手术的PTC患者50例,其中有淋巴结转移29例,无淋巴结转移癌21例。所有患者均经西安市第九医院影像科及病理科检测确诊。取术中甲状腺癌组织及相应的癌旁正常组织,所有标本获取前患者均未接受放疗、化疗,将获取的组织立即放入液氮速冻,并储存于-80 ℃直至实时荧光定量PCR检测。
1.2 细胞培养
人乳头状甲状腺癌细胞系BHT101购自中国科学院典型培养物保藏委员会细胞库,将细胞培养在含有10%胎牛血清的RPMI培养基中,置于37 ℃、5% CO2的饱和湿度培养箱中培养24 h后换液,以后每2 d换1次液,5~7 d传代1次。取3~5代生长良好的细胞用于后续试验。
1.3 Slit2过表达质粒转染
经PCR扩增人Slit2 cDNA的全长为4950 bp,扩增产物用1%琼脂糖凝胶电泳鉴定,并割胶回收,之后将扩增产物克隆至pCMV6-Entry真核载体(北京OriGene公司)中构建Slit2/pCMV6-Entry重组质粒。将BHT101细胞以每孔3×105个/ml的密度种植于6孔板,依照脂质体2000(上海碧云天公司)的说明书将Slit2/pCMV6-Entry重组质粒转染至BHT101细胞中,同时以载体pCMV6-Entry转染为对照,转染24 h后采用实时荧光定量PCR和Western Blot检测转染效果。
1.4 细胞增殖活性分析
采用CCK-8试剂盒检测细胞增殖活性,试剂盒购自上海碧云天公司。将转染质粒的细胞以每孔1×103个/ml、100 μl的密度接种于96孔板,每组设4个复孔,分别于接种后0、1、2、3、5、7 d每孔加入10 μl CCK-8溶液,孵育1 h后,用酶标仪在450 nm处测定吸光度(OD)。
1.5 Transwell实验
细胞侵袭:将100 μl matrigel胶(用无血清培养基稀释)预铺于transwell小室滤膜上表面,孵育1 h备用。将转染24 h后的细胞重悬于无血清的培养基中,并以5×105个/ml、100 μl接种于transwell小室,然后将小室中放入含10%胎牛血清培养基的24孔板中,各组设4个复孔,孵育48 h后,用棉签小心移去上室内的细胞及matrigel胶,用0.1%结晶紫染小室滤膜10 min,在光镜下观察细胞。随机选取10个100倍视野,计数穿膜细胞数,取均值表示细胞侵袭能力。细胞迁移实验步骤同细胞侵袭实验,但不铺matrigel胶。
1.6 免疫共沉淀
采用RIPA裂解液从转染24 h的细胞中提取总蛋白,经3 000 r/min离心30 min后,取上清液,将一部分上清液用于Western Blot分析。给制备的上清中加入2 μg的抗E-cadherin抗体,另取50 μl蛋白裂解液作为阳性对照(input),4 ℃结合过夜。将Protein G Agrose(上海翊圣生物科技有限公司)经5 000 r/min离心1 min后,弃上清,用细胞裂解液重悬,加入至结合过夜的混合液中,室温反应30 min,离心后加入上样缓冲液,进行蛋白印迹检测,此时一抗为抗E-钙黏蛋白抗体和β-连环蛋白抗体,一抗均购自上海碧云天公司。
1.7 实时荧光定量PCR
采用Trizol试剂提取总RNA,采用BeyoRTTMⅡ cDNA第一链合成试剂盒合成第一链cDNA,用BeyoFastTMSYBR Green qPCR Mix进行实时荧光定量PCR扩增,试剂盒均购自上海碧云天公司。引物由上海生工公司设计合成,引物序列为:Slit2:上游5'-TCCGTTGTTCAGGTACAGAAGAT-3',下游5'-CGACACTTTTCAGGGCAAGC-3'。 Rac1:上游5'-TACGCCCCCTATCCTATCCG-3',下游5'-AGAGCAAGTGTCTGCACCTC-3'。内参GAPDH:上游5'-AATGGGCAGCCGTTAGGAAA-3',下游5'-GCGCCCAATACGACCAAATC-3'。采用2-Ct计算目的基因的表达。
1.8 Western Blot
将免疫共沉淀制备的上清液,用BCA试剂盒定量后,加入上样缓冲液中,用8%SDS-PAGE凝胶分离,转膜,用5%胎牛血清封闭45 min,加入一抗,包括:Slit2,4 ℃孵育过夜,TBST洗3次,加入二抗(1∶8 000,上海碧云天公司),室温摇床孵育1 h,TBST洗3次,用电化学发光试剂ECL暗室发光,采用美国Bio-Rad公司的凝胶成像系统及Quantity One 4.6.2软件对条带进行统计分析。一抗:Slit2(1∶200,上海酶联生物)、Rac1(1∶800,德国Merck公司)、p(Ser71)-Rac1(1∶500,德国Merck公司)、内参GAPDH(1∶5000,上海碧云天)。
1.9 Rac1活性分析
采用美国Cytoskeleton公司的Rac1 G-LISA活性分析试剂盒分析Rac1的活性。主要步骤为:将转染24 h后的细胞裂解物以每孔50 μl加入Rac1-GTP亲和板,400 rpm、4 ℃摇床震荡孵育30 min,洗2次。每孔快速加入200 l抗原呈递缓冲液,孵育2 min,洗3次。加入50 μl Rac1抗体(1∶50),400 rpm、室温摇床震荡孵育45 min,洗3次。加入50 μl辣根过氧化物酶(HRP)标记的二抗(1∶100),400 rpm、室温摇床震荡孵育45 min,洗3次。加入50 μl HRP检测试剂,5 min内采用荧光酶标仪在490 nm处检测荧光强度。
1.10 统计学分析
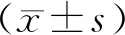
2 结果
2.1 Slit2在甲状腺癌患者中的表达
如表1所示,Slit2 mRNA在甲状腺癌组织中的表达显著低于其在癌旁组织中的表达(P<0.05)。Slit2 mRNA在转移癌患者的甲状腺癌组织中的表达显著低于其在无转移癌患者中的表达(P<0.05)。
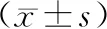
表1 甲状腺癌患者Slit2 mRNA的表达
2.2 Slit2对甲状腺癌细胞增殖的影响
如图1所示,与对照组相比,Slit2组细胞在转染1 d、2 d、3 d、5 d、7 d时的细胞增殖活性显著降低(P<0.05)。
2.3 Slit2对甲状腺癌细胞迁移和侵袭的影响
如表2所示,与对照组相比,Slit2组细胞中Slit2 mRNA和蛋白的表达显著增加(P<0.05)。
Slit2组细胞中迁移细胞数和侵袭细胞数均显著低于对照组(P<0.05)。
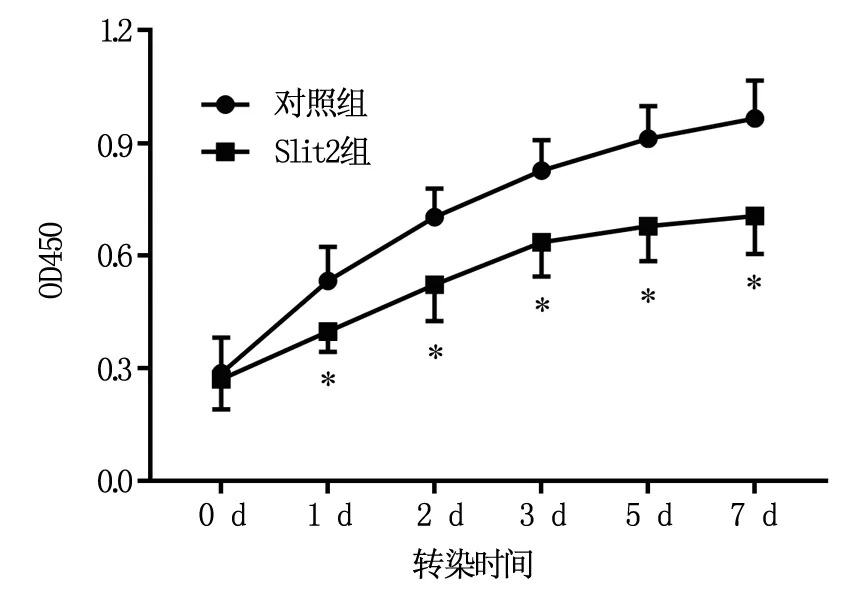
图1 各组细胞增殖活性分析
2.4 Slit2对Rho GTP酶Rac1活性的影响
如表3所示,与对照组相比,Slit2组细胞中Rac1活性、p-Rac1、Rac1 mRNA和蛋白的表达均显著降低(P<0.05)。
2.5 Slit2对β-连环蛋白/E-钙黏蛋白复合体的影响
如表4所示,与对照组相比,Slit2组细胞中E-钙黏蛋白和β-连环蛋白的相互结合作用显著增加,对比差异有统计学意义(P<0.05)。
3 讨论
之前许多研究已经将Slit-Robo信号传导通路与肿瘤细胞转化和进展的调节联系起来。然而,最近的证据表明,Slit-Robo信号传导的作用并不简单,它们可直接作为癌基因或肿瘤抑制因子起作用,而且与细胞类型或癌症阶段有密切关系[2]。在本研究中,我们发现Slit2在甲状腺癌中起肿瘤抑制剂的作用。过去的研究显示在其他恶性肿瘤中常常可检测到Slit2基因沉默或启动子高甲基化而下调[4-5,8],而随着甲状腺癌的研究进展,已经发现Slit2在PTC患者癌组织中的表达显着下降,并与PTC的侵袭性特征相关[9]。这与我们的研究结果一致,Slit2 mRNA在甲状腺癌组织中的表达显著低于其在癌旁组织中的表达,在转移癌患者的甲状腺癌组织中的表达显著低于其在无转移癌患者中的表达。这些研究及结果证实,Slit2在PTC中发挥抑制作用,且可能抑制癌症的转移。
为进一步研究Slit2在PTC中的作用机制,我们通过给人乳头状甲状腺癌细胞系BHT101转染Slit2/pCMV6-Entry重组质粒,在体外研究Slit2对PTC增殖、迁移、侵袭的影响,并探讨影响机制,结果表明,Slit2过表达抑制甲状腺癌细胞增殖、迁移和侵袭。这些发现进一步证实Slit2在甲状腺癌中作为肿瘤抑制因子的作用,而Slit2可能成为抑制侵袭性进行性甲状腺癌转移的新治疗剂。同时Shi等也得到类似的结果,经短发夹沉默的Slit2可显著增加甲状腺癌细胞的存活率[9]。但是在肿瘤发生和发展过程中如何上调Slit2目前尚不清楚。我们的假设是,PTC中Slit2表达的降低可能是一个补偿机制,对其他致癌因素导致的信号通路失调的一种补偿机制,但还需要进一步的功能分析来描述Slit2-Robo信号在甲状腺癌的肿瘤发生中的作用,以及调控Slit2-Robo信号传导活性的机制。
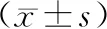
表2 各组细胞迁移和侵袭分析
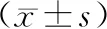
表3 各组Rac1活性及表达对比
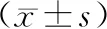
表4 各组β-连环蛋白和E-cadherin蛋白相互作用的对比
目前Slit2在甲状腺癌增殖、迁移和侵袭中的作用机制还甚少报道。Shi等的研究显示,下调的Slit2可通过促进低氧诱导因子(HIF)-1的转录活性进而增加甲状腺癌细胞的有氧糖酵解(Warburg效应)过程,导致肿瘤细胞的持续增殖[9]。但也有许多研究表明,Slit-Robo信号转导可促进β-连环蛋白在膜上定位,从而抑制其在细胞核中的转录功能[8,10]。E-钙黏蛋白是一种单次跨膜糖蛋白,主要介导细胞-细胞间黏附,胞外区包含的组氨酸-丙氨酸-缬氨酸序列是E-钙黏蛋白发挥黏附功能所必需的,胞内区非常保守,可与连环蛋白(α-、β-、γ-)相结合参与连接细胞骨架[11]。但β-连环蛋白除了参与E-钙黏蛋白与细胞骨架的连接外,还可转位至核内,增加Wnt介导的TCF/LEF-1的转录活性,进而促进细胞增殖[12]。本研究通过免疫共沉淀的方法检测到Slit2可显著增加E-钙黏蛋白和β-连环蛋白的结合,因此我们推断Slit2可能通过增加β-连环蛋白转位至细胞膜,与跨膜糖蛋白E-钙黏蛋白结合,进而降低β-连环蛋白在核内介导的转录活性,最终抑制甲状腺癌细胞的增殖。
此外,许多研究表明Slit-Robo信号通过调节Rho GTP酶影响细胞运动[2]。Rho GTP酶是肌动蛋白细胞骨架及脊椎动物细胞形态异质性的调节器,参与细胞运动。目前研究最多的Rho GTP酶主要包括Cdc42、Rac1和RhoA。Rac1活化可导致细胞外周肌动蛋白丝网的组装,从而产生扁平足和膜皱褶。而Cdc42活化则可诱发富含肌动蛋白的膜表面突起,称为丝状伪足[13]。因此,Rac1和Cdc42的活化对于细胞迁移和侵袭等细胞运动具有促进作用。本研究显示,Slit2可显著抑制Rac1活性、p-Rac1、Rac1 mRNA和蛋白的表达,提示Slit2对细胞运动的抑制作用,与Transwell实验结果相符。但本研究也存在许多不足之处,比如甲状腺癌患者的样本量较少,对β-连环蛋白在膜定位的检测缺少免疫荧光分析,对Slit2抑制Rho GTP酶介导的细胞运动只检测Rac1一个分子。这些还需要更加详细深入的研究。
总之,Slit2抑制甲状腺癌的发生发展,并通过增加膜β-连环蛋白/E-钙黏蛋白的结合抑制甲状腺癌细胞增殖,通过抑制Rho GTP酶Rac1抑制甲状腺癌细胞迁移和侵袭。本文揭示了Slit2/Robo信号传导作为甲状腺癌的潜在预后标志物和/或候选治疗靶标的重要性。

