高效液相色谱法测定透明质酸钠含量的研究
陈玉娟,陈雯雯,乔莉苹,李启艳,于海英,胡德福,郭学平
(1.华熙生物科技股份有限公司,山东 济南 250101;2.山东省食品药品检验研究院,山东 济南 250101)
透明质酸(hyaluronic acid,HA)是一种可用于皮肤保湿、润滑、修复的化妆品原料,又称玻尿酸,用于医药领域时也称作玻璃酸。通常应用其钠盐形式,即透明质酸钠。透明质酸是一种酸性黏多糖,广泛存在于脊椎动物组织细胞间质中,其结构是由β-D-葡糖醛酸和β-D-N-乙酰氨基葡糖组成的双糖单位反复交替连接而成,分子量范围可由几千至几百万道尔顿。HA是在1934年由美国科学家Meyer等[1-3]从牛眼玻璃体中首次分离得到,因其具有良好的润滑性、保湿性和黏弹性,并具有极佳的生物相容性而广泛应用于化妆品、食品和医药行业中。
透明质酸钠含量的经典检测方法为硫酸-咔唑法[4-5],即使用强酸将透明质酸钠降解成葡糖醛酸,葡糖醛酸与咔唑反应形成有机络合物,该络合物显示特有的紫色,其吸光度和糖醛酸的浓度成正比,通过葡萄糖醛酸的含量可以确定透明质酸钠的含量[6]。由于透明质酸双糖才是透明质酸最小结构单元,上述方法只针对双糖结构中一部分(葡糖醛酸)进行鉴别和定量,专属性并不强。且一般化妆品通常配方较为复杂,当一些结构复杂的防腐剂、乳化剂、稳定剂等存在时也可能与硫酸咔唑试剂反应显色在530 nm有特征吸收,采用经典的咔唑法作为这些产品的含量检测方法专属性差,会造成结果偏差较大,回收率难以达到要求等问题。
微生物来源的透明质酸酶能将透明质酸钠特异性降解为不饱和双糖(ΔDiHA)[7],通过对供试品中的ΔDiHA进行定量来计算透明质酸钠含量,即只有供试品为透明质酸钠时,才能产生对应量的ΔDiHA,因此采用酶解法结合高效液相色谱法检测透明质酸钠含量,能排除绝大多数干扰及假阳性,如糖醛酸、有色添加物、能与硫酸咔唑反应显紫红色的物质等,有极强的专属性,检测结果更加准确可靠。
1 仪器与材料
1.1 仪器 梅特勒-托利多AL104型分析天平(0.1 mg);Agilent 1260高效液相色谱仪(紫外检测器)。
1.2 试剂与材料 磷酸二氢钠(分析纯);磷酸氢二钠(分析纯);磷酸(分析纯);去离子水。
透明质酸钠对照及供试品(华熙生物科技股份有限公司);透明质酸酶(华熙生物科技股份有限公司,≥1 000 IU·mL-1)。
2 方法与结果
2.1 色谱条件 色谱柱:MCI GEL CK08EH色谱柱(8 mm ×300 mm,5 μm);流动相:1%磷酸; 流速:0.6 mL·min-1;进样量:20 μL;柱温:40 ℃; 检测波长:232 nm。
2.2 溶液配制 酶解缓冲液:称取磷酸二氢钠(NaH2PO4·2H2O)27.4 g、磷酸氢二钠(Na2HPO4·12H2O)8.8 g置1 000 mL容量瓶中,加水稀释至刻度,摇匀,得0.2 mol·L-1Na2HPO4-NaH2PO4缓冲液。上述缓冲液稀释40倍后得到酶解缓冲液(5 mmol·L-1Na2HPO4-NaH2PO4缓冲液,pH 6.0)。
对照溶液:精密称取透明质酸钠对照品约50 mg于50 mL容量瓶中,酶解缓冲液充分溶解并定容至刻度,混匀。取上述溶液0.2 mL,加入0.5 mL透明质酸酶,混匀,密封,42 ℃酶解2 h,煮沸2 min使酶失活。将上述溶液转移入10 mL容量瓶中以缓冲液定容至刻度,0.22 μm滤膜过滤,即得对照溶液。
供试溶液:精密称取透明质酸钠供试品约50 mg于50 mL容量瓶中,酶解缓冲液充分溶解并定容至刻度,混匀。取上述溶液0.2 mL,加入0.5 mL透明质酸酶,混匀,密封,42 ℃酶解2 h,煮沸2 min使酶失活。将上述溶液转移入10 mL容量瓶中以流动相定容至刻度,0.22 μm滤膜过滤,即得供试溶液。平行制备两份。
2.4 方法专属性验证 验证方法:按“2.2”项下方法制备对照品溶液及空白溶液(不溶解透明质酸钠),分别取对照品溶液、空白溶液各20 μL依法进样,记录色谱图。可接受标准:空白溶液在主峰(不饱和透明质酸二糖,ΔDiHA)位置没有色谱峰出现,主峰两侧如有相邻峰,分离度应大于1.5[8]。
验证结果:酶解缓冲液及酶液中的成分均未对主峰产生干扰,主峰与相邻峰的分离度为13.0,该方法的专属性符合验证要求,结果见表1及图1。

表1 专属性验证结果
2.5 线性和范围 验证方法:精密称取透明质酸钠对照品约50 mg于50 mL容量瓶中,酶解缓冲液溶解并定容至刻度,混匀,制得标准储备液。精密量取上述母液0.0、0.1、0.2、0.5、1.0、2.0 mL,分别加入2 mL透明质酸酶,混匀,密封,42 ℃酶解2 h,煮沸2 min使酶失活,各转移入10 mL容量瓶中以流动相定容至刻度,0.22 μm滤膜过滤,即得系列标准工作溶液。按“2.1”项下所述色谱条件进样,记录色谱图。以工作溶液浓度为横坐标,峰面积为纵坐标绘制标准曲线。可接受标准:线性回归方程的相关系数不得小于0.998,Y轴截距应在100%响应值(5 479.5)的2%(109.6)以内。
验证结果:透明质酸钠浓度与峰面积的线性回归方程为Y=29.772X-5.046 0,相关系数r2=1.000 0,截距为-5.046 0,均符合验证要求。结果见表2、图2。

表2 线性结果
2.6 检出限(LOD) 验证方法:将对照溶液稀释适当倍数,依法进样,记录色谱图,计算主峰信噪比(S/N),当S/N≈3时的浓度为最低检测浓度即检出限。
验证结果:当透明质酸钠浓度为0.04 μg·mL-1时S/N=4.1,该方法对透明质酸钠的最低检出浓度为0.04 μg·mL-1,最低检出量为0.8 ng,检出限远低于检测浓度。
2.7 检出限(LOQ) 验证方法:将对照品溶液稀释适当倍数,依法进样,记录色谱图,计算主峰信噪比(S/N),当S/N≈10时的浓度为最低定量浓度即定量限,将此浓度供试品重复进样6次,计算主峰峰面积相对标准偏差,不得大于2%。
验证结果:当透明质酸钠浓度为0.12 μg·mL-1时S/N=9.8,该方法对于透明质酸钠的最低检出浓度为0.012 μg·mL-1,最低检出量为2.4 ng。将此浓度下的溶液依法重复进样6次,主峰峰面积RSD为1.7%,符合验证要求。
2.8 重复性验证 验证方法:平行制备6份供试溶液,依法进样检测,记录色谱图,计算供试品中透明质酸钠含量及6个平行样结果的RSD。可接受标准:6个结果(透明质酸钠含量)的RSD应小于2.0%。
验证结果:6个供试品平行样中透明质酸钠含量平均值为97.0%,6个结果的相对标准偏差为0.4%,符合验证要求,重复性验证通过,结果见表3。
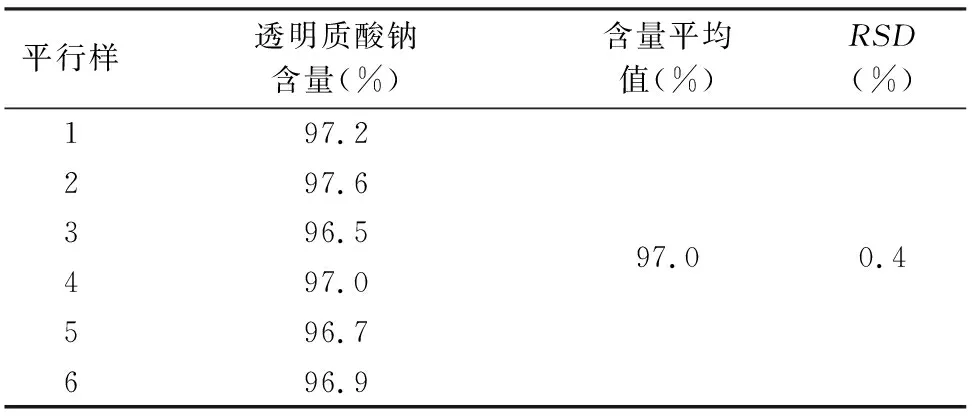
表3 重复性结果
2.9 准确度验证 验证方法:精密吸取不含透明质酸钠的空白样品0.2 mL及1 mL透明质酸酶至EP管中,平行配制9份,每3份为1组,每组分别加入“2.2”项下所述对照母液0.16、0.20和0.24 mL,混匀,密封,42 ℃酶解2 h,煮沸2 min使酶失活,各转入10 mL容量瓶中并定容至刻度。将9份供试溶液各取20 μL注入液相色谱仪,记录色谱图,以HA检出量和理论加入量的比值计算方法回收率。可接受标准:方法回收率为95%~105%,且9个回收率相对标准偏差小于2.0%。
验证结果:方法平均回收率为103.1%,相对标准偏差1.3%,均符合验证要求,验证通过,验证结果见表4。
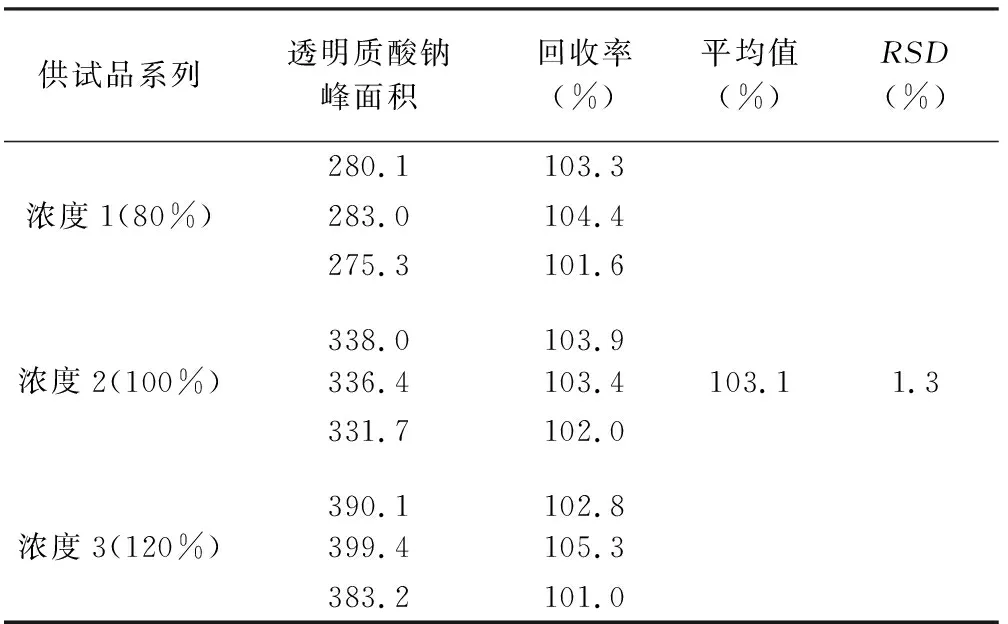
表4 准确度验证结果
3 讨论
3.1 检测波长选择 透明质酸钠经透明质酸酶彻底降解后的产物为透明质酸不饱和双糖,在紫外232 nm有特征吸收,吸收值和ΔDiHA的量呈线性相关。因此将检测波长设置为232 nm(见图3)。
3.2 酶量的选择 本方法定量是通过检测供试品中降解生成的ΔDiHA的量来计算透明质酸钠的含量,因此酶解步骤中加入的透明质酸酶应保证溶液中的透明质酸彻底降解。经前期试验摸索,1 mg透明质酸钠应至少加入1 000 IU透明质酸酶,42 ℃酶解2 h即可彻底降解(232 nm吸收不再增加)。
此方法如应用于终端产品,由于配方中的成分可能影响酶活性,因此应通过预试验确定酶的最佳用量。
3.3 色谱柱的选择 ΔDiHA的极性较大,分析检测一般选用氨基键合硅胶柱以盐溶液为流动相,在这种色谱条件下键合氨基的水解速度较快,色谱柱耐用性较差。MCI GEL CK08EH是一种阳离子交换柱,以水或1%磷酸为流动相,适用于小分子有机酸和小分子糖的分析,柱效高,稳定性好,提高了方法的耐用性和经济性。
本文建立了一种高效液相色谱检测透明质酸钠含量的方法,透明质酸钠先经透明质酸酶彻底降解为ΔDiHA,通过检测ΔDiHA的量计算透明质酸钠含量。相比于传统的硫酸-咔唑法,本方法兼具定性及定量的作用,有极强的专属性。采用酶解法结合高效液相色谱法检测透明质酸钠含量,能排除绝大多数干扰及假阳性,如糖醛酸、有色添加物、能与硫酸咔唑反应显紫红色的物质等,检测结果准确可信,能更加科学有效控制原料和终端产品的质量。

