壳五糖对骨肉瘤细胞抗肿瘤作用的研究
潘珍 程冬冬 位晓娟 李世杰 郭华 杨庆诚
骨肉瘤是常见的骨原发性恶性肿瘤。骨肉瘤好发于长骨干骺端,是导致儿童和青少年癌症相关死亡的主要原因之一[1-2]。目前,骨肉瘤治疗方案主要为原发肿瘤切除联合术前及术后的化学治疗,这使骨肉瘤患者5年生存率提高至60%~70%[3-4]。然而,仍有约50%的骨肉瘤患者在治疗过程中出现远处转移,其中近90%为肺转移[5]。患者一旦出现肺转移,其5年生存率则降至11%~29%[6]。虽然骨肉瘤治疗的新方案层出不穷,但由于存在早期肺转移,以及部分患者对化疗不敏感,骨肉瘤患者的致死率和致残率仍然较高[7]。
壳寡糖是甲壳质或壳聚糖部分降解的产物,其分子量小,易溶于水,无细胞毒性,与壳聚糖相比具有更好的生物活性[8]。壳寡糖通常为含2~10个氨基葡萄糖的不同聚合度的物质[9]。壳聚糖酶能水解壳寡糖,使其从较高聚合度转为低聚合度,在其水解期间进行不断纯化,可得到以单糖为主的最终水解产物[10-11]。已有研究表明,不同聚合度的壳寡糖发挥不同的生物效应,高聚合度壳寡糖(五聚体和六聚体)可显示出更高的抗肿瘤增殖活性[12-13]。近年,壳寡糖在促进肿瘤细胞凋亡中的作用已引起学者们关注[14-15]。然而,壳寡糖尤其是单糖,对骨肉瘤细胞影响的研究报道较少。同时,其抗肿瘤作用的机制也尚不明确。本研究拟初步探索壳五糖对骨肉瘤细胞的抗肿瘤作用,以及其可能的分子机制。
1 材料与方法
1.1 实验材料
细胞株:人骨肉瘤细胞系MNNG、MG63、U2OS(均购自中国科学院上海细胞库)。
主要试剂和仪器:Dulbecco改良的Eagle(DMEM)培养基、RPMI 1640培养基、胎牛血清、青霉素、链霉素(澳洲Hyclone公司),0.25%胰蛋白酶/EDTA(美国Gibco公司),CCK-8试剂盒、细胞周期检测试剂盒、细胞凋亡检测试剂盒(上海碧云天生物技术有限公司),Transwell小室(美国康宁公司),Matrigel胶(美国BD Biosciences公司),蛋白质提取试剂(美国Thermo Fisher公司),蛋白酶抑制剂、磷酸酶抑制剂(上海碧云天生物技术有限公司),BCA蛋白质检测试剂盒(美国Thermo Fisher公司),PVDF膜(美国Millipore公司),抗体:磷酸肌醇-3-激酶(PI3K)、磷酸化PI3K(p-PI3K)、丝氨酸-苏氨酸蛋白激酶(AKT)、磷酸化AKT(p-AKT)、凋亡相关半胱氨酸蛋白酶(CASP)9、细胞周期蛋白依赖性激酶(CDK)6、 β-Actin(美国Proteintech Group公司)。细胞培养箱(Thermo HERAcell 150,美国Thermo Fisher公司),流式细胞仪(美国BD Biosciences公司)。
1.2 细胞培养
DMEM培养基用于培养人骨肉瘤细胞MNNG、MG63,RPMI 1640 培养基用于培养人骨肉瘤细胞 U2OS。所有培养基中均加入 10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素,于37 ℃, 二氧化碳(CO2)体积分数为5%的培养箱中进行细胞培养。
1.3 细胞活性及细胞增殖实验
取骨肉瘤细胞以每孔5 000个细胞接种于96孔培养板中,采用不同质量浓度的壳寡糖单糖(壳二糖、壳三糖、壳四糖、壳五糖、壳六糖)处理3种骨肉瘤细胞,其中MNNG细胞设置的质量浓度梯度为0 mg/mL、0.625 mg/mL、1.25 mg/mL、2.5 mg/mL、5 mg/mL,MG63细胞为0 mg/mL、0.5 mg/mL、1.5 mg/mL、2.5 mg/mL、5 mg/mL,U2OS细胞为0 mg/mL、0.3125 mg/mL、0.625 mg/mL、1.25 mg/mL、2.5 mg/mL。处理48 h后去除培养液,每孔加入DMEM 100 uL 和CCK-8溶液10 uL,37 ℃敷育2 h。使用酶标仪检测每孔吸光度(OD450),计算不同壳寡糖单糖的半数抑制浓度(IC50)。为了检测细胞增殖情况,将细胞接种到96孔板(5 000个细胞/孔),然后使用质量浓度为IC50的壳寡糖单糖(壳二糖、壳三糖、壳四糖、壳五糖、壳六糖)处理细胞5 d,每天采用CCK-8法测定细胞活性。
1.4 细胞克隆实验
先用壳五糖处理细胞48 h后,将1×103个细胞接种于6孔板中,并在37 ℃培养箱中培养。10~14 d后,将细胞用100%甲醇固定30 min,并用0.1%结晶紫染色30 min,最后计数细胞集落。
1.5 细胞侵袭和迁移实验
在Transwell小室中将含有5×104个细胞的200 uL无血清培养基直接滴入上室为细胞迁移实验。进行细胞侵袭测定时,则需将1×105个细胞放置于上室中,其上涂有用无血清培养基稀释的Matrigel(1∶7稀释),并保持上室培养基中含有质量浓度为IC50的壳五糖。分别将800 uL含10%胎牛血清的培养基添加到下室中。在37 ℃下孵育后,将膜底表面的细胞用100%甲醇固定,0.1%结晶紫染色30 min,在光学显微镜下计数。
1.6 细胞凋亡检测和细胞周期实验
细胞凋亡检测:将细胞接种在6孔板中,每孔3×105个细胞,然后用质量浓度为IC50的壳五糖处理细胞。48 h后,按照Annexin V-FITC细胞凋亡检测试剂盒的说明收集细胞,洗涤并染色,在流式细胞仪上读取样品。
细胞周期测定:按上述方法处理细胞,然后使用细胞周期和凋亡分析试剂盒进行收集并通过流式细胞仪进行分析。
1.7 蛋白质印迹法检测实验
用质量浓度为IC50的壳五糖处理3种骨肉瘤细胞48 h后,使用蛋白质提取试剂、蛋白酶抑制剂和磷酸酶抑制剂组成的混合物提取细胞蛋白,通过BCA蛋白质检测试剂盒进行测量。将蛋白质裂解物分离并转移至PVDF膜上,5%脱脂乳封闭,用一抗于4 ℃孵育过夜,PBS液洗膜3次,每次15 min;用二抗室温孵育2 h,然后用增强的化学发光液检测反应蛋白条带,并使用Bio-Rad ChemiDoc XRS化学发光成像系统(美国Bio-Rad 公司)获得可视化图像。
1.8 统计学分析
采用SPSS21.0软件进行统计学分析。通过t检验评估两组之间的差异,图形使用GraphPad Prism 8软件生成。计量资料采用平均值±标准差表示,P<0.05为具有统计学差异。
2 结果
2.1 壳寡糖单糖对骨肉瘤细胞的抑制作用
CCK-8法检测不同聚合度壳寡糖单糖对骨肉瘤细胞系体外活力的影响发现,壳寡糖单糖对骨肉瘤细胞系的抑制作用呈剂量依赖性,见图1。3种骨肉瘤细胞系中不同壳寡糖单糖的IC50值见表1,5种壳寡糖单糖对骨肉瘤细胞均有抑制作用,其中壳五糖的抑制作用稍高。

图1 壳寡糖单糖对骨肉瘤细胞活力的影响
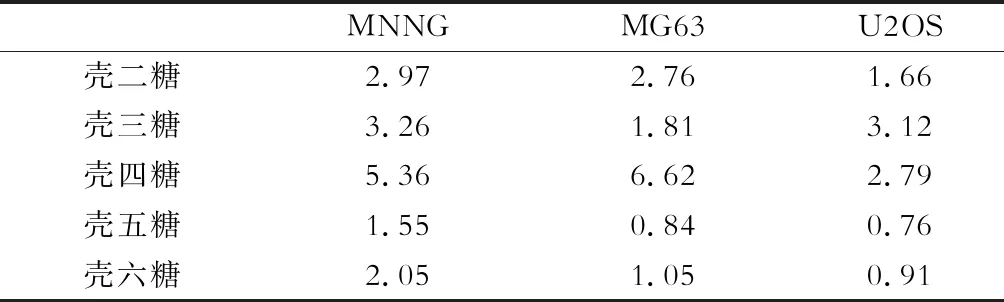
表1 不同壳寡糖单糖在3种骨肉瘤细胞中的IC50/mg·mL-1
2.2 壳五糖对骨肉瘤细胞增殖和克隆形成能力的抑制作用
通过对不同壳寡糖单糖对骨肉瘤细胞系IC50的比较,选择壳五糖进行进一步实验,壳五糖的质量浓度为其对3种骨肉瘤细胞的IC50(MNNG 1.55 mg/mL、MG63 0.84 mg/mL、U2OS 0.76 mg/mL),验证其对骨肉瘤细胞的抑制作用。CCK-8细胞增殖实验显示,与对照组(等体积PBS)相比较,质量浓度为IC50的壳五糖处理骨肉瘤细胞可明显抑制其增殖能力(图2a)。同样,克隆形成实验结果显示,壳五糖明显减少骨肉瘤细胞集落的形成(图2b、图2c)。
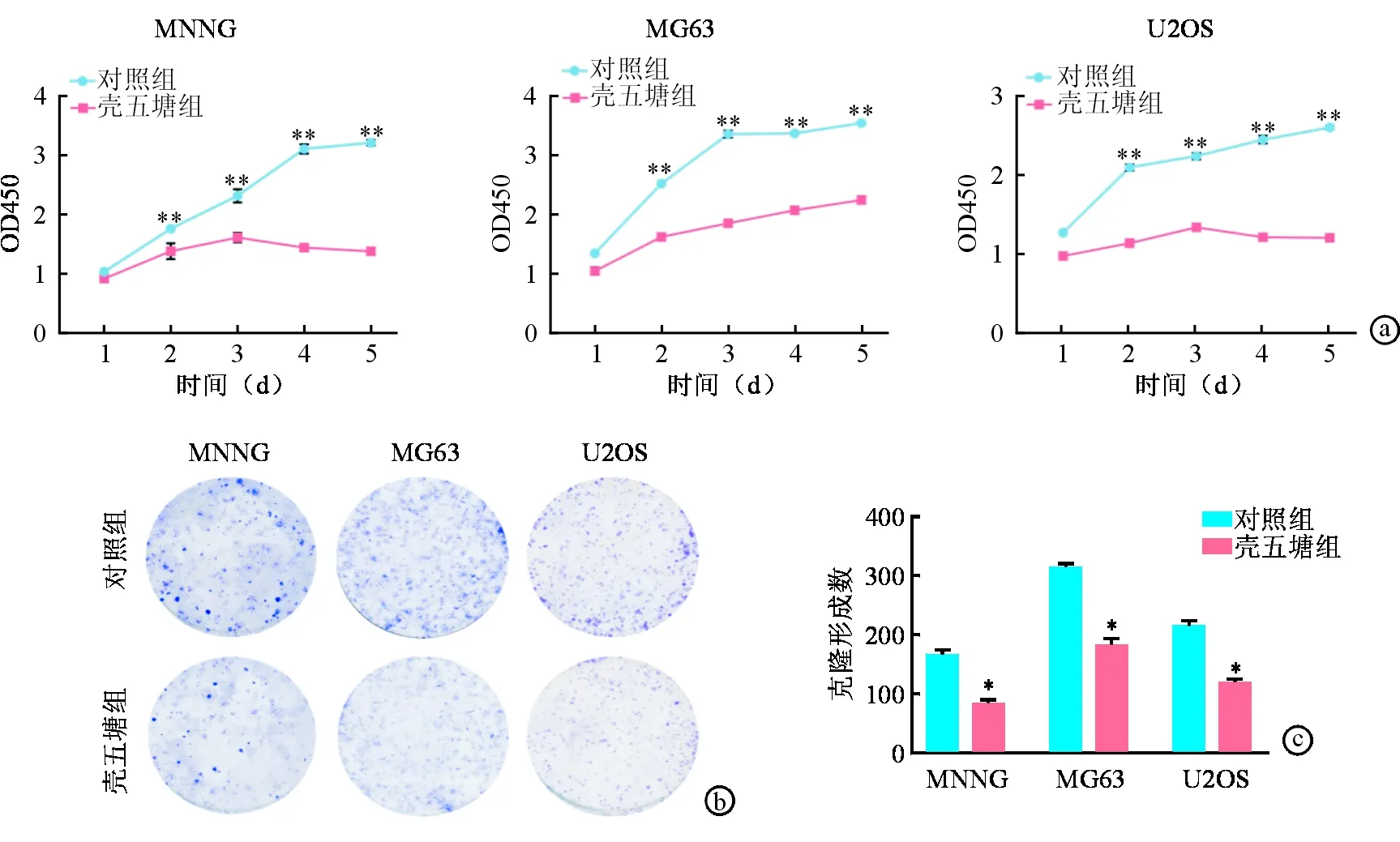
图2壳五糖对骨肉瘤细胞增殖和克隆形成的影响 壳五糖抑制骨肉瘤细胞增殖(a)和细胞集落形成(b、c),*为两组比较P<0.05 **为两组比较P<0.01
2.3 壳五糖抑制骨肉瘤细胞的迁移和侵袭能力
细胞侵袭和细胞迁移实验均表明,壳五糖处理骨肉瘤细胞系后,穿透Transwell小室的细胞数明显少于对照组,并且具有统计学意义(P<0.05),见图3。该结果提示,壳五糖显著抑制骨肉瘤细胞的侵袭和迁移能力。

图3壳五糖对骨肉瘤细胞迁移和侵袭能力的影响 壳五糖抑制细胞的迁移和侵袭(×200)(a),*为两组比较P<0.05 **为两组比较P<0.01
2.4 壳五糖对骨肉瘤细胞的细胞周期及细胞凋亡的影响
通过流式细胞仪检测细胞周期和细胞凋亡,结果显示壳五糖可抑制骨肉瘤细胞由S期向G2期转变,进而抑制细胞周期进程;另外,流式细胞仪检测结果显示,壳五糖组的细胞凋亡率明显高于对照组,见下页图4。以上结果表明壳五糖处理骨肉瘤细胞后阻碍了细胞周期的进展并促进细胞凋亡。
2.5 壳五糖对PI3K/AKT信号转导通路中关键蛋白表达的影响
利用蛋白质印迹法检测相关信号转导通路的关键因子,结合统计学分析可见,与对照组相比,壳五糖组的p-PI3K、p-AKT、CDK6的蛋白表达水平明显下降,CASP9表达明显增加,而PI3K、AKT的蛋白表达水平无明显变化(下页图5)。
3 讨论
骨肉瘤是儿童和青少年最常见的原发性骨肿瘤[16-17],好发于长骨干骺端[18]。尽管化疗方案不断改进,但其复发率仍然很高[19]。肿瘤转移依然是骨肉瘤患者死亡的主要原因,且对于肺转移患者,目前的治疗方法还是依赖于手术切除和全身化疗[20]。随着对骨肉瘤发生和发展的认识不断深入,探索调控骨肉瘤发生及其转移侵袭的机制逐渐成为研究热点。研究骨肉瘤发生及转移相关的信号靶点,并对此进行针对性干预,确定更有效的治疗方案,将有望改善骨肉瘤的临床疗效及预后。

图4壳五糖对骨肉瘤细胞的细胞周期和细胞凋亡的影响 抑制骨肉瘤细胞由S期向G2期转变(a、b),促进细胞凋亡(c、d), *为两组比较P<0.05 **为两组比较P<0.01

图5 蛋白质印迹法检测PI3K/AKT信号转导通路相关因子表达 *为两组比较P<0.05 **为两组比较P<0.01
目前,越来越多的学者关注到海洋生物在肿瘤治疗中的应用。壳聚糖来源于甲壳素的脱乙酰作用,它是贝壳类骨骼和真菌细胞壁的主要成分[21]。壳聚糖通过壳聚糖酶水解或化学方法可制得聚合度小于20且平均相对分子质量<3 200的壳寡糖[22]。目前,壳寡糖已被证明具有多种生理活性,如抗菌,抗病毒,抗肿瘤,抗氧化,免疫调节等[23-24]。有文献报道,完全乙酰化和完全脱乙酰化的壳六糖均具有抗肿瘤活性,且高聚合度壳寡糖(五聚体和六聚体)显示出更高的抗肿瘤活性[13]。因此,壳寡糖,尤其是其单糖形式可能成为治疗肿瘤的新型化合物。
本研究的目的在于探索壳寡糖单糖壳五糖是否具有抗骨肉瘤细胞活性的能力及其作用机制。实验结果显示,壳寡糖单糖能够以剂量依赖性方式抑制骨肉瘤细胞生长,其中以壳五糖作用效果最佳。同时发现,壳五糖不仅抑制骨肉瘤细胞的增殖能力,也抑制骨肉瘤细胞的迁移和侵袭能力。另外,壳五糖可通过抑制细胞周期从S期向G2期的转变来延迟细胞周期进程并促进细胞凋亡。已有研究发现,壳寡糖可增强人结肠癌HCT116细胞中B细胞淋巴瘤/白血病(Bcl)-2家族基因效应蛋白(Bak)表达并减少Bcl-2蛋白和Bcl-xL蛋白表达,从而诱导细胞凋亡发生[25]。而在人肝细胞癌中,壳寡糖能通过提高CASP3的表达来促进细胞凋亡[26]。本研究发现,壳五糖作用于3种骨肉瘤细胞(MNNG、MG63、U2OS)可使其p-PI3K、p-AKT、CDK6的蛋白表达明显下降,CASP9表达明显增加,提示壳五糖可能通过PI3K/AKT信号转导通路发挥作用。
综上所述,我们得出结论,壳五糖可在体外试验中有效抑制骨肉瘤细胞的增殖和转移,其作用机制可能是通过调节 PI3K/AKT信号转导通路发生的。
骨肉瘤的发生和发展是涉及多阶段、多因素、多步骤的复杂生物学过程,本研究仅初步探讨了壳五糖对骨肉瘤细胞的抑制作用,但对壳五糖是否能应用于骨肉瘤治疗及其对PI3K/AKT信号转导通路的影响有待后续实验进一步探究。

