健脾补肾方对再生障碍性贫血患者免疫功能、骨髓造血功能的影响
张琳琳 曹宇峰 吕丽丽 王磊 边月平
再生障碍性贫血(AA)是多种病因引起的获得性骨髓造血异常疾病,患者主要表现为骨髓造血功能障碍或衰竭、全血细胞减少。目前认为免疫功能失调、造血干/祖细胞和骨髓造血微环境损伤是AA的主要发病机制[1-3]。健脾补肾方能够补肾填精、养血生髓,临床用于脾肾亏虚引起的气血不足、血枯髓空[4,5]。本研究观察健脾补肾方对AA患者T淋巴细胞亚群、造血细胞因子的影响,进一步从MAPK/ERK信号通路角度探讨其发挥治疗作用的可能机制。
1 资料与方法
1.1 一般资料 选择2016年1月至2018年6月我院收治的90例AA患者,按照随机数字表法随机分为对照组和治疗组,每组45例。对照组:男25例,女20例;年龄32~61岁,平均年龄(39.12±5.42)岁;病程1~12年,平均病程(5.12±0.73)年;中医证候分型:脾肾阴虚型10例,脾肾阳虚型19例,脾肾阴阳两虚型16例;治疗组:男23例,女22例;年龄30~65岁,平均年龄(40.00±5.51)岁;病程1~14年,平均病程(5.78±0.82)年;中医证候分型:脾肾阴虚型12例,脾肾阳虚型18例,脾肾阴阳两虚型15例。2组年龄、性别比、病程和中医证候分型比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组一般资料比较 n=45
1.2 纳入与排除标准
1.2.1 纳入标准:①符合《血液病诊断及疗效标准》制定的AA诊断标准,且经临床症状体征、血常规指标、骨髓涂片及病理学检查确诊为AA;②符合《中药新药临床研究指导原则》制定的中医辨证分型诊断标准;③入组前2周内未接受过激素、化疗药物治疗者;④患者自愿参加本研究,且签署知情同意书。
1.2.2 排除标准:①合并PNH、白血病等其他血液系统疾病;②合并心、肝、肺、肾等重要脏器功能不全者;③妊娠或哺乳期女性;④对本研究药物过敏或有禁忌证者。
1.3 治疗方法 对照组给予环孢素A(杭州中美华东制药有限公司)治疗,口服,4 mg·kg-1·d-1,2次/d;同时根据病情给予抗感染、补血及止血药物。治疗组给予健脾补肾方治疗,组成:黄芪24 g,女贞子15 g,太子参24 g,白术芍15 g,炒丹皮15 g,制半夏10 g,小蓟草15 g,菟丝子24 g,炒枳壳10 g,炙甘草6 g。1个月为1个疗程,共治疗2个疗程。针对不同中医辨证分型,健脾补肾方中分别配伍不同中药,脾肾阴虚型可选择滋阴生精的药物,如生地黄、黄柏等;脾肾阳虚型可选择填精助阳的药物,如补骨脂、淫羊藿;脾肾阴阳两虚型可选择阴阳双补的药物,如杜仲、制首乌等。
1.4 观察指标及方法
1.4.1 T淋巴细胞亚群:采用流式细胞仪(美国Beckman Coulter公司)测定外周血T淋巴细胞亚群(CD3+、CD4+、CD8+),计算CD4+/CD8+。
1.4.2 血常规指标:分别于治疗前后抽取患者清晨空腹静脉血3 ml,采用血细胞计数仪测定血红蛋白(Hb)、红细胞(RBC)、白细胞(WBC)、血小板(PLT)。
1.4.3 造血细胞因子:采用酶联免疫吸附实验法(ELISA)测定血清促红细胞生成素(EPO)、促血小板生成素(TPO)、血管内皮生长因子(VEGF)水平。
1.4.4 MAPK/ERK信号通路蛋白表达:采用Western blot测定骨髓基质细胞p-ERK、p-JNK、p-P38蛋白表达。骨髓基质细胞裂解后提取总蛋白,BCA法定量蛋白。取20 μg总蛋白上样进行SDS-PAGE分离,电转移至PVDF膜,5%脱脂奶粉封闭1 h,依次加入特异性一抗(1∶1 000稀释)和辣根过氧化物酶标记的兔抗鼠二抗(1∶5 000稀释)。室温孵育1 h。PBS洗膜3次,以GAPDH为内参照基因,ECL发光后采用Image-Pro Plus软件分析目的条带的相对表达量。
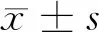
2 结果
2.1 2组外周血T淋巴细胞亚群比较 治疗前2组外周血CD3+、CD4+、CD8+、CD4+/CD8+比较差异无统计学意义(P>0.05)。治疗后2组外周血CD3+、CD4+、CD4+/CD8+均明显高于治疗前,CD8+均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组(P<0.05)。见表2。


组别CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+对照组 治疗前63.68±4.5726.05±2.6735.00±4.310.78±0.09 治疗后68.97±6.33*30.43±3.73*30.14±3.63*1.18±0.14*治疗组 治疗前64.22±5.2125.68±3.1034.78±4.230.80±0.11 治疗后77.52±7.85*#38.43±4.35*#24.97±2.98*#1.39±0.18*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.2 2组血常规指标比较 治疗前2组Hb、RBC、WBC、PLT比较差异无统计学意义(P>0.05)。治疗后2组Hb、RBC、WBC、PLT均明显高于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组Hb、RBC、WBC、PLT高于对照组,差异有统计学意义(P<0.05)。见表3。


组别Hb(g/L)RBC(×1010g/L)WBC(×109g/L)PLT(×109g/L)对照组 治疗前51.47±7.2318.76±2.572.05±0.3134.41±4.78 治疗后85.20±9.54*32.21±4.50*3.32±0.46*55.25±6.31*治疗组 治疗前50.62±6.9319.14±2.932.09±0.3335.12±5.02 治疗后103.79±10.71*#43.68±6.27*#3.99±0.52*#69.29±8.73*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.3 2组血清造血细胞因子水平比较 治疗前2组血清EPO、TPO、VEGF水平比较差异无统计学意义(P>0.05)。治疗后2组血清EPO、TPO水平均明显低于治疗前,VEGF水平均明显高于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组EPO、TPO水平低于对照组,VEGF水平高于对照组(P<0.05)。见表4。


组别EPO(U/L)TPO(pg/ml)VEGF(pg/ml)对照组 治疗前40.53±5.82267.09±36.6446.42±5.56 治疗后30.14±4.16*188.57±23.12*69.37±8.23*治疗组 治疗前39.78±5.57271.33±38.3447.13±5.78 治疗后19.35±2.84*#89.65±11.23*#110.68±13.75*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.4 2组骨髓基质细胞MAPK/ERK通路蛋白表达比较 治疗前2组骨髓基质细胞p-ERK、p-JNK、p-P38蛋白表达比较差异无统计学意义(P>0.05)。治疗后2组骨髓基质细胞p-ERK蛋白表达均明显高于治疗前,p-JNK、p-P38蛋白表达均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组p-ERK蛋白表达高于对照组,p-JNK、p-P38蛋白表达低于对照组(P<0.05)。见表5。


组别p-ERKp-JNKp-P38对照组 治疗前0.44±0.061.09±0.150.96±0.12 治疗后0.69±0.10*0.77±0.10*0.69±0.09*治疗组 治疗前0.42±0.051.11±0.170.93±0.10 治疗后1.12±0.16*#0.38±0.06*#0.35±0.05*#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
3 讨论
中医认为AA是由于外邪和内伤等原因引起的气血亏虚、诸脏失养以及髓脉空虚,因而出现血虚证候。血虚时心、肝、脾、肾等脏器受损,其中脾肾亏虚是导致气血不足、精不化血的根源。因此,AA治疗应以培补脾肾、益气生血为主。本研究根据中医学观点,从补益脾肾角度出发,将健脾补肾方应用于AA患者的临床治疗中,诸药合用能够达到填髓生血,化气生血的治疗目的。
研究表明,骨髓造血干/祖细胞数量减少和功能缺陷导致骨髓造血细胞生成障碍、造血能力下降是AA的主要发病机制,而免疫异常又引起VEGF等造血负调控因子分泌失调和骨髓造血干/祖细胞凋亡,进一步加重AA,患者表现为外周血象异常,即Hb、RBC、WBC、PLT明显下降[6]。骨髓造血是与多种因素有关的复杂过程,其中造血因子在骨髓造血过程中发挥重要调控作用。EPO、TPO主要是由骨髓基质细胞、肝细胞、肾小管细胞合成分泌的细胞因子,EPO与红细胞膜受体结合后主要发挥促进红细胞增殖、分化、成熟并增加外周血红细胞数量等作用,TPO与血小板膜受体结合后能够调控正常骨髓造血干细胞功能[7]。近年来研究发现VEGF不仅能够促进血管生成并增加血管通透性,对造血功能也具有间接调控作用[8,9]。国内外研究发现AA患者血清EPO、TPO水平较健康人明显增高,VEGF水平较健康人明显降低,随着病情好转EPO、TPO水平逐渐降低,VEGF水平逐渐升高,提示与EPO、TPO水平与骨髓造血功能障碍程度呈正相关,VEGF水平与骨髓造血功能障碍程度呈负相关[10-13]。本研究结果表明,治疗后2组Hb、RBC、WBC、PLT及血清VEGF水平均明显高于治疗前,血清EPO、TPO水平均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组Hb、RBC、WBC、PLT、VEGF高于对照组,EPO、TPO低于对照组(P<0.05),提示健脾补肾方治疗AA能够更加有效的调节造血因子分泌,从而改善患者外周血象。
MAPK是将细菌复合物、炎性因子等细胞外刺激信号传递到细胞核中的一种丝/苏氨酸蛋白激酶,在细胞增殖、分化、凋亡等生理过程中发挥关键调控作用[14]。MAPK家族信号通路包括ERK、JNK/SAPK和P38三条信号通路,其中ERK信号通路的主要功能是促进细胞增殖、分化并抑制细胞凋亡,而JNK/SAPK和p-P38是调控细胞应激反应及促进细胞凋亡的重要通路[15]。本研究显示,p-ERK是ERK的活性形式,主要通过以下机制发挥抗凋亡作用:(1)促进增殖相关转录因子AP-1及抗凋亡细胞因子Bcl-2的活化,从而促进细胞增殖并抑制细胞凋亡;(2)促进细胞周期相关蛋白CDK2、CDK4的活化,促使细胞周期进入G1和S期,因而抑制细胞凋亡[16]。动物实验结果显示,AA小鼠骨髓基质细胞MEK、p-MEK、ERK、p-ERK蛋白表达明显下调,提示MAPK/ERK信号通路参与AA的发生发展。临床研究也表明,骨髓机制细胞p-ERK蛋白表达较健康人明显降低,p-JNK和p-P38蛋白表达较健康人明显增高,说明ERK信号通路的激活与造血干/祖细胞的增殖和分化有关[17-19]。本研究结果表明,治疗后2组骨髓基质细胞p-ERK蛋白表达均明显高于治疗前,p-JNK、p-P38蛋白表达均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组p-ERK蛋白表达高于对照组,p-JNK、p-P38蛋白表达低于对照组(P<0.05)。我们推测p-ERK蛋白表达降低造成其对AP-1等下游转录因子调控作用减弱,从而影响造血干/祖细胞的增殖和分化,并促进造血干/祖细胞凋亡,因而导致AA发生发展,而健脾补肾方通过上调p-ERK蛋白表达、下调p-JNK、p-P38蛋白表达促进骨髓造血功能的恢复,升高外周血象,这可能是健脾补肾方发挥治疗作用的机制之一。
综上所述,健脾补肾方治疗AA疗效显著,能够有效调节患者免疫功能和造血细胞因子分泌,从而促进骨髓造血功能恢复。MAPK/ERK信号通路的激活在AA发病过程中发挥重要作用,健脾补肾方可能通过调控MAPK/ERK信号通路,促进骨髓造血功能的恢复。

