不同剂量右美托咪啶对蛛网膜下腔出血急性期大鼠神经功能的影响
李雪 李蔚 丁会峰 王保芝 韩建民 徐雪 曹静 步雪静 康靖超
蛛网膜下腔出血是颅脑损伤中常见的疾病之一,严重威胁患者的生存质量及生命安全。有研究认为,脑缺血再灌注过程主要与脂质过氧化反应、炎性因子、调亡及抗凋亡因子、兴奋性神经递质等存在密切的关系[2],而蛛网膜下腔出血的模型研究笔者所见较少。蛛网膜下腔出血急性期,血凝块聚集在蛛网膜下腔,不能及时被吸收,含氧血红蛋白释放氧自由基,诱发脂质过氧化反应,同时释放血管活性因子诱发一系列的反应,导致细胞结构功能破坏,最终引起血脑屏障通透性增加、脉络丛异常、脑脊液回流障碍、脑血管痉挛。细胞凋亡反应是一种生理性的细胞死亡过程,是组织器官的保护性功能。蛛网膜下腔出血的发生,导致该功能调节异常,正常脑组织,如:海马、脑皮质等部位神经细胞过度凋亡,最终引起机体神经功能障碍。导致神经细胞及血管壁结构破坏。右美托咪啶(dexmedetom-idine,DEX)是一种新型的高选择性α-2 肾上腺素受体激动剂,研究表明,在脑缺血再灌注损伤、脑出血、脑损伤等动物模型中,DEX被证明有显著的脑保护作用[1],在氧中毒的新生鼠模型研究中证明,DEX可以抑制氧中毒引起的神经细胞的凋亡、炎性反应及脂质过氧化反应,保护神经系统发育[2]。Liao等[3]研究发现,DEX可以抑制海马、丘脑区凋亡因子的表达降低异氟烷对新生鼠记忆功能的损伤。可见,DEX对各种原因导致的脑损伤均有保护性的作用。本研究拟从神经行为学、病理学、形态学、炎性因子及凋亡的情况评价三种不同剂量右美托咪啶对蛛网膜下腔出血急性期大鼠神经功能的影响,为临床应用提供指导。
1 材料与方法
1.1 实验动物 健康清洁级SD大鼠50只,由河北医科大学实验动物中心提供,合格证号:1611355,雌雄不限,3个月龄,体重250~300 g,采用随机数字表法分为5组(n=10):对照组(C组)、蛛网膜下腔出血组(S组)、低剂量右美托咪定组(D1组)、中剂量右美托咪定组(D2组)、高剂量右美托咪定组(D3组)。
1.2 造模 采用经寰枕膜枕大池注血法,制备大鼠蛛网膜下腔出血模型[4]。造模完成即刻,S组经尾静脉泵注1.5 ml/h 0.9%氯化钠溶液,D1、D2、D3组分别经尾静脉泵注2.5 μg·kg-1·h-1、5 μg·kg-1·h-1、10 μg·kg-1·h-1DEX(江苏恒瑞医药股份有限公司),持续2 h。
1.3 方法 造模完成后48 h,采用随机数字表法将每组大鼠随机分为2个亚组(n=5)。
1.3.1 神经功能评估及脑含水量:一亚组按参考文献[5]中应用的改良神经功能缺损评分进行神经功能评估,评分标准分为肢体运动、感觉、反射及肢体平衡等,评分范围在0~18分,分数越高,说明神经功能缺损越严重。神经功能评分完成后,处死该亚组大鼠,取全脑组织,经电子天平精确称重后,放入110℃恒温干燥箱烘烤24 h至恒重(2次称重差别<0.2 mg),用同一电子天平再精确称干脑组织重量,按照eliot干湿重法计算脑组织含水量,以百分率表示:脑含水量(%)=(湿重-干重)/湿重×100%。
1.3.2 基底动脉病理学变化:另一亚组大鼠,腹腔注射10%水合氯醛麻醉,于左心室穿刺置管,快速输入0.9%氯化钠溶液200~300 ml进行血液替换,随即以4%的多聚甲醛固定液进行前固定,待大鼠全身僵硬后,断头取脑组织及脑干4%多聚甲醛后固定24 h。常规脱水石蜡包埋,制备切片。苏木素染色制备光镜切片,光镜下观察基底动脉病理学变化。
1.3.3 马组织Bax、BCL-2、TNFA表达:采用免疫组化法染色检测海马组织Bax(批号:AF0120,上海聚士隆生物科技有限公司)、BCL-2(批号:AF6139,上海聚士隆生物科技有限公司)、TNFA(批号:AF7014,上海聚士隆生物科技有限公司)表达情况。取脑组织光镜切片,常规脱水,枸橼酸钠修复抗原,过氧化氢阻断内源性过氧化物酶,以山羊血清工作液封闭,分别加入Bax(1∶100)、Bcl-2(1∶100)、TNF(1∶100)一抗孵育,4℃过夜,二抗(兔抗SP检测试剂盒,批号:15155A08,中杉金桥生物技术有限公司)常温孵育1 h,DAB(20×,批号:15155A08,中杉金桥生物技术有限公司)显色。
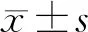
2 结果
2.1 蛛网膜下腔出血模型大鼠神经行为学评分比较 与C组比较,S组、D1组、D2组和D3组神经行为学评分升高(P<0.05),D2、D3组神经行为学评分低于S组(P<0.05),D1组差异无统计学意义(P>0.05)。见表1。

表1 蛛网膜下腔出血模型大鼠神经行为学评分比较 n=5,分,
注:与C组比较,*P<0.05;与S组比较,#P<0.05
2.2 蛛网膜下腔出血模型大鼠脑水含量比较 S组、D1、D2、D3组脑水含量高于对照组(P<0.05),D3组脑水含量低于S组(P<0.05),D1组和D2组与S组比较差异无统计学意义(P>0.05)。见表2。


组别脑水含量C组 76.7±0.9S组 80.5±0.7*D1组79.9±0.7*D2组79.7±0.7*D3组78.6±0.6*#
注:与C组比较,*P<0.05;与S组比较,#P<0.05
2.3 基底动脉改变 与C组比较,S组、D1组和D2组基底动脉可见明显的痉挛,D1组痉挛缓解不明显,D2组痉挛明显缓解,D3组基底动脉可见微弱的血管痉挛。见图1。
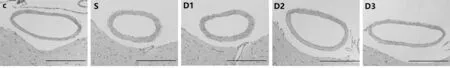

C组S组D1组D2组D3组
图1基底动脉改变(光镜×40)
2.4 海马组织Bax、BCL-2、TNFA表达比较 S、D1、D2、D3组TNF表达明显升高,其中D1组与S组相比差异无统计学意义(P>0.05),D2、D3组与S组相比,TNF表达明显减少(P<0.05);与S组相比,D1、D2、D3组Bcl-2表达逐渐增高(P<0.05);与C组相比,S、D1、D2组Bax表达明显升高,D1组与S组间差异无统计学意义(P>0.05),D2、D3组表达较S组明显减少(P<0.05)。见表3。
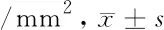
表3 蛛网膜下腔出血模型大鼠的海马组织Bax、BCL-2、TNFA表达比较 n=5,个
注:与C组比较,*P<0.05;与S组比较,#P<0.05
3 讨论
有研究表明,DEX有明确的脑保护作用,其在颅脑手术、术中唤醒、术后镇静及药物戒断治疗中得到了一致的认可[6]。大鼠蛛网膜下腔出血模型在基础研究中得到了广泛的应用,其中包括:枕大池注血法、视交叉注血法和血管穿刺法等方法。由于血管穿刺法的出血量不易控制等特点,其中,枕大池注血法能够人为的控制模型出血情况,且能够很好的模拟蛛网膜下腔出血患者病理生理的变化,应用广泛。本研究采用单次枕大池内注入1 mg/kg自体血法制备大鼠蛛网膜下腔出血模型,可以很好的模拟出血后急性期脑组织病理生理改变。参照文献[7],本研究选取3个剂量2.5 μg·kg-1·h-1、5 μg·kg-1·h-1和10 μg·kg-1·h-1进行观察。
神经功能缺损程度评分是评价机体神经功能是否损伤及损伤程度的客观评价指标。最常见的神经功能评分方法有姿势反射测试、肢体放置测试及平衡木测试,这些测试分别从肢体运动、感觉、反射、平衡和机体协调等方面对大鼠的神经功能做出评价。最终评分越高,说明神经行为功能损伤越严重,反之,越轻。本研究S组大鼠造模成功后,从手术开始到大鼠清醒1.5~2 h。造模后48 h内可见大鼠精神萎靡,行动减少,进食水减少,对惊吓反射及眨眼反射等反应明显迟钝。本研究对象雌雄不限,观察到雌性大鼠术后清醒时间明显短于雄性大鼠,且术后雌性大鼠精神状况及饮食情况明显好于雄性大鼠。由于本研究样本量有限,性别及雌雄激素是否对蛛网膜下腔出血预后有影响及影响机制,尚需进一步的研究和证明。本研究结果显示,S组、D1组、D2组和D3组大鼠神经功能缺损程度评分明显高于C组(P<0.05),D1组与S组之间比较差异无统计学意义(P>0.05),D2、D3组大鼠神经功能缺损程度评分明显低于S组和D1组(P<0.05),可见中高剂量DEX可以改善脑出血后神经行为学的变化。
脑水肿是指脑内外各种因素影响导致脑细胞,组织等含水量增多的一种病理现象,是导致颅内高压的重要因素。目前,针对颅内高压及脑水肿的治疗方式主要为输注甘露醇高渗溶液和去骨瓣减压术,但该治疗措施作用持续时间短,治疗后颅内压反弹现象明显。有报道,蛛网膜下腔出血可以改变大鼠的神经行为,引起脑水肿,增加血脑屏障的通透性。DEX可以激活细胞外信号调节激酶(ERK)改善蛛网膜下腔出血引起的上述损伤[8]。同时,DEX可以明显改善脑损伤,脑卒中患者的预后,这与DEX减少炎性因子、氧化自由基的释放,减轻脑损伤后脑组织的炎性反应及过氧化反应有关。 本研究显示,高剂量DEX缓解蛛网膜下腔出血急性期脑水肿的发生明显优于中低剂量组。临床工作中,DEX主要用于蛛网膜下腔出血患者镇静,大剂量的应用可缓解颅脑损伤所引起的一系列反应,但对循环及各项生命体征的影响应进一步权衡利弊。DEX减轻脑损伤后脑水肿的发生,与血脑屏障上α-2肾上腺素受体结合位点无关,DEX的脑保护作用是否与机体非肾上腺素能结合位点有关,具体结合位点及机制需进一步研究。
Ayoglu等[4]研究认为DEX可以缓解脑出血后脑组织的氧化应激反应,同时DEX存在明显的缓解脑血管痉挛的作用,其中10 μg/kg作用明显优于5 μg/kg。有报道认为 DEX 对蛛网膜下腔出血导致的大脑前额皮质损伤具有剂量依赖性的保护作用,其作用可能与DEX 减轻脑血管痉挛有关[9]。有研究证明,含氧血红蛋白破坏神经源性NO,导致NO功能紊乱引起血管痉挛的发生[9]。脑血管痉挛和内皮素、PKC、瞬时受体电位离子通道、Ca离子通道、炎性因子等有明确的关系[9,10]。本研究应用三种不同剂量,持续泵注2.5 μg·kg-1·h-1、5 μg·kg-1·h-1和10 μg·kg-1·h-1,2 h验证DEX对脑血管痉挛的保护作用。低剂量DEX对血管痉挛的缓解作用不明显,中高剂量DEX可明显缓解脑血管痉挛的发生。脑血管痉挛与含氧血红蛋白,Nitric oxide (NO),protein Kinase C(PKC),自由基,炎性因子,Ca离子及脂蛋白有密切的关系。
有研究发现,单次枕大池注血所致脑出血模型大鼠,在脑出血急性期,凋亡因子caspase-3、Bcl-2的表达发生明显的改变;在模型制备成功后caspase-3表达随时间的增加而增加,24 h后表达明显,48 h达到高峰。Bcl-2在脑出血后12 h表达明显,48 h达到高峰,直到第7天一直处于高表达水平[11],这为本研究提取标本提供了有利的时间依据。本研究结果显示,单次枕大池注血所致脑出血后出血急性期,细胞凋亡因子表达发生了明显的变化。出血后,诱发凋亡反应增强的同时,抗凋亡反应也有所增强。DEX可以通过抑制Bax的表达,促进Bcl-2的表达起到抑制细胞凋亡的作用。机体细胞的凋亡是一个大而复杂的机制,本研究只是单纯的从Bax、Bcl-2水平阐明脑出血对海马神经细胞凋亡的影响及DEX对脑组织的保护作用。
TNF是创伤后应激反应最早表达的炎性因子,它的表达和释放,对血脑屏障的破坏、神经元的损伤和脑水肿的形成起着重要作用。研究发现,缺血脑组织病灶区,TNF-mRNA表达明显增多,这与TNF参与脑损伤后各种生理反应有关[12]。有报道,大鼠脑缺血再灌注之后,海马区TNF、IL-1表达明显增多,TNF、IL-1的表达改变和脑缺血再灌注损伤存在明显的关系[13]。蛛网膜下腔出血后,海马区TNF表达明显增多,中、高剂量组,TNF表达减少,说明蛛网膜下腔出血后,诱发一系列炎性反应,中、高剂量DEX可缓解脑组织炎性反应的加剧,从而缓解颅脑组织的进一步损伤。
本研究结果表明,DEX可以改善蛛网膜下腔出血大鼠神经行为学改变,缓解出血急性期减轻脑血管痉挛及脑水肿的发生。同时,DEX可以通过调节凋亡抗凋亡蛋白及炎性因子的表达对脑组织产生保护作用。本研究证明DEX对蛛网膜下腔出血预后,有明显的改善作用,其中中高剂量组作用明显优于低剂量组(P<0.05)。以往蛛网膜下腔出血导致脑血管痉挛的模型显示,DEX对脑血管痉挛的缓解作用呈抛物线状剂量依赖性。本研究从3个不同剂量出发探讨DEX对蛛网膜下腔出血预后影响,DEX的脑保护作用是否呈剂量相关性将进一步研究。
蛛网膜下腔出血已成为临床上的多发病之一,严重影响着患者的生活及生命安全。蛛网膜下腔出血急性期,血凝块聚集在蛛网膜下腔,不能及时被吸收,含氧血红蛋白释放氧自由基,诱发脂质过氧化反应,同时释放血管活性因子导致神经细胞及血管壁结构破坏。正常情况下,机体各种调节机制及通路处于一种动态平衡状态。脑出血的发生导致机体平衡失调,诱发一系列的保护及过度保护反应。炎性反应和过氧化反应可以导致细胞结构功能破坏,最终引起血脑屏障通透性增加、脉络丛异常、脑脊液回流障碍、脑血管痉挛。细胞凋亡反应是一种生理性的细胞死亡过程,是组织器官的保护性功能。蛛网膜下腔出血的发生,导致该功能调节异常,正常脑组织,如:海马、脑皮质等部位神经细胞过度凋亡,最终引起机体神经功能障碍。同时,兴奋性神经递质的过度表达、JNK、P38MAPK通路、胆碱能抗炎通路、TRPC通路等都与蛛网膜下腔出血引起的脑损伤有关。大量研究证明DEX对脑组织有明确的脑保护作用,并且程剂量相关性。DEX可以通过调节细胞的凋亡反应、过氧化反应、炎性反应及JNK、P38MAPK、TRPCD、α7nAChR通路等抑制脑组织损伤[14,15],减轻脑损伤后引起的神经功能异常、脑水肿脑血管痉挛等的发生。但DEX作用的最终机制为抗炎、抗氧化、抑制凋亡反应。本研究从3种不同剂量探讨DEX对蛛网膜下腔出血大鼠神经功能的影响,具体机制、DEX作用位点及DEX的脑保护作用是否呈剂量相关性有待进一步研究。

