带状疱疹急性期患者血清前炎性细胞因子、免疫球蛋白和T淋巴细胞亚群水平与后遗神经痛的相关性分析
李玉秋 王琛 韦兰 韦冠京 潘南楠 徐文英 钱煕亮 卢敏
带状疱疹(herpes zoster,HZ)后遗神经痛(posther-petic neurlgia,PHN)是由水痘-带状疱疹病毒(varicella-zoster virus,VZV)引起的一种难治性神经病理性疼痛综合征,在中老年人中多发,且其疼痛持续时间长,不仅会阻碍患者白天社会活动,还会引起患者食欲不振、失眠及抑郁,给患者的工作和生活带来严重影响[1-5]。PHN为HZ最为常见的并发症,发生率高达27%,且有40%~50%的患者对各种治疗均缺乏敏感性,所以PHN预防成为医学工作者不断探寻的课题[6-9]。本文献报道VZV感染后引起的神经病理性疼痛和体液免疫应答紊乱的免疫球蛋白、细胞因子以及T淋巴细胞有关[10],但在HZ体内细胞免疫以及体液免疫的变化上不明确,本研究通过检测HZ急性期患者血清前炎性因子、免疫球蛋白及Th1/Th2型细胞因子变化,并分析与PHN的相关性,为临床诊断治疗PHN提供支持。
1 资料与方法
1.1 一般资料 选取2016年1月至2017年12月广西壮族自治区人民医院皮肤科确诊为HZ患者348例作为研究对象,随访3个月观察PHN情况,将出现PHN的患者52例为PHN组,未发生后遗神经痛的HZ患者296例为HZ对照组,另选择同期体检正常的健康者50例为健康对照组。PHN组:男24例,女28例;年龄26~80岁,平均年龄(54.67±8.75)岁。HZ对照组:男130例,女166例;年龄25~80岁,平均年龄(54.25±8.98)岁。健康对照组:男24例,女26例;年龄25~79岁,平均年龄(54.54±9.01)岁。3组性别比和年龄差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 血清采集:PHN组和HZ对照组入院后急性期采集肘静脉血6 ml,健康对照组体检时采集肘静脉血6 ml,分为2部分,一部分置于肝素抗凝管中,6 h内进行T淋巴细胞亚群检测,一部分室温静置0.5 h,然后离心,分离上清,置于EP管中,放于-80℃冰箱保藏待检。
1.2.2 血清疼痛介质检测:取出血清标本,室温融化后采用酶联免疫试剂(ELISA)检测血清疼痛介质含量:血清β-内啡肽(β-EP)、神经降压素(neurotensin,NT)、降钙素基因相关肽(calcitonin gene related peptide,CGRP)、血浆P物质(Substance P,SP)和神经生长因子诱导蛋白(Nerve Growth Factor Inducible,VGF)。
1.2.3 细胞炎性因子检测:取出血清标本,室温融化后采用ELISA检测细胞炎性因子,肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)、白介素-8(IL-8)、白介素-10(IL-10)、白介素-1β(IL-1β),试剂盒采购自奥地利Bender Medsystems公司。
1.2.4 血清免疫球蛋白检测:取出血清标本,室温融化后采用免疫散射比浊法检测血清免疫球蛋白:C3、C4、IgG、IgA和IgM。
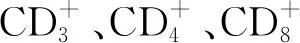
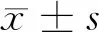
2 结果
2.1 3组血清疼痛介质比较 3组血清疼痛介质两两比较差异均有统计学意义(P<0.05),其中PHN组和HZ对照组中β-EP、NT明显低于健康对照组,CGRP、SP及VGF明显高于对照组,差异有统计学意义(P<0.05),PHN组中β-EP、NT明显低于HZ对照组,CGRP、SP及VGF明显高于HZ对照组,差异有统计学意义(P<0.05)。见表1。
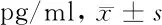

组别β-EPNTCGRPSPVGFPHN组(n=52) 5.91±0.75*#3.26±0.38*#7.78±0.81*#6.54±0.81*#13.60±1.71*#HZ对照组(n=296)8.30±0.87*5.64±0.69*4.58±0.54*4.14±0.51*7.89±1.02*健康对照组(n=50)17.56±2.0910.40±1.833.04±0.392.32±0.334.01±0.35F值35.47127.45315.68414.71932.696P值<0.001<0.001<0.001<0.001<0.001
注:与健康对照组比较,*P<0.05;与HZ对照组比较,#P<0.05
2.2 3组细胞炎性因子水平比较 PHN组和HZ对照组中IL-6、TNF-α、IL-1β、IL-10及IL-8水平均明显高于健康对照组,差异有统计学意义(P<0.05),PHN组中IL-6水平明显高于HZ对照组,而在TNF-α、IL-1β、IL-10及IL-8水平组间差异无统计学意义(P>0.05)。见表2。
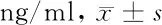
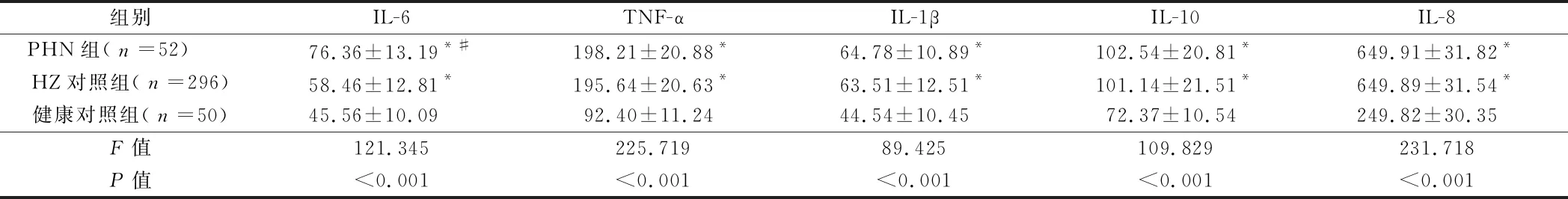
组别IL-6TNF-αIL-1βIL-10IL-8PHN组(n=52) 76.36±13.19*#198.21±20.88*64.78±10.89*102.54±20.81*649.91±31.82*HZ对照组(n=296)58.46±12.81*195.64±20.63*63.51±12.51*101.14±21.51*649.89±31.54*健康对照组(n=50)45.56±10.0992.40±11.2444.54±10.4572.37±10.54249.82±30.35F值121.345225.71989.425109.829231.718P值<0.001<0.001<0.001<0.001<0.001
注:与健康对照组比较,*P<0.05;与HZ对照组比较,#P<0.05
2.3 3组血清免疫球蛋白水平比较 3组血清免疫球蛋白水平两两比较差异均有统计学意义(P<0.05),其中PHN组和HZ对照组中C3、C4、IgG、IgM及IgA明显低于健康对照组,差异有统计学意义(P<0.05),PHN组中C3、C4、IgG、IgM及IgA明显低于HZ对照组,差异有统计学意义(P<0.05)。见表3。
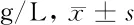

组别C3C4IgGIgMIgAPHN组(n=52) 1.12±0.14*#0.26±0.05*#10.26±1.14*#1.55±0.21*#0.35±0.05*#HZ对照组(n=296)1.29±0.21*0.34±0.03*13.52±1.21*1.92±0.21*0.57±0.05*健康对照组(n=50)1.08±0.140.23±0.048.84±1.451.23±0.240.23±0.04F值12.37210.73421.34513.7189.865P值<0.001<0.001<0.001<0.001<0.001
注:与健康对照组比较,*P<0.05;与HZ对照组比较,#P<0.05
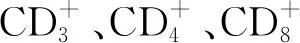


组别CD+3(%)CD+4(%)CD+8(%)CD+4/CD+8PHN组(n=52) 57.12±10.22*#32.27±5.23*#20.21±4.14*#1.77±0.42*#HZ对照组(n=296)57.29±8.24*32.31±8.12*20.52±4.21*1.79±0.71*健康对照组(n=50)68.08±8.1638.28±7.3428.78±4.411.40±0.32F值45.34540.89131.35610.354P值<0.001<0.001<0.001<0.001
注:与健康对照组比较,*P<0.05;与HZ对照组比较,#P<0.05
2.5 血清疼痛介质与IL-6、免疫球蛋白水平的相关性分析 Spearson相关性分析结果显示IL-6和β-EP、NT呈明显负相关(P<0.05),与CGRP、SP及VGF呈明显正相关(P<0.05);免疫球蛋白C3、C4、IgG、IgM及IgA均与β-EP、NT呈明显正相关(P<0.05),与CGRP、SP及VGF呈明显负相关(P<0.05)。见表5。
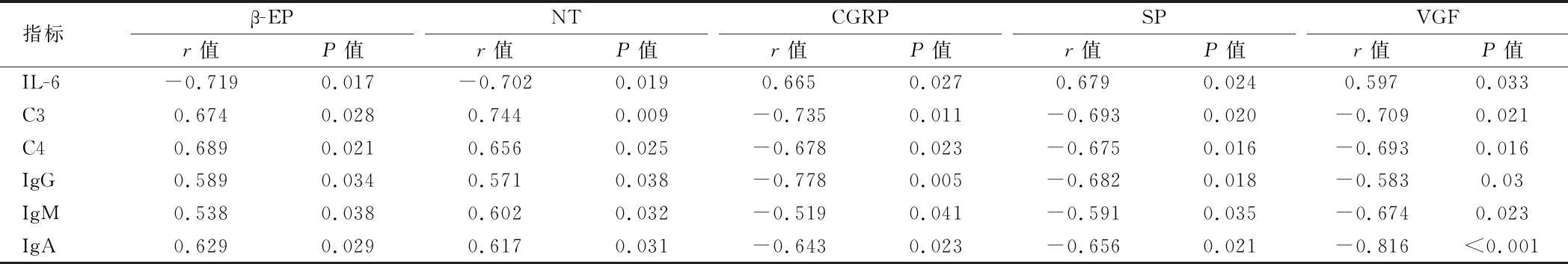
表5 血清疼痛介质与IL-6、免疫球蛋白水平的相关性分析
3 讨论
HZ作为一种病毒性皮肤病,主要是VZV引起,有文献报道VZV感染机体后,不会立即发病,而是在感觉神经元内潜伏相当一段时间,当机体受到恶性肿瘤、创伤等外界刺激后,机体的免疫抵抗力开始明显下降,VZV就会激活,然后通过感觉神经开始下行,被其侵犯的神经就会出现疼痛、皮损等相关病变,并向末梢神经纤维传播,最终出现皮肤病变[11,12]。一些患者的疱疹消退之后,还会存在神经疼痛且治疗无效,该部分患者即为PHN。PHN病程持续时间长,对患者的工作和生活带来极大的影响,目前PHN尚未有特效的治疗药物和手段,且其发病机制不明确,从而使PHN预防工作难以展开。
近年来,神经病理性疼痛研究发现β-EP、NT、CGRP、SP以及VGF等多种疼痛介质在可以用来反映神经病理性疼痛程度,β-EP和NT是镇痛作用神经递质,可以和相应的受体结合,提高痛觉阈值,从而减轻疼痛感觉;SP和VGF是导致疼痛的神经调节肽,主要通过提高神经元兴奋性从而介导神经病理性疼痛进程;CGRP的功能主要是增加微循环通透性、扩张血管,同时还能抑制P物质分解,增加炎性介质分泌,从而增加疼痛程度[13-15]。本研究通过检测五种疼痛介质在PHN组、HZ对照组和健康对照组中的表达,结果显示3组血清疼痛介质含量两两比较,差异均有统计学意义(P<0.05),其中PHN组和HZ对照组中β-EP、NT明显低于健康对照组,CGRP、SP及VGF明显高于对照组,差异有统计学意义(P<0.05),PHN组中β-EP、NT明显低于HZ对照组,CGRP、SP及VGF明显高于HZ对照组,差异有统计学意义(P<0.05)。表明HZ患者血清中疼痛介质出现异常,且其含量高低与皮肤疱疹愈合后PHN发生有关。
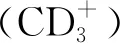
VZV感染引起细胞免疫紊乱还会造成免疫球蛋白和细胞因子异常,免疫球蛋白水平异常和机体抗病毒应答低下相关,从而造成VZV在三叉神经节、脊髓后根神经节等部位再次复制引起PHN发生[21,22],本研究发现3组血清免疫球蛋白水平两两对比均存在统计学意义(P<0.05),其中PHN组和HZ对照组中C3、C4、IgG、IgM及IgA明显低于健康对照组,差异有统计学意义(P<0.05),且本研究还发现PHN组中C3、C4、IgG、IgM及IgA明显低于HZ对照组,差异有统计学意义(P<0.05),说明当免疫应答不足,分泌免疫球蛋白不足以清除病毒时,就会引起PHN发生,从而加重神经疼痛程度。接着我们又进行了疼痛介质和免疫球蛋白的相关性分析,显示免疫球蛋白C3、C4、IgG、IgM及IgA均与β-EP、NT呈明显的正相关关系(P<0.05),与CGRP、SP及VGF呈明显的负相关关系(P<0.05),从而进一步证实了免疫球蛋白分泌不足会引起疼痛加重。
前炎性因子IL-6、TNF-α、IL-1β在神经病理性疼痛发生发展中起着极其重要作用,其不仅会提高神经元兴奋性,还会诱发疼痛[23,24]。有学者在研究HZ患者血清Th1/Th2细胞因子水平中,发现IL-6、IL-8在HZ中要略高于健康对照组,但差异无统计学意义(P>0.05)[25]。也有学者发现PHN患者中IL-6水平不仅高于未发生PHN的HZ患者,而且还与疼痛区感觉缺失呈明显正相关关系[26-29]。IL-10作为重要的抗炎分子,能够抑制前炎性因子的表达,神经损伤后会IL-10水平会升高。本研究结果显示PHN组和HZ对照组中IL-6、TNF-α、IL-1β、IL-10及IL-8水平均明显高于健康对照组,差异有统计学意义(P<0.05),PHN组中IL-6水平明显高于HZ对照组,而在TNF-α、IL-1β、IL-10及IL-8水平组间差异无统计学意义(P>0.05)。提示在HZ和PHN发病可能是因为炎性因子过度表达和抗炎因子表达不足引起,Spearson相关性分析结果显示IL-6和β-EP、NT呈明显的负相关关系(P<0.05),与CGRP、SP及VGF呈明显的正相关关系(P<0.05),进一步提示反映神经损伤的IL-6过度表达可能是引起PHN发生的关键因素。
综上所述,HZ急性期细胞免疫功能低下、前炎性因子过度表达和抗炎因子表达不足是PHN发生的危险因素。

