小麦种子注入低能氮离子束的诱变效应
高 飞, 张 明, 夏仁江, 韩利涛
(1.遵义医科大学 物理学教研室, 贵州 遵义 563003; 2.郑州大学 河南省离子束生物工程重点实验室, 河南 郑州 450001)
20世纪80年代末期,中国科学院离子束生物工程学实验室发现离子注入生物学效应,为离子束生物工程技术应用于农作物的改良揭开了序幕[1]。离子束生物工程技术的作用机理是将一定剂量离子注入植物细胞壁(农作物一般是胚),通过粒子的植入、能量的输入、动能的传递以及电荷的交换,从而诱导植物发生可遗传变异[2]。目前,离子束注入技术不仅可应用于农作物品种的改良,而且在微生物细胞的刻蚀以及转基因上也得到广泛应用[3]。李兴林等[4]用低能重离子辐照春麦定西24,经过多年筛选获得2个稳定的后代118和119,经测定118的蛋白质含量较春麦定西24提高1百分点,辐照后代的高分子量麦谷蛋白亚基类型相对含量发生较大变化。张利华[5]以粉质小麦辐36为材料,经氮离子注入后,M2代出现高秆植株占72.6%。甘斌杰等[6]对小麦8553进行离子束注入发现,后代发生了种皮由白变红的诱变。离子束注入的剂量不同、不同作物或同一作物不同品种所产生的诱变效果各不相同[7-9]。
小麦是贵州的主要粮食作物之一,其种植面积和产量仅次于水稻和玉米[10]。但是由于受自然环境或耕作水平影响,贵州小麦的品质不能达到国家标准或企业收购标准,因而小麦价格不高,许多小麦加工企业基本从外省购进专用优质小麦,使贵州各地区小麦种植严重受到地域性限制[11]。鉴于此,研究采用离子束生物技术,通过适宜剂量的氮离子注入小麦种子,分析注入氮离子束对小麦种子活力、幼苗POD和CAT活性以及植株农艺形状的影响,探究氮离子束对小麦种子的诱变效应,以期为促进优质高效小麦育种技术体系的建设与贵州小麦的种质创新及优良品种选育提供参考。
1 材料与方法
1.1 试验材料
供试小麦品种分别为荣春南麦1号和吉麦1号。荣春南麦1号为南充市农业科学院与四川荣春种业有限责任公司共同选育,贵州引进种植;吉麦1号为贵州吉丰种业有限责任公司选育。小麦种子均由遵义医科大学物理学教研室提供。
1.2 试验设计
采用低能(30~200 keV)氮离子束注入技术,向小麦种子注入氮离子束进行试验。以未注入氮离子束的小麦种子为空白对照,以注入氮离子束(剂量为3×1017N+/cm2)的种子为处理对象。为便于试验比较,将供试小麦品种荣春南麦1号编号为GG11,吉麦1号编号为GG12;GG11注入氮离子束后编号为SG11,GG12注入氮离子束后编号为SG12,共4个处理。考察注入氮离子束后小麦种子的活力和幼苗的POD与CAT活性,以及田间小麦的植株形态变化。
1.3 试验方法
1.3.1 小麦种子注入氮离子束 2016年10月在郑州大学离子束实验室采用TITAN脉冲式离子注入机向小麦GG11和GG12的新鲜、饱满、无破损籽粒注入氮离子,注入参数为氮离子能量30 keV,脉冲频率25 Hz,脉冲宽度40 μs,束流2 mA,剂量3×1017N+/cm2。
1.3.2 小麦种子活力测定 将对照材料GG11和GG12与注入氮离子的材料SG11和SG12各取100粒种子,每个培养皿中(底部垫有潮湿的滤纸)置入25粒。于25℃恒温箱催芽,记录每天发芽数。培养第3天统计发芽势,第7天统计发芽率,培养第10天随机测量10株幼苗鲜重和苗长,取平均值。
发芽势=前3 d供试种子的发芽数/供试种子总数×100%
发芽率=前7 d供试种子发芽总数/供试种子总数×100%
出苗率=前10 d供试种子出苗籽粒数/供试种子总数×100%
1.3.3 小麦幼苗POD及CAT活性测定 小麦种子恒温箱培养第10天即小麦幼苗长至2叶期时进行首次酶活性测定,之后第5天起每隔1 d测1次,连续测定5次。POD及CAT活性测定分别采用愈创木酚氧化法和酶促反应法进行[12]。
1.3.4 小麦植株农艺性状比较 2016 年 10月15 日将GG11、SG11、GG12和SG12小麦种子播于贵州省桐梓县燎原镇大关村实验基地,播种行距 20 cm,株距 18 cm,每个材料播2行(行长约10 m)。小麦成熟后,每行取10 株植株,测量顶一叶长度、植株株高及主茎穗长,考察小麦穗粒数、千粒重和穗芒情况。
1.4 数据处理
采用Excel 2010进行数据基本运算,SPSS 22进行统计分析,Origin Pro 8制作图表。
2 结果与分析
2.1 低能氮离子束注入对小麦种子活力的影响
从表1看出,种子发芽势SG11显著低于其空白对照GG11,SG12极显著低于其空白对照GG12;出苗率SG11低于GG11,SG12显著低于GG12;发芽率SG11和SG12均低于相应对照GG11和GG12。说明,小麦种子注入低能氮离子束后其种子萌发受到抑制,种子活力下降。
表1小麦种子注入低能氮离子束后种子的萌发情况
Table 1 Germination situation of wheat seeds injected with low energy N+ion beam %
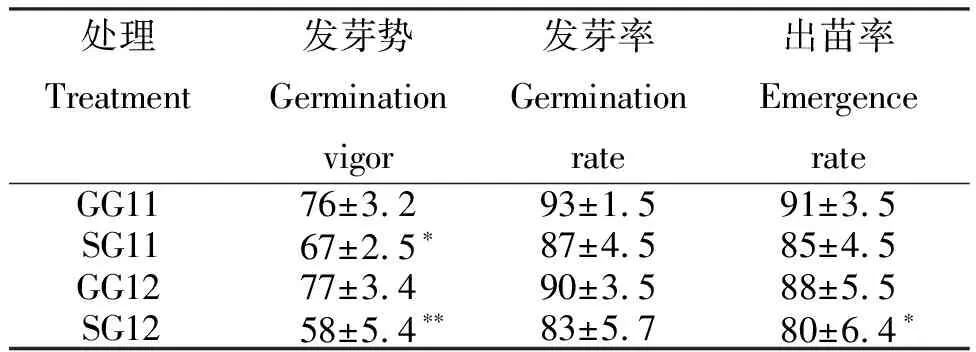
处理Treatment发芽势 Germination vigor发芽率Germination rate出苗率 Emergence rateGG1176±3.293±1.591±3.5SG1167±2.5∗87±4.585±4.5GG1277±3.490±3.588±5.5SG12 58±5.4 ∗∗83±5.780±6.4∗
注:*、**分别表示与相应对照差异达显著(P<0.05)和极显著水平(P<0.01),下同。
Note: * and** indicate significance of difference atP<0.05 andP<0.01 level respeceively.The same below.
2.2 低能氮离子束注入对小麦幼苗素质的影响
从图1看出,小麦幼苗鲜重和苗高形态指标对低能氮离子束注入的反应较为强烈,注入低能氮离子束后小麦苗高与鲜重都略有降低,其中SG11苗高降低明显。表明,低能氮离子束注入小麦后,其生理指标发生一定的生物效应。
Fig.1 Fresh seedling weight and height of wheat seeds injected with low energy N+ion beam
2.3 低能氮离子注入对小麦幼苗POD及CAT活性的影响
从图2看出, 4个小麦材料幼苗的POD和CAT活性随生长时间的延长呈升高趋势。SG11和SG12幼苗POD和CAT活性在相同时段均高于其相应的空白对照GG11和GG12。表明,小麦籽粒注入低能量氮离子束后其幼苗POD和CAT活性增大。
2.4 低能氮离子注入对小麦主要农艺性状的影响
从表2看出,与GG11相比,SG11的株高、穗长度、穗粒数下降,其株高从92.3 cm降至71.1 cm,降低22.9%,差异极显著;SG11顶叶长和千粒重增加,顶叶长从24.2 cm升至26.1 cm,升高7%;千粒重从54.6 g升至56.2 g,升高2.8%,但差异不显著。
与GG12相比,SG12的顶叶长、株高、穗长及穗粒数下降,顶一叶长从26.4 cm降至21.6 cm,降低18.2%,差异显著;株高从86.6 cm降至78.6 cm,降低9.2%,差异显著;穗粒数从34粒降至29粒,降低14.7%,差异显著。千粒重从46.4 g升至48.5 g,升高4.3%,但差异不显著。
总体看,小麦籽粒注入氮离子束后其株高、穗长和穗粒数显著低于未注入氮离子束的处理,说明小麦籽粒注入氮离子束明显抑制植株生长,但可促进千粒重增加。另外,注入氮离子束的小麦有部分麦芒产生突变,出现缺芒或无芒现象。

表2 低能氮离子束注入小麦的主要农艺性状
3 结论与讨论
研究表明,低能氮离子束(剂量为3×1017N+/cm2)注入对小麦种子萌发有抑制效应,小麦注入氮离子束后,种子活力下降,其发芽率和出苗率显著低于未注入氮离子束的处理。低能氮离子束注入也抑制小麦幼苗生长,显著降低幼苗的鲜重和苗长,可能是因为离子束能量沉积和传递效应综合作用使小麦种子萌发期间胚根及后期主根生长发育不良而导致。而小麦种子注入低能量氮离子束后其幼苗POD和CAT活性增大。低能氮离子束注入后引起小麦第1代农艺性状发生广泛的遗传变异,研究发现,注入低能氮离子束后植株出现顶一叶突变、株高降低、麦芒缺芒或无芒及千粒重增加等显著的性状变异。
低能氮离子束对小麦种子活力和植株形态均具有显著的生物学效应,主要表现在种子萌发受挫、幼苗POD和CAT活性增强、植株诱变效果明显(植株变矮,麦穗上出现缺芒、无芒等现象)及千粒重增大等。此效应均来自于注入低能氮离子束的小麦当代,某些性状是否在第2代中得以延续,尚需进一步跟踪研究,若后代出现稳定表达的优良性状,则可用于小麦种质材料的改良。

