管花肉苁蓉药渣中多糖提取工艺及体外抗氧化活性研究
艾拉旦·麦麦提艾力,杨 婷,袁 洁,艾拉旦·艾力,姚 军*,游 林
(1.新疆医科大学药学院,新疆 乌鲁木齐 830011;2.新疆医科大学厚博学院,新疆 克拉玛依 834000;3.和田帝辰医药生物科技有限公司,新疆 和田 848000)
管花肉苁蓉(Cistanchetubulosa)为列当科管花肉苁蓉Cistanchetubulosa(Schenk) Wight的干燥带鱗叶的肉质茎,又称南疆大芸、硬大芸。管花肉苁蓉生长于海拔800~1 400 m的沙地或半固定沙丘、干涸老河床、湖盆低地等,常寄生于柽柳和梭梭的根部。管花肉苁蓉具有补肾壮阳、润肠通便、保肝、抗衰老、抗疲劳、增强免疫力及益智等功效[1-4],主治肾阳不足、精血亏虚、阳痿不孕、腰膝酸软、筋骨无力、肠燥便秘等症[5-6]。
国内外对管花肉苁蓉的研究热点主要集中于醇提取的苯乙醇苷类成分[7-8],其指标性成分为松果菊苷和毛蕊花糖苷。荒漠肉苁蓉和管花肉苁蓉是《中华人民共和国药典》(2015年版)收载品种,均以松果菊苷和毛蕊花糖苷为指标成分进行质量控制。研究发现,荒漠肉苁蓉多糖具有抗衰老、抗肿瘤、调节免疫力、改善人体造血功能等功效,且毒副作用小[9]。管花肉苁蓉主产于新疆和田地区,已实现大面积人工栽培,其产量占全国的70%。截至2017年上半年,于田县管花肉苁蓉种植面积达11 700 hm2,接种管花肉苁蓉面积为10 300 hm2,年产量突破10 000 t,已作为肉苁蓉的新基原进入市场[10]。和田地区肉苁蓉企业采用醇提法提取管花肉苁蓉中的苯乙醇苷类成分,进行中成药和保健品的研发,已上市产品有苁蓉总苷胶囊、复方苁蓉益智胶囊、肉苁蓉黑米保健酒等[11],但醇提后的药渣一般作为废物处理。
作者所在课题组在实验中发现管花肉苁蓉药渣中的多糖含量较为丰富,但有关多糖有效成分含量[12]、药理药效的报道较少。为此,作者对管花肉苁蓉多糖的提取工艺及体外抗氧化活性进行研究,拟为管花肉苁蓉多糖的综合利用奠定理论基础,促进管花肉苁蓉加工产业技术升级。
1 实验
1.1 材料、试剂与仪器
管花肉苁蓉药渣,新疆和田帝辰医药生物科技有限公司。
无水乙醇、浓硫酸,天津富宇精细化工有限公司;蒽酮,上海科丰实业有限责任公司;无水葡萄糖,天津致远化学试剂有限公司;抗坏血酸,天津天新精细化工开发中心;二苯代苦味酰基(DPPH),上海梯希爱化成工业发展有限公司;新亚铜试剂、过氧化氢、硫酸亚铁、水杨酸等均为分析纯。
AB135-S型分析天平,瑞士梅特勒公司;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;EYELA OSB-2100型油浴锅、EYELA N-1001型旋转蒸发仪,上海爱郎仪器有限公司;UV-2550型紫外可见分光光度计,日本岛津公司。
1.2 方法
1.2.1 溶液的配制
葡萄糖溶液:精密称取10.08 mg葡萄糖于100 mL容量瓶中,加蒸馏水溶解并定容至刻度,摇匀,即得0.100 8 mg·mL-1葡萄糖溶液。
硫酸蒽酮溶液:精密称取蒽酮0.1 g于100 mL容量瓶中,加硫酸溶解并定容至刻度,摇匀,即得1.0 mg·mL-1硫酸蒽酮溶液。
1.2.2 标准曲线的绘制
参照《中华人民共和国药典》(2015年版)中多糖含量测定项绘制标准曲线[13]:分别精密量取0.100 8 mg·mL-1葡萄糖溶液0.4 mL、0.8 mL、1.2 mL、1.6 mL、2.0 mL置于具塞试管中,用蒸馏水补足至2.0 mL;加入1.0 mg·mL-1硫酸蒽酮溶液6 mL,立即摇匀,静置15 min后冰水浴冷却15 min;以蒸馏水为空白,测定不同浓度葡萄糖溶液在625 nm处的吸光度。以葡萄糖浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线。
1.2.3 管花肉苁蓉多糖的提取
脱脂:将管花肉苁蓉药渣粉碎,过65目筛,按1∶3(g∶mL,下同)的料液比加入95%乙醇回流脱脂2 h,过滤,常温晾干,得脱脂管花肉苁蓉药渣。
提取:取脱脂药渣10 g,加蒸馏水提取,过滤,浓缩滤液,加入4倍体积的无水乙醇,4 ℃下静置24 h,抽滤,沉淀晾干,得管花肉苁蓉多糖,称重,密封保存,备用。
本实验中,管花肉苁蓉药渣中多糖含量在40%~70%之间,为提高指标的科学性,按式(1)计算多糖提取率:

(1)
式中:m1为多糖质量,g;m0为药渣质量,g。
1.2.4 提取工艺优化
1.2.4.1 单因素实验
影响管花肉苁蓉多糖提取率的主要因素是料液比、提取时间、提取温度。采用单因素实验,分别考察料液比(1∶10、1∶20、1∶30、1∶40、1∶50)、提取时间(1.5 h、2.0 h、2.5 h、3.0 h、3.5 h)、提取温度(70 ℃、75 ℃、80 ℃、85 ℃、90 ℃)对管花肉苁蓉多糖提取率的影响。
1.2.4.2 正交实验
为了优化管花肉苁蓉药渣中多糖的提取工艺[14],在单因素实验的基础上,以管花肉苁蓉多糖提取率为指标,以提取温度、料液比、提取时间为考察因素进行正交实验,每个实验重复3次。
1.2.5 体外抗氧化活性评价
1.2.5.1 对DPPH自由基清除能力的测定
配制浓度分别为20 μg·mL-1、40 μg·mL-1、60 μg·mL-1、80 μg·mL-1、100 μg·mL-1的管花肉苁蓉多糖溶液,分别加入2×10-4mol·L-1DPPH-乙醇溶液2 mL,摇匀,暗反应30 min;测定517 nm处吸光度(A1)。以等体积蒸馏水代替多糖溶液,同法操作,测定其吸光度(A0);以等体积无水乙醇代替DPPH-乙醇溶液,同法操作,测定其吸光度(A2);VC为阳性对照。按式(2)计算DPPH自由基清除率[15]:

(2)
1.2.5.2 对羟基自由基清除能力的测定
取若干具塞试管,依次加入9.0 mmol·L-1FeSO41 mL、9.0 mmol·L-1水杨酸-乙醇溶液1 mL、不同浓度(10 μg·mL-1、20 μg·mL-1、40 μg·mL-1、80 μg·mL-1、160 μg·mL-1)的管花肉苁蓉多糖溶液1 mL、3%H2O2溶液1 mL,37 ℃下加热60 min,测定 510 nm处吸光度(A1)。以等体积蒸馏水代替多糖溶液, 同法操作,测定其吸光度(A0);以等体积蒸馏水代替3%H2O2溶液,同法操作,测定其吸光度 (A2);VC为阳性对照。平行测定3次, 取平均值。按式(2)计算羟基自由基清除率[16]。
1.2.5.3 对铜离子还原能力的测定
取若干具塞试管,分别加入0.5 mL不同浓度(5 μg·mL-1、10 μg·mL-1、20 μg·mL-1、30 μg·mL-1、40 μg·mL-1)的管花肉苁蓉多糖溶液、1 mL新亚铜试剂(7.5 mmol·L-1)和1 mL CuSO4溶液(0.01 mol·L-1),摇匀,再加入3.75 mL醋酸铵缓冲溶液,混匀,静置30 min,测定450 nm 处吸光度,平行测定3次,取平均值(A),最大吸光度为Amax[17]。以等体积蒸馏水代替多糖溶液作为空白对照,测定其吸光度(A0);VC为阳性对照。按式(3)计算铜离子还原率:
(3)
2 结果与讨论
2.1 标准曲线与回归方程
以葡萄糖浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线,如图1所示。
拟合得回归方程:A=39.603c-0.0771,R2=0.9998。表明,葡萄糖浓度在0.005~0.025 mg·mL-1范围内与吸光度呈良好的线性关系。
2.2 管花肉苁蓉多糖提取工艺单因素实验结果
2.2.1 料液比对管花肉苁蓉多糖提取率的影响
固定提取温度为70 ℃、提取时间为2.0 h,分别在料液比为1∶10、1∶20、1∶30、1∶40、1∶50的条件下提取脱脂管花肉苁蓉药渣中的多糖,考察料液比对管花肉苁蓉多糖提取率的影响,结果见图2。
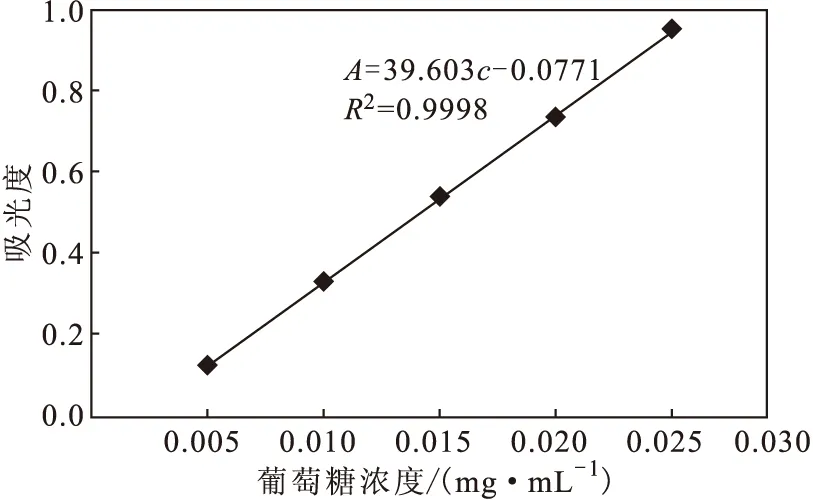
图1 葡萄糖标准曲线

图2 料液比对管花肉苁蓉多糖提取率的影响
从图2可知,随着料液比的减小,即溶剂用量的增加,管花肉苁蓉多糖提取率逐渐升高。这是因为,随着溶剂用量的增加,固体药渣和水两相中的多糖浓度差增大,有利于多糖从药渣中溶出进入水中,导致多糖提取量不断增加。考虑到浓缩时间,选择1∶30~1∶50为正交实验料液比水平。
2.2.2 提取时间对管花肉苁蓉多糖提取率的影响
固定料液比为1∶40、提取温度为70 ℃,分别提取1.5 h、2.0 h、2.5 h、3.0 h、3.5 h,考察提取时间对管花肉苁蓉多糖提取率的影响,结果见图3。
从图3可知,随着提取时间的延长,管花肉苁蓉多糖提取率呈先升高后降低的趋势,在2.5 h时达到最高。这可能是因为,随着提取时间的延长,多糖溶出更充分,多糖提取率相应升高;但提取时间过长,多糖结构可能被破坏,提取率明显下降。为保证多糖结构完整和生物活性,选择2.0~3.0 h为正交实验提取时间水平。
2.2.3 提取温度对管花肉苁蓉多糖提取率的影响
固定料液比为1∶40、提取时间为2.0 h,分别在70 ℃、75 ℃、80 ℃、85 ℃、90 ℃下提取脱脂管花肉苁蓉药渣中的多糖,考察提取温度对管花肉苁蓉多糖提取率的影响,结果见图4。

图3 提取时间对管花肉苁蓉多糖提取率的影响
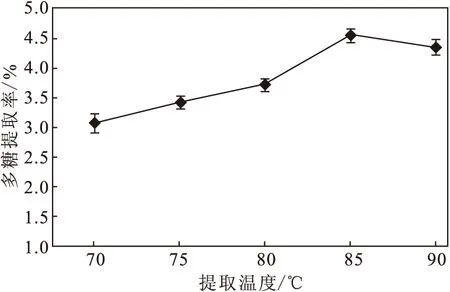
图4 提取温度对管花肉苁蓉多糖提取率的影响
从图4可知,随着提取温度的升高,管花肉苁蓉多糖提取率先升高后降低,在提取温度为85 ℃时,多糖提取率达到最高。这是因为,当提取温度超过85 ℃后,多糖结构可能被破坏,提取率呈下降趋势。为保证多糖结构完整,选择80~90 ℃为正交实验提取温度水平。
2.3 管花肉苁蓉多糖提取工艺正交实验结果
正交实验的因素与水平见表 1,结果与分析见表2,方差分析见表3。
表1 正交实验的因素与水平
Tab.1 Factors and levels of orthogonal experiments

水平因素A.提取温度/℃B.料液比/(g∶mL)C.提取时间/h1801∶302.02851∶402.53901∶503.0
表2 正交实验的结果与分析
Tab.2 Result and analysis of orthogonal experiments

实验号ABC 提取率/%11 1 1 4.1421 2 2 3.3131 3 3 3.9742 1 2 3.1752 2 3 3.6762 3 1 4.1873 1 3 4.4183 2 1 4.9793 3 2 5.68K111.43 11.74 13.30K211.0311.9612.17K315.07 13.8312.06R1.34 0.70 0.42
表3 方差分析
Tab.3 Variance analysis of orthogonal experiments

方差来源离差平方和自由度均方F值F临界值显著性提取温度3.302.001.656.6019.000无料液比0.882.000.441.7619.000无提取时间0.322.000.160.6419.000无误差0.52.000.25
从表2、3可知,各因素对管花肉苁蓉多糖提取率的影响大小依次为A>B>C,即提取温度>料液比>提取时间,与直观分析结果一致[18];最优提取条件为A3B3C1,即提取温度90 ℃、料液比1∶50、提取时间2.0 h。
在最优提取条件下,测得管花肉苁蓉多糖得率为8.91%,多糖含量为64.6%,即提取率为5.76%。与文献报道的黄梨渣多糖提取率(6.3%)相近[19],说明管花肉苁蓉药渣中多糖含量较高,且管花肉苁蓉功效成分含量较肉苁蓉高,多糖也被认为是功效成分之一[20],有进一步研究价值。
2.4 管花肉苁蓉多糖的体外抗氧化活性
2.4.1 对DPPH自由基的清除能力(图5)
从图5可知,在20~100 μg·mL-1浓度范围内,管花肉苁蓉多糖对DPPH自由基的清除能力和浓度呈正相关,清除率表现为剂量依赖性。当多糖浓度为100 μg·mL-1时,其对DPPH自由基的清除率为29.4%;而相同浓度的VC对DPPH自由基的清除率达到95.8%。表明,管花肉苁蓉多糖对DPPH自由基的清除能力远不如VC。
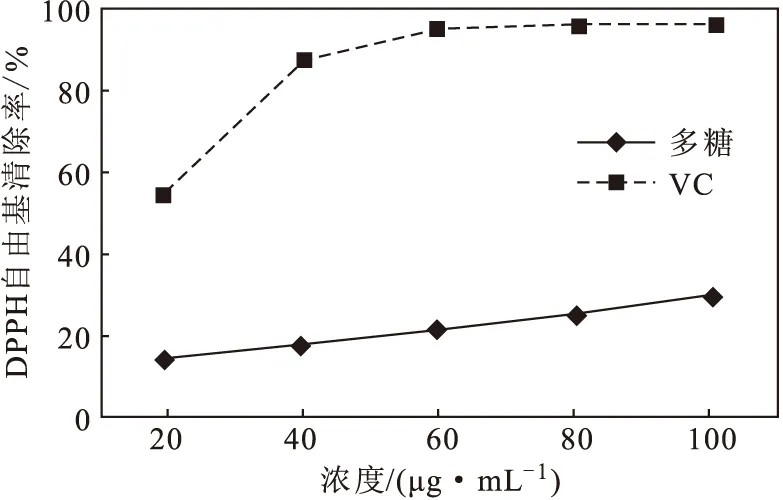
图5 管花肉苁蓉多糖对DPPH自由基的清除能力
2.4.2 对羟基自由基的清除能力(图6)

图6 管花肉苁蓉多糖对羟基自由基的清除能力
从图6可知,在10~160 μg·mL-1浓度范围内,管花肉苁蓉多糖对羟基自由基的清除率具有剂量依赖性。当多糖浓度为160 μg·mL-1时,其对羟基自由基的清除率为18.9%;而相同浓度的VC对羟基自由基的清除率达到98.6%。表明,管花肉苁蓉多糖对羟基自由基的清除能力远不如VC。
2.4.3 对铜离子的还原能力(图7)

图7 管花肉苁蓉多糖对铜离子的还原能力
从图7可知,当浓度为40 μg·mL-1时,管花肉苁蓉多糖对铜离子的还原率为43.7%,VC对铜离子的还原率为81.3%;40 μg·mL-1管花肉苁蓉多糖对铜离子的还原能力相当于27 μg·mL-1VC 对铜离子的还原能力。
综上,管花肉苁蓉多糖对DPPH自由基和羟基自由基都具有清除能力,但清除能力远低于VC;管花肉苁蓉多糖对铜离子具有较强的还原能力,其对铜离子的还原能力略低于VC,这可能是因为,多糖分子中含有大量的羟基[20],能够作为电子供体参与氧化还原反应,将高价金属离子还原成低价。
3 结论
在单因素实验的基础上,通过正交实验优化了管花肉苁蓉药渣中多糖的提取工艺,确定最优提取工艺为:提取温度90 ℃、料液比1∶50(g∶mL)、提取时间2.0 h,在此条件下,管花肉苁蓉多糖提取率为5.76%。管花肉苁蓉多糖对DPPH自由基和羟基自由基都具有清除能力,对铜离子具有较强的还原能力。

