Gabazine及其衍生物的研究与应用进展
张志松,文裴施,巨修练,刘根炎
(武汉工程大学化工与制药学院 绿色化工过程教育部重点实验室,湖北 武汉 430205)
Gabazine及其衍生物对GABA受体具有选择性拮抗作用,是研究GABA受体和中枢神经系统的一种重要有机小分子,是化学和生物领域的研究热点。作者在此对近30年来Gabazine及其衍生物的研究和应用进展进行综述。
1 Gabazine的发现
20世纪80年代,Chambon等[1]合成了γ-氨基丁酸(γ-aminobutyric acid,GABA)的芳基氨基哒嗪衍生物SR 95103(图1),SR 95103是大鼠GABAA受体的竞争性拮抗剂。Heaulme等[2]对SR 95103进行结构改造时发现,在哒嗪环3位苯环的对位引入甲氧基时,所得化合物Gabazine(SR 95531,图1)对大鼠GABAA受体的拮抗活性明显提高,其对GABAA受体的拮抗活性约为SR 95103的20倍。进一步研究表明Gabazine是GABAA受体的一种典型的竞争性拮抗剂,作为一种小分子被广泛应用于药理学和神经医学等研究领域。
2 Gabazine及其衍生物对大鼠GABAA受体的作用
Wermuth等[3]合成了一系列Gabazine类似物,并测定了其对大鼠GABAA受体的拮抗活性。构效关系表明,当Gabazine的羧基被酯、酰胺或腈替代时,会降低其对大鼠GABAA受体的拮抗活性;当哒嗪环1位侧链的长度延长或缩短时,所得衍生物的拮抗活性明显降低。这表明Gabazine衍生物上完整的GABA结构最有利于其对大鼠GABAA受体的识别。此外,若用甲基或苯基取代哒嗪环5位的氢,所得衍生物对大鼠GABAA受体的拮抗活性降低。哒嗪环3位的取代基对其拮抗活性起到了重要的作用,当3位为环己基或芳基时,所得衍生物的拮抗活性显著提高,其中尤以对甲氧基苯基(Gabazine)和对氯苯基(SR 42641,图1)取代衍生物的拮抗活性最高。
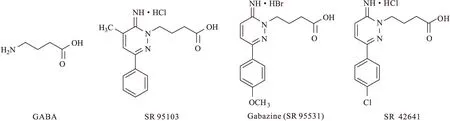
图1 GABA、SR 95103、Gabazine(SR 95531)和SR 42641的化学结构式
3 Gabazine及其衍生物对蛔虫GABA受体的作用
1980年,Martin[4]在猪蛔虫(Ascarissuum)肌肉细胞的突触外区域发现了线虫GABA受体。药理学研究表明,大多数GABAA受体激动剂对该GABA受体有拮抗活性,而印防己毒素、荷包牡丹碱、一叶萩碱等经典GABAA受体拮抗剂对其无拮抗活性[5-6]。
Gabazine作为大鼠GABAA受体拮抗剂的效价约为SR 95103的20倍[7],但Gabazine对蛔虫GABA受体的拮抗活性低于SR 95103[8-9]。研究表明,Gabazine衍生物在蛔虫GABA受体与脊椎动物GABAA受体中有着不同的构效关系[8]。
当Gabazine侧链羧基分别被磺酸基、膦酸基或四唑基取代,所得衍生物1、2、3(图2)对蛔虫GABA受体的拮抗活性降低;当侧链长度增加到5个碳原子或去掉侧链时,会显著降低Gabazine衍生物对蛔虫GABA受体的拮抗活性;若用乙酰胆碱侧链取代GABA侧链时,所得衍生物4(图2)对蛔虫GABA受体的拮抗活性降低;这表明哒嗪环1位的完整GABA侧链对拮抗活性较重要。对6位氨基进行烷基化、酰基化或去掉氨基,所得衍生物的拮抗活性显著降低,表明6位游离氨基是拮抗活性所必需的。当在哒嗪环5位引入亲脂基团时,所得衍生物5(图2)的拮抗活性提高。Gabazine衍生物对脊椎动物GABAA受体和蛔虫GABA受体拮抗作用的选择性为开发新型安全的驱虫药提供了理论依据和新思路[10]。
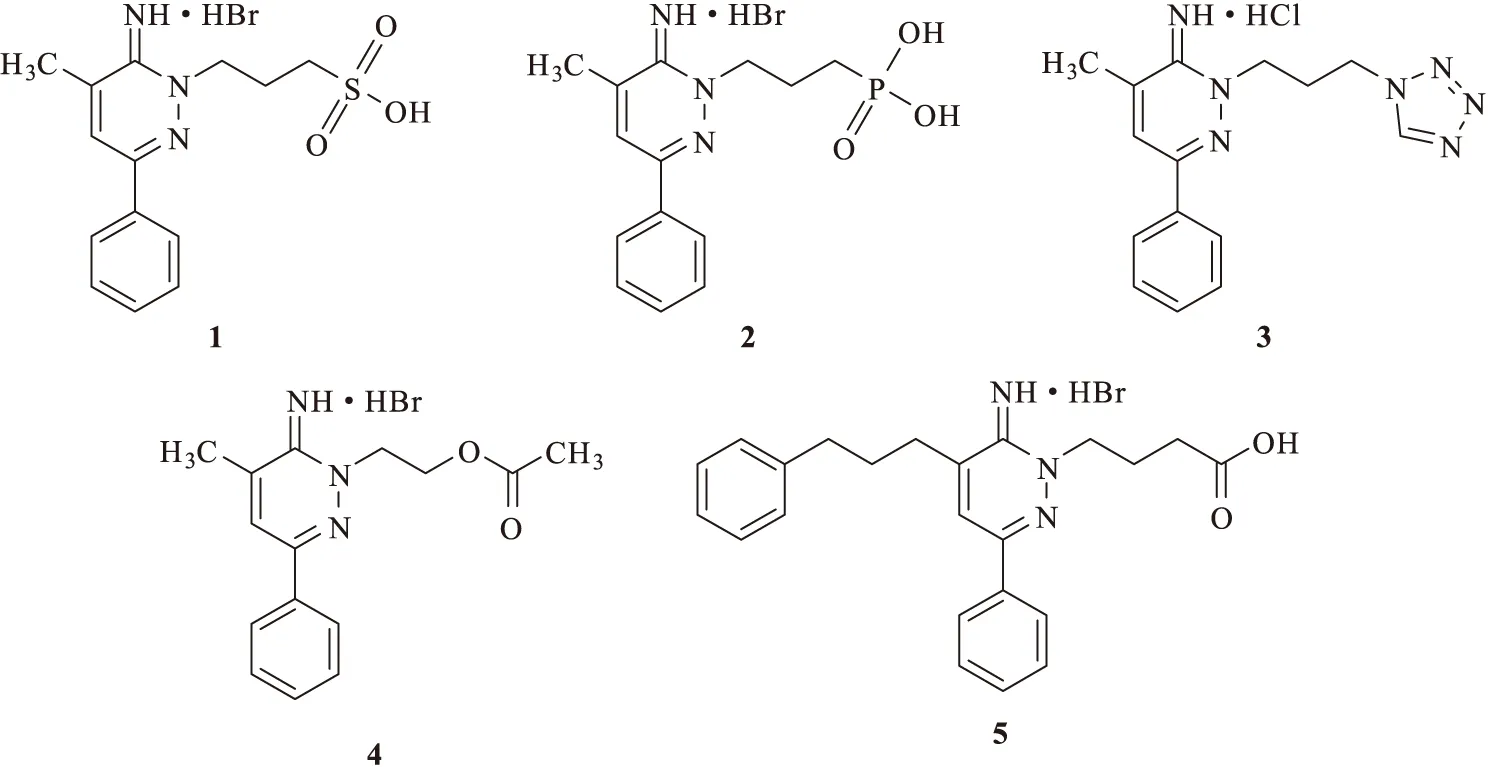
图2 不同基团修饰的Gabazine衍生物的化学结构式
4 Gabazine对神经元放电的影响
研究表明,对苍白球微量注射GABAA受体拮抗剂荷包牡丹碱能起到抗帕金森病效应[11]。朱苏红等[12]采用电生理学方法探究了Gabazine对小鼠苍白球神经元放电的影响,结果表明,Gabazine能兴奋小鼠苍白球神经元,为进一步探讨苍白球GABAA递质系统在抗帕金森病效应中的作用提供了初步的理论和实验依据。刘子然等[13]研究了Gabazine对大鼠黑质网状带GABA能神经元放电的影响,结果表明,Gabazine能兴奋大鼠黑质网状带GABA能神经元,揭示了内源性GABAA受体对神经元自发放电具有调控作用,为进一步探讨GABAA受体在帕金森病发病中的作用提供了一定的理论依据。
5 Gabazine及其衍生物对昆虫GABA受体的作用
Gabazine对昆虫GABA受体有一定的拮抗活性[14-16]。Rahman等[17]合成了一系列Gabazine衍生物并测定了其对部分昆虫GABA受体的拮抗活性,结果表明,当在Gabazine哒嗪环的3位引入芳基时,所得衍生物对昆虫GABA受体的拮抗活性明显提高。其中,当哒嗪环3位为2-萘基时,所得衍生物6(图3)的拮抗活性最高,其浓度为100 μmol·L-1时,对褐飞虱(Laodelphaxstriatella)和斜纹夜蛾(Spodopteralitura)的GABA受体中GABA诱导效应的抑制率为100%。电生理测试表明,500 μmol·L-1衍生物6对美洲蟑螂(Periplanetaamericana)GABA受体中GABA诱导电流的抑制率接近90%。

图3 对昆虫GABA受体拮抗活性较高的Gabazine衍生物的化学结构式
Rahman等[18]进一步研究了4位和1位取代基对Gabazine衍生物拮抗活性的影响。当4位引入环丁基时,所得衍生物对昆虫GABA受体的拮抗活性明显降低;当1位羧基被氰基取代时,所得衍生物对昆虫GABA受体的拮抗活性没有显著变化,这表明当Gabazine衍生物作为昆虫GABA受体拮抗剂时,1位氰基可能是羧基的生物电子等排体;当3位分别引入4-联苯基、2-氟-4-联苯基和2-萘基等大芳香环时,所得衍生物7、8、9(图3)具有较高的拮抗活性。然而目前尚未对哒嗪环5位进行结构改造,若对哒嗪环的3位和5位同时进行修饰,有望开发出对昆虫GABA受体拮抗活性更高的拮抗剂。
6 Gabazine及其衍生物对α1β2γ2型GABAA受体的作用
哺乳动物α1β2γ2型GABAA受体是最普遍的一种GABA受体亚型[19]。长期使用一种激动剂后,组织或细胞对激动剂的敏感性和反应性下降,这种现象被称为受体脱敏[20]。Xu等[21]研究发现,Gabazine可以促进α1β2γ2型GABAA受体从脱敏状态恢复。
Iqbal等[22]在Gabazine结构中分别引入苄基和丙炔基,得到衍生物10~13(图4),并测试了其对α1β2γ2型GABAA受体的拮抗活性。结果表明,引入苄基的衍生物10对α1β2γ2型GABAA受体的拮抗活性明显提高,与Gabazine相比提高了30倍;在苄基的间位引入给电子的甲氧基(11)或吸电子的硝基(12)可进一步提高拮抗活性;引入丙炔基(13)也可提高拮抗活性。此结论为Gabazine衍生物的进一步研究提供了新的方向。
Mortensen等[23]将光活性基团芳基叠氮、二苯甲酮和芳基双吖丙啶分别引入Gabazine结构中,得到的衍生物14~16(图5)对α1β2γ2型GABAA受体的拮抗活性较Gabazine有所提高。在紫外光照射下,这些光活性基团会形成高活性中间体,与GABA结合位点上的氨基酸残基反应并共价结合,从而对α1β2γ2型GABAA受体产生不可逆的拮抗作用。这种特异性不可逆结合为荧光标记GABAA受体提供了新手段,可作为追踪GABAA受体的光活性配体。
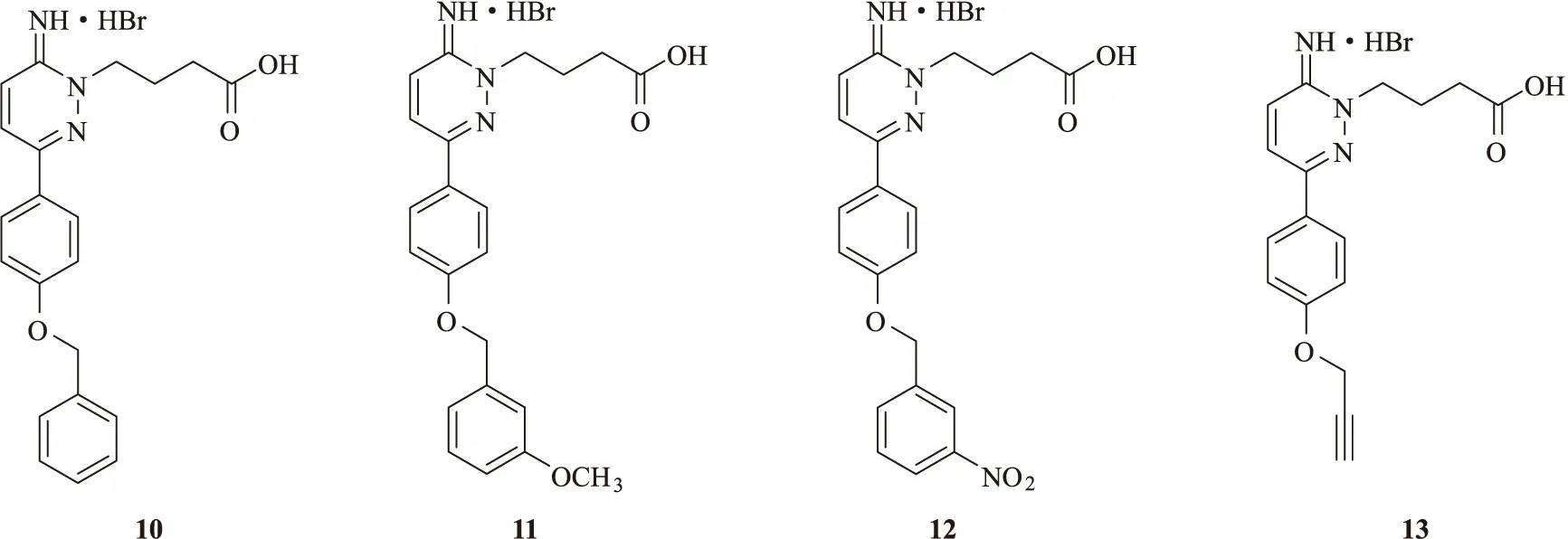
图4 具有苄基和丙炔基的Gabazine衍生物的化学结构式

图5 具有光活性基团的Gabazine衍生物和Azogabazine的化学结构式
Huckvale等[24]在Gabazine结构的3位引入偶氮苯结构,合成了衍生物Azogabazine(17,图5),其对α1β2γ2型GABAA受体的拮抗活性较Gabazine提高了13倍。Azogabazine经过不同波长的光照射后会以不同比例的顺反异构体的形式存在:经紫外光照射后,主要以顺式结构存在;经蓝光照射后,主要以反式结构存在。实验证实,Azogabazine的反式异构体是有效的拮抗剂,而其顺式异构体无拮抗活性。
7 Gabazine及其衍生物对GHB高亲和力结合位点的作用
γ-羟基丁酸(γ-hydroxybutyric acid,GHB)是GABA的代谢物,是哺乳动物大脑中的一种内源性化合物,具有低亲和力和高亲和力靶标[25]。外源性GHB的主要药理作用是由GABAB受体介导的,GABAB受体以低亲和力结合GHB[26-27];而某些GABAA受体的亚型已被证明具有GHB高亲和力结合位点[28]。
NCS-382是GHB高亲和力结合位点的一种选择性配体,Gabazine可抑制两者结合[28]。Krall等[29]合成了3类Gabazine衍生物(18~20,图6),以研究其与GHB高亲和力结合位点和GABAA受体正构结合位点结合的关键结构。结果发现,这些衍生物苯环的3位或4位被给电子基或吸电子基取代后,大多数都能抑制[3H]NCS-382与GHB高亲和力结合位点的结合,表明它们能与GHB高亲和力结合位点结合。其中咪唑并哒嗪类的苯环4位被氯取代后的衍生物20与GHB高亲和力结合位点的结合力最强。

图6 亚氨基哒嗪类、二氢咪唑并哒嗪类和咪唑并哒嗪类衍生物的化学结构式
8 结语
Gabazine及其衍生物对GABA受体具有选择性拮抗作用,在化学和生物相关领域研究较多,但目前尚未开发出实际应用的药品或产品。以Gabazine衍生物为先导化合物,进行进一步结构修饰,有望开发出安全、高效的驱虫药和杀虫剂,也可丰富GABA受体正构位点相关配体的研究。

