溴氰菊酯对大鼠卵巢甾体激素合成的影响
刘晨晨,骆海燕,郐艳荣,高小博,陆彩玲*
(1.国家卫生健康委科学技术研究所遗传优生中心,北京 100081;2. 北京协和医学院研究生院,北京 100005)
卵巢的主要功能是分泌甾体激素和排卵,其中甾体激素主要是雌激素和孕激素[1]。颗粒细胞是哺乳动物卵泡内最大的细胞群[2],也是雌激素和孕激素合成的主要场所[3]。雌激素可以促进卵泡的生长和排卵,刺激子宫内膜增生和血管形成以及维持月经周期等[4]。雌二醇(17β-estradiol,E2)是女性生殖系统中活性最强的雌激素[5]。孕酮(Progesterone,P4)是孕激素的主要活性形式,它维持着卵巢月经周期和妊娠的正常功能,同时也是其它许多甾体激素合成的中间体[6]。甾体激素合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)参与将甾体激素的前体胆固醇由线粒体外膜向线粒体内膜的转运,这是孕酮合成的限速步骤。胆固醇在胆固醇侧链裂解酶(cytochrome P450scc enzyme,P450scc)的作用下可转化为孕烯醇酮,后者在一系列酶的作用下生成雄激素,而雄激素在芳香化酶(aromatase)的作用下又可生成雌二醇[7-9]。Sirtuin1(Sirt1)是一种组蛋白去乙酰化酶,有研究发现,Sirt1可以促进颗粒细胞中孕酮和雌二醇的合成及其关键酶StAR和芳香化酶的表达[10-11]。
甾体激素合成酶类受体内外多种因素的调节,其中外源因素包括环境内分泌干扰物。环境内分泌干扰物包括天然和人工合成的化合物,其中很多都有拟雌激素活性[12]。拟除虫菊酯类农药是一种人工合成农药,具有高效、低毒和广谱等特性,因此成为毒性较强的有机磷和有机氯农药的理想替代品。研究表明,拟除虫菊酯类农药具有拟雌激素活性,是一种环境内分泌干扰物[13]。一些拟除虫菊酯类农药如氰戊菊酯和联苯菊酯会干扰卵巢内甾体激素的合成及关键酶的表达[14-15]。溴氰菊酯(Deltamethrin,DLT)是一种常见的拟除虫菊酯类农药,被广泛应用于经济作物、仓库等害虫防治。Camargo-Mathias等[16]发现DLT可以直接作用于蜱虫的卵巢。Ge等[17]发现DLT可以影响半翅目Delphacidae卵巢内总RNA和蛋白质的合成,抑制产卵。还有报道称,在41%的南非的人母乳样本中检测到了DLT[18]。但目前还没有关于DLT影响卵巢内甾体激素合成及关键酶表达的相关报道,因此本研究探讨了DLT对大鼠卵巢和原代颗粒细胞中甾体激素合成及其关键酶表达的影响。
材料和方法
一、实验材料
1.实验动物:出生21 d的健康雌性Sprague-Dawley(SD)大鼠,SPF级,体重55~60 g,购自北京维通利华,饲养于国家卫生健康委科学技术研究所实验动物中心。动物饲养条件:温度(22±2)℃,空气相对湿度(55±15)%,昼夜周期12/12 h,保证有充足的鼠粮和水。
2.主要试剂和设备:DMEM/F12液体培养基、胎牛血清(Hyclone,美国);孕马血清促性腺激素(PMSG,北京海德创业生物);溴氰菊酯(天津必斯特化学);17-β雌二醇、孕酮电化学发光法试剂盒(罗氏,美国);酶标仪(Bioteck,美国;Gen5,=450 nm);StAR和芳香化酶兔多克隆抗体(ABclonal,美国);P450scc兔多克隆抗体(Cell Signaling,美国);Sirt1兔多克隆抗体(Santa Cruz,美国);辣根过氧化物酶(HRP)-山羊抗兔IgG二抗(北京中杉金桥)。
二、研究方法
1.体内实验:将21 d龄的雌性SD大鼠按体重区段随机分组法进行分组,每组7只,分为空白对照组和实验组。实验组分别给予6.25 mg·kg-1·d-1、12.50 mg·kg-1·d-1DLT(根据大鼠灌胃的半数致死量及文献中DLT的大鼠灌胃剂量[19-21],我们选择了这两个相对较低的给药剂量。),对照组给予玉米油。每天灌胃一次,连续灌胃7 d。于第8天早晨进行安乐死,并对所有大鼠用戊巴比妥钠进行麻醉后取血,保存于非促凝采血管中,收集卵巢用于后续提取蛋白。
2.原代颗粒细胞的分离及培养:21 d龄的雌性SD大鼠每只腹腔注射20 U的PMSG注射液,饲养48 h后颈椎脱臼处死并在无菌条件下迅速取出双侧卵巢,剔除卵巢被膜及周围组织,用1 ml注射器针头刺破卵泡使颗粒细胞释放出来,将颗粒细胞重悬于含15% FBS的DMEM/F12培养基中,并以合适的密度接种于细胞培养皿中,置于37℃、5% CO2的培养箱中培养,以备后续处理。
3.颗粒细胞的处理:用二甲基亚砜将DLT溶解配成300 mmol/L的贮存液为母液,依次梯度稀释成200 mmol/L、100 mmol/L,贮存于-20℃冰箱,分装备用。待颗粒细胞贴壁培养24~48 h后,用无血清培养基饥饿细胞12 h后,换液,并分别用二甲基亚砜(对照组)、100 μmol/L、200 μmol/L、300 μmol/L的DLT处理细胞48 h。
4.电化学发光法测定雌二醇和孕酮:收集DLT处理后的大鼠血清和颗粒细胞上清液,储存于-80℃,按照雌二醇和孕酮电化学发光法试剂盒说明书测定雌二醇和孕酮的水平。
5.组织及细胞蛋白提取:组织总蛋白提取时每0.1 g组织加100 μl裂解液(RIPA、100×PMSF、100×NaF、蛋白酶抑制剂),用超声波细胞粉碎机超声10~20 s;细胞总蛋白提取时需吸去细胞培养基,用生理盐水润洗细胞,收集细胞于灭菌的1.5 ml离心管中,室温,800 rpm离心,弃去生理盐水,加适量配好的裂解液裂解蛋白。之后冰上裂解30 min,期间每10 min旋涡震荡15 s,4℃,13 000 rpm离心15 min,收集上清,分装,-80℃存放。
6.Western Blot检测方法:利用BCA蛋白定量试剂盒(Sigma,美国)进行蛋白浓度定量,12% SDS-PAGE分离蛋白,转印至硝酸纤维素膜上。用5%的脱脂牛奶封闭1 h后,分别用一抗4℃孵育过夜,PBST漂洗,随后用HRP标记的二抗室温孵育1 h,PBST漂洗后,ECL化学显影。实验中用β-actin作为内参照,利用Image J软件进行灰度定量分析。
三、统计学分析

结 果
一、DLT对大鼠卵巢内甾体激素合成的影响
对大鼠进行了DLT浓度为0、6.25、12.50 mg·kg-1·d-1为期7 d的暴露处理,收集血清,通过电化学发光法检测雌二醇和孕酮水平的变化。结果显示,与对照组相比,实验组的雌二醇水平升高、孕酮水平下降,且差异均具有统计学意义(P<0.05)(图1)。

A:雌二醇;B:孕酮;与对照组比较,*P**P图1 DLT暴露7 d后大鼠血清中甾体激素分泌水平的变化
二、DLT对大鼠卵巢内甾体激素合成关键酶及Sirt1表达的影响
为了检测DLT暴露处理大鼠,卵巢内甾体激素合成关键酶及Sirt1表达量的变化,我们用Western Blot法对卵巢组织中StAR、P450scc、芳香化酶及Sirt1的表达量进行了检测。结果显示,与对照组相比,实验组中StAR、P450scc、芳香化酶及Sirt1的表达量均显著升高(P<0.01),且StAR、P450scc和芳香化酶的表达量具有剂量依赖性(图2)。
三、DLT对原代颗粒细胞中甾体激素合成的影响
为了进一步探究DLT对颗粒细胞中甾体激素合成的影响,我们分离了大鼠原代颗粒细胞,分别用0、100、200、300 μmol/L的DLT处理48 h后,收集上清,通过电化学发光法检测颗粒细胞中雌二醇和孕酮分泌水平的变化。结果显示,与对照组相比,实验组中雌二醇水平显著升高(P<0.001),孕酮水平没有显著性变化(P>0.05)(图3)。
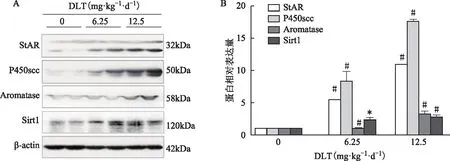
A:Western Blot检测;B:灰度分析柱状图;与对照组比较,*P#P图2 DLT暴露7 d后大鼠卵巢中StAR、P450scc、芳香化酶及Sirt1的表达情况

A:雌二醇;B:孕酮;与对照组比较,*P图3 DLT处理颗粒细胞48 h后上清液中甾体激素分泌水平的变化
四、DLT对原代颗粒细胞中甾体激素合成关键酶及Sirt1表达的影响
进一步检测不同浓度DLT(0、100、200、300 μmol/L)处理下,原代颗粒细胞中甾体激素合成关键酶及Sirt1表达量的变化,我们用Western Blot法对颗粒细胞中StAR、P450scc、芳香化酶及Sirt1的表达量进行了检测。结果显示,与对照组相比,随着DLT浓度的升高,StAR、P450scc、芳香化酶及Sirt1的表达量均显著升高(P<0.001),且具有剂量依赖性(图4)。

A:Western Blot检测;B:灰度分析柱状图(各处理组4柱自左至右分别示0、100、200、300 μmol/L处理后);与对照组比较,*P图4 DLT处理48 h后颗粒细胞中StAR、P450scc、芳香化酶及Sirt1的表达情况
讨 论
DLT可以干扰雄性生殖系统,并诱导睾丸细胞凋亡[20,22]。但目前关于DLT对雌性生殖系统影响方面的研究主要以昆虫为研究材料[16-17],其对哺乳动物卵巢功能影响方面的研究鲜见报道。本研究发现了DLT可以影响大鼠卵巢内甾体激素的分泌及其关键酶的表达。我们分别进行了体内外实验,探究在DLT暴露下,大鼠卵巢和原代颗粒细胞中孕酮和雌二醇分泌量的变化,同时检测了影响这些甾体激素合成的关键酶StAR、P450scc及芳香化酶表达量的变化。体内实验中,我们发现在DLT暴露下孕酮的分泌量减少了,且有统计学差异(P<0.05)。同时检测了控制孕酮合成的关键酶StAR和P450scc表达量的变化,发现随着DLT暴露浓度的升高,StAR和P450scc表达量均逐渐增加(P<0.001)。孕酮分泌量变化与其关键酶表达量变化不一致,这可能是由于孕酮更快地转化成了代谢产物,从而造成检测到的孕酮水平降低。Nimrod[23]发现FSH促进大鼠卵巢颗粒细胞中孕酮生成的同时也激活了一系列促使孕酮代谢的脱氢酶和还原酶。Crellin[24]发现甲氧滴滴涕抑制猪颗粒细胞中孕酮生成的同时,促进了P450scc的表达。同时在体内实验中,雌二醇的分泌量升高了(P<0.05),这可能是芳香化酶表达量增加(P<0.001)的原因。体外实验中,我们发现在DLT处理下,大鼠原代颗粒细胞中孕酮水平基本不变,雌二醇分泌量有升高(P<0.001),但数值变化不大。我们还检测到孕酮合成的关键酶StAR和P450scc表达量均逐渐增加(P<0.001),且呈剂量依赖效应。雌二醇合成的关键酶芳香化酶的表达量增加了(P<0.001)。StAR和P450scc表达量增加幅度较大,而孕酮和雌二醇的变化水平较微弱,这可能是由于DLT同时促进了孕酮和雌二醇的代谢过程,造成检测到的孕酮和雌二醇的变化水平不大。Chen等[25]发现三氯生促进大鼠原代颗粒细胞中雌二醇合成酶芳香化酶表达的同时,也促进了雌二醇代谢酶Cyp1a1和Cyp1b1的表达。总之,DLT对卵巢甾体激素合成是多因素、多层次的调节,雌二醇和孕酮的分泌水平取决于其合成和代谢速率的动态平衡。
Reverchon等[26]发现内脂素可以通过Sirt1来促进牛卵巢颗粒细胞中雌二醇和孕酮的分泌,并且促进StAR的表达。本研究发现,在DLT处理下甾体激素关键酶StAR、P450scc、芳香化酶表达量增加的同时,Sirt1的表达量也增加了(P<0.01),这提示DLT可能通过Sirt1来影响甾体激素合成关键酶的表达及甾体激素的合成。但这还需进一步的探索和验证。
综上,在DLT的暴露下,体内外实验中甾体激素合成关键酶StAR、P450scc和芳香化酶表达量均增加了,同时体内实验中孕酮的分泌量减少、雌二醇的分泌量增加,体外实验中雌二醇的分泌量增加。孕酮对于腺垂体激素分泌、排卵、孕卵着床和正常妊娠的维持有重要作用,还能促进乳腺腺泡的发育和成熟,它的减少会影响生殖器官的生长发育和功能[27]。Vorherr[28]发现雌二醇的增加会使下丘脑-垂体-卵巢轴功能紊乱、月经不调以及乳腺纤维囊性增生。雌二醇还与一些癌症如乳腺癌、卵巢癌和子宫内膜癌等的发生有关[29-31]。这提示DLT可能会通过降低孕酮分泌量和提高雌二醇分泌量来干扰雌性生殖系统。本研究在一定程度上为评估DLT对女性生殖功能的影响提供了依据。

