二步消化分离提取不同比例的混合斑精子DNA初探
何佳烘
(广州市公安局黄埔区分局,广东 广州515800)
含有精子的混合生物检材是法医物证学领域研究的一个热门课题,按照GAT 383-2014法庭科学DNA实验室检验规范关于混合斑的提取与纯化方法,采用差异裂解法提取精子DNA。在实际检案过程中,对混合斑检材前期进行消化处理、精子沉淀后期进行洗涤纯化都需要耗费大量时间,特别是当女性受害者被强奸时为处女或正处月事期时,事后提取到的混合斑检材多为大量女性阴道血液与少量男性精液的混合物,检材中男女成分比例悬殊,对检材进行前期预处理时需耗费更长时间,且单纯增加消化洗涤时间次数常常未能完全清除混合检材中受害人成分。本文通过改进传统差异裂解法的洗涤程序,成功提取到该类混合斑中的单一女性成分,并能保证检验结果的均衡性[1]。
1 材料与方法
1.1 样本
提取正常男性精液(P30检测呈阳性)若干,人工制作男性精液与女性血液混合的样本,按照男性精液与女性血液为1∶1,1∶10,1∶30,1∶50,1∶80,1∶100的配比分别制作面积为(1×1)cm2各10份的混合斑样本,采用传统差异裂解法与改进的差异裂解法提取检材精子DNA。
1.2 仪器和试剂
9700PCR仪(美国ABI);3130XL测序仪(美国ABI);博坤全自动提取工作站及其提取试剂盒(中国辽宁);QIAsymphony提取蛋白酶(德国凯杰);PowerPlex21TM试剂盒(美国Promega)。
1.3 方法
1.3.1 传统差异裂解法
(1)将样本剪碎后加入200uL TNE缓冲液,37℃保温1h,加入20uL 10%SDS和10uL 10mg/mL PK,37℃保温2h;
(2)使用NAO套管离心10min,6000 r/min去除载体,去除上清液,沉淀物分别加入800uL TNE离心10min,6000 r/min,洗涤3次;
(3)沉淀物加入20uL DTT、10uL 10mg/mL PK,振荡混匀至沉淀溶解后将所有液体移入博坤提取消化过滤板,使用博坤试剂盒提取DNA,模板洗脱体积为50uL,4℃保存备用[2]。
1.3.2 改进差异裂解法
(1)将样本剪碎后置于1.5mL EP管,分别加入600uL TNE缓冲液、60uL 10%SDS和10uL 10mg/mL PK,37℃保温2h,EP管离心10min,6000 r/min,自上而下吸取去除上清液500uL,余下液体分别加入300uL TNE缓冲液、30uL 10%SDS和10uL 10mg/mL PK,37℃保温2h;
(2)移入NAO套管离心10min,6000 r/min去除载体,去除上清液,沉淀物分别加入800uL TNE离心10min,6000 r/min,洗涤1次;
(3)沉淀物加入20uL DTT、10uL 10mg/mL PK,振荡混匀至沉淀溶解后将所有液体移入博坤提取消化过滤板,使用博坤试剂盒提取DNA,模板洗脱体积为50uL,4℃保存备用[3]。
1.3.3 DNA扩增及分型检测
参照PowerPlex21TM试剂盒说明书操作进行扩增,取PCR产物经3130XL测序仪电泳,用GeneMapper ID-X软件进行分析并获得分型图谱。对于获得基因座在13个以上、各等位基因峰高于100rfu且峰值间比不小于1/3的样本判定为成功获得分型的样本。
2 结果
本文中,混合斑检材经两种差异裂解法提取的检验结果见表1。
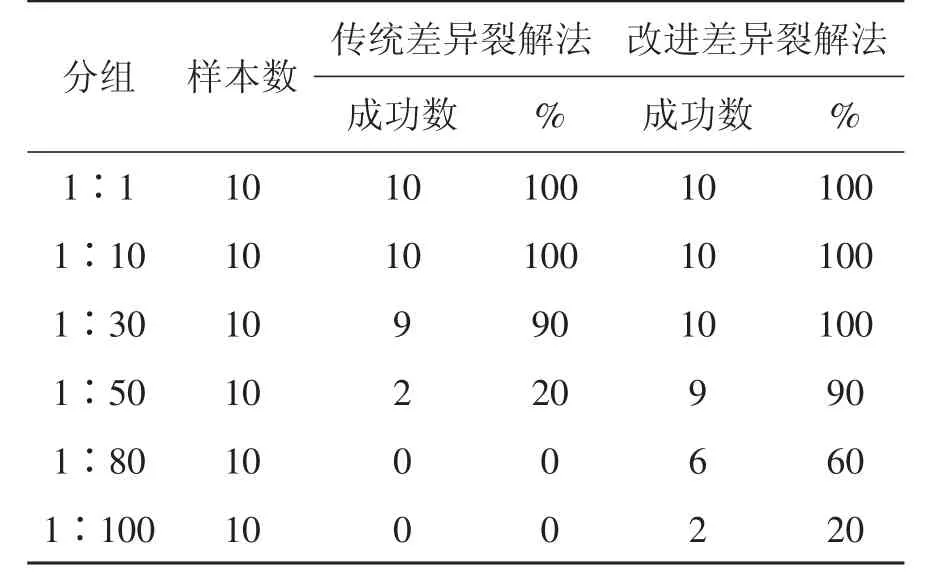
表1 两种差异裂解法提取混合斑中精子的DNA检测结果
比较两种差异裂解法提取的检验结果,改进的差异裂解法检出率明显高于传统差异裂解法。并且,样本精血比例越悬殊、检测难度越高时,两者差异越显著。
3 讨论
用传统的差异裂解法处理混合斑检材时,上皮细胞与精子细胞的分离并不都是完全的,特别是在含有大量女性上皮细胞且精子细胞含量少的混合斑检材中,一些上皮细胞在第一步消化时没有消化干净,使得精子DNA溶液中出现女性成分,表现为混合分型,不利于结果判断。实验分析,两种方法在混合斑精血比例不大的情形下,均能很好地获得混合斑中的精子DNA。而当混合斑检材中精血比例慢慢增大时,传统差异裂解法即使添加过量的试剂也无法在短时间内通过一次性消化获得稳定的核酸得率和纯度,在后期洗涤过程中往往会因为前期女性成分消化不完全导致丢失大部分精子DNA基因座甚至无法检出;改进的差异裂解法在前期处理混合斑时增加了纯化和二次消化步骤,在精血比例悬殊先行洗涤进行纯化以除去大部分血液成分,二次消化进一步减少女性成分,后期的洗涤使细胞碎片与精子沉淀分开,减少了混合斑中精子的损失,这大大提高了分离提取混合斑精子DNA的成功率[4]。
综上所述,由于改进的差异裂解法使用的试剂与传统方法无异,无需特殊设备,适用于常见的混合斑检材,而提取效能上较前者更具优势,且检验结果峰值具有更好的均衡性,在日常检案中具有较高的应用价值。

