Pb2+对青蛤的急性毒性及对其血淋巴液中免疫相关酶活性的影响
王 瑞, 黄雨辰, 熊德东, 黄 亚, 田 甜, 孟 彬, 梁 健, 2
Pb2+对青蛤的急性毒性及对其血淋巴液中免疫相关酶活性的影响
王 瑞1, 黄雨辰1, 熊德东1, 黄 亚1, 田 甜1, 孟 彬1, 梁 健1, 2
(1. 天津农学院 水产学院, 天津市水产生态及养殖重点实验室, 天津 300384; 2. 天津市海洋牧场技术工程中心, 天津 300457)
采用静态急性毒性实验研究了重金属Pb2+对青蛤()的生物急性毒性效应, 测定了在96 h Pb2+半致死浓度的1/10(TC组)和1/100(SC组)两个浓度胁迫下, 血淋巴液中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和溶菌酶(LSZ)活性的变化。结果显示: Pb2+的96 hLC50为7.938 mg/L; SC组ACP活性表现为诱导-抑制趋势, 除4 d外均与对照组差异显著(<0.05), TC组为抑制趋势, 为3个组中的最低, 与对照组差异显著(<0.05); 实验组SC组和TC组的AKP、LSZ活性均表现为前期为诱导中后期受抑制的趋势, 与对照组差异显著(<0.05), 且TC组活性始终低于SC组, 表现出Pb2+的胁迫浓度越高酶活性受到的抑制作用越大。以上结果表明, 重金属Pb2+对青蛤的毒性级别为高毒级, 能造成青蛤免疫相关酶的活性受到抑制, 影响青蛤的免疫能力, 而且这种抑制作用随着环境中Pb2+浓度增加而增加。
青蛤(); Pb2+; 急性毒性; 免疫相关酶
铅(Pb)是一种非常常见的有色重金属元素, 具有难降解、难代谢、可沿食物链堆积和蓄积的特性, 并且污染后难以发现。多数学者认为Pb并非动物生长的必需元素, 而是一种对动物有累积伤害的污染物,是地球上分布最广, 最严重的环境污染物之一[1]。近年来随着经济的发展, 工厂含铅废水的排放以及废旧电池的丢弃, 使Pb2+等重金属离子随着江河的冲刷作用最终进入海洋。而沿海的海洋生物, 特别是滩涂贝类会通过生物富集效应将Pb2+等重金属离子累积在体内, 造成自身损害, 成为水产养殖健康发展的重要障碍。同时随着时间的推移以及食物链的传递作用, Pb2+会对的海洋生态系统以及人类的健康产生损害。研究Pb2+等重金属富集效应对贝类的影响越来越受科学家的关注, 已报道有近江洋牡蛎()[2]、栉孔扇贝()[3]、菲律宾蛤仔()[4]、四角蛤蜊()[5]、缢蛏()[6]、泥蚶()[7]。同时全国各省市也在监测本地区海域贝类的重金属Pb2+污染状况, 以评估人群膳食暴露风险[8-10]。
青蛤()属软体动物门、瓣鳃纲、帘蛤目、帘蛤科, 民间通常称之为黑蛤、圆蛤、铁蛤等, 其生长速度快, 适应性强, 分布范围广, 种群密度大, 是重要的经济贝类[11]。由于沉降作用Pb2+在水体下层尤其是在底泥中含量会比较高, 而青蛤移动性差, 活动范围较小, 长期栖息于底泥中, 且为滤食性, 其Pb2+富集量会尤为严重。因此, 本研究通过确定Pb2+对青蛤的半致死浓度和安全浓度, 研究这两种浓度胁迫下青蛤血淋巴液中免疫相关酶活性的变化, 全面分析青蛤对Pb2+应激反应机制, 进而评估重金属Pb2+污染对青蛤的存活趋势以及养殖产业的影响程度。
1 材料与方法
1.1 实验材料
实验用青蛤取自天津独流减河河口区, 于天津海升水产养殖公司暂养7 d, 期间使用沙滤海水, 盐度25, 每天投喂小球藻()3次, 投喂量2×104cell/L, 并连续充气。在实验开始前24 h停止投喂, 挑选身体健康, 壳面无破损, 闭壳反应迅速、大小相似(壳长15.979 mm±0.150 mm; 壳宽17.043 mm±0.176 mm; 壳高9.862 mm±0.180 mm)的青蛤进行实验。
1.2 急性毒性实验
使用醋酸铅配置实验所需母液, 并根据预实验结果, 参照等对数间距法[11], 设置10.00、13.90、19.05、26.30、36.30和50.12 mg/L 6组浓度梯度, 每组3个重复, 并以正常海水组为对照组, 每组放入青蛤20枚(表1)。试验期间不投饵不充气, 每4 h观察各组情况, 及时挑出死亡个体并做记录(以外套膜收缩、贝壳张开、用玻璃棒触碰无闭壳反应做为死亡的判断依据), 计算Pb2+的96 h半致死浓度(96 h LC50), 安全浓度为96 h LC50的1/100。每6 h测量并记录pH值及温度的变化。
1.3 数据处理
对实验数据用 SPSS 21.0 软件进行线性回归分析, 继而计算半致死浓度、95%置信区间和相关系数2。单因素方差分析用于方差分析, Duncan test检验数据的显著性, 结果表示为: 平均数±标准差, 显著性水平为<0.05。
2 结果与分析
2.1 Pb2+对青蛤的急性毒性
各实验组急性毒性实验过程中海水温度、pH值变化如图1所示。各实验组在各时间点上的水温差异很小, 最高时相差1.3℃, 整个实验期间温度变化范围为28.0~31.5℃; 各实验组的pH值差异最大值出现在78 h, 为1.47; 整个试验期间海水pH值的变化范围为6.60~8.20; 海水盐度为人工调制, 稳定于25‰, 因此可认为本实验的外界环境因子相对稳定。
通过线性回归线分析, 得出死亡概率单位与醋酸铅溶度对数的相关方程为=4.77419+3.70986, 相关系数2=0.988。醋酸铅(CH3COO)2Pb对青蛤的96 h LC50=19.360 mg/L, 95%的置信区间为17.554~21.230 mg/L, 安全浓度为0.194 mg/L, 通过换算得出Pb2+对青蛤的96 h LC50为7.938 mg/L, 安全浓度为0.0794 mg/L。

图1 急性毒性实验过程中海水温度、pH值变化情况

表1 不同浓度铅离子对青蛤的急性毒性
2.2 Pb2+对青蛤的胁迫
胁迫实验期间各实验组海水温度、pH值变化如图2所示。SC和TC实验组在各时间点上的温度基本一致, 与对照存在一定温差, 最大温差出现在第12 d, 差值为1.7℃, 整个实验期间温度变化范围为28.3~31.3℃; 实验组与对照组的pH值相差不大, 最大差值出现在11 d, 为0.28, 整个试验期间海水pH值的变化范围为7.67~8.27。海水盐度为人工调制, 稳定于25‰, 因此可认为本实验的外界环境因子相对稳定。
2.2.1 对酸性磷酸酶的浓度影响
由图3可知, 与对照组相比, SC组ACP活性整体表现为先诱导后抑制趋势, 除4 d时在各时间点上与对照组差异显著(<0.05), 最低值出现在第10 d, 仅为(0.94±0.01)U/mg; TC组整体表现抑制趋势, 整个实验过程中均为三个实验组中的最低, 除4 d外与对照组差异显著(<0.05); 最低值出现在第10 d, 为(0.74±0.01)U/mg。

图2 胁迫实验期间温度、pH值变化情况

图3 不同Pb2+浓度胁迫对青蛤血淋巴液ACP活性的影响
注: 同一时间点上不同的字母表示组间差异显著(<0.05), 下同
2.2.2 对碱性磷酸酶的浓度影响
如图4所示, 胁迫的第2 d, 实验组SC组和TC组的AKP活性出现短暂的诱导作用, 随胁迫时间的推移在第4 d后就一直处于受抑制作用; SC组在受抑制期间除第8 d外均与对照组差异显著(<0.05), 最小值出现在第10 d仅为(0.55±0.05) U/mg; TC组在受抑制期间均与对照组差异显著(<0.05), 最小值出现在第10d仅为(0.23±0.03) U/mg。
2.2.3 对溶菌酶的浓度影响
如图5所示, 实验组SC组和TC组的LSZ活性在实验前期表现为诱导趋势, 中后期表现为抑制趋势, 均在第4 d时产生最大诱导作用, 此时SC组活性最大值为3.73 U/mg, TC组为4.20U/mg; 随后两实验组LSZ活性迅速被抑制, 期间两实验组均与对照组差异显著(<0.05), 且TC组活性始终低于SC组; SC组LSZ活性最低值(1.23±0.01) U/mg出现在第6 d, TC组在第12 d时出现最低值(1.05±0.07) U/mg。

图4 不同Pb2+浓度胁迫对青蛤血淋巴液AKP活性的影响
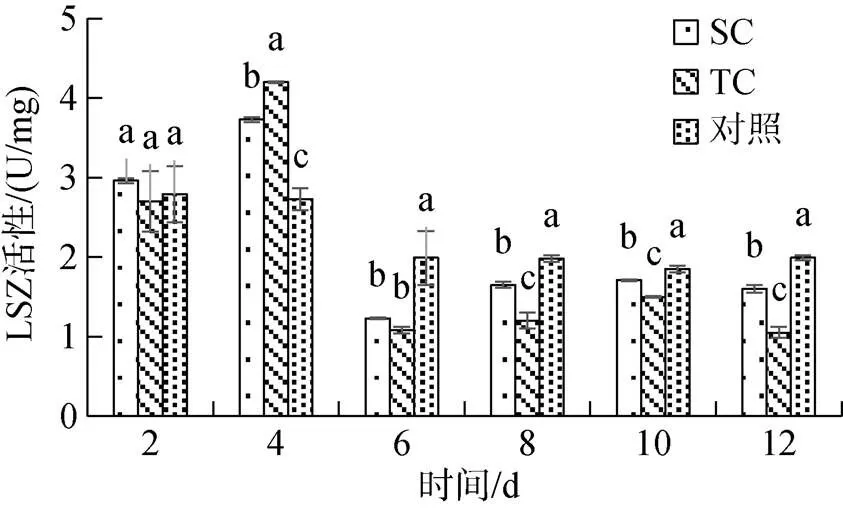
图5 不同Pb2+浓度胁迫对青蛤血淋巴液LSZ活性的影响
3 讨论
3.1 急性毒性
急性毒性实验是指物质在高浓度、短时期(通常为24~96 h)引起受试生物群体出现一定数量的死亡或者产生其他效应的实验方法, 进而得出某种物质对生物的半致死浓度和安全浓度, 为找出该物质的作用途径、剂量-效应关系、作用机理等其他的动物实验提供依据支撑, 同时也可以为环境监测提供预警值, 因而沿用至今, 成为最常用的毒理学实验方法之一。水生动物对水环境的变化很敏感, 当水体中蓄积一定浓度有毒物质时, 会出现中毒现象, 具体表现为: 索饵、生殖或者形态的改变; 迟钝迟发性症状、行为反常、运动痉挛失调或游动停滞、麻痹、甚至停止摄食而死; 种群数量和结构发生变化等[13]。本实验开始时, 各个浓度组的青蛤无异常表现, 不久后轻触青蛤的水管个别个体收缩缓慢, 表现出明显的应激现象。随着作用时间的延长, 更多的个体表现出类似的应激反应且更加迟钝, 严重者出现外套膜收缩、闭壳肌无力、贝壳张开等明显的中毒表现, 最终造成死亡。这也与海湾扇贝的铅中毒的症状相一致[14]。
符修正等人[15]研究得出Pb2+对波纹巴非蛤的96 h LC50为4.119 mg/L, 毒性级别为高毒级(LC50为1~100 mg/L)。刘琼玉等[16]进行重金属锌、铅对菲律宾蛤仔的急性毒性试验结果显示, Pb2+对菲律宾蛤仔的96 h LC50为14.28 mg/L。本试验研究得到Pb2+对青蛤的96 h LC50为7.938 mg/L, 安全浓度为0.0794 mg/L,毒性级别属于高毒级。这表明即使是相同的物质, 其毒性仍然有所差异, 这可能和生物体自身的耐受性以及物质在机体内的代谢、作用方式有一定关系。
本试验中青蛤Pb2+安全浓度为0.0794 mg/L, 高于中华人民共和国农业部发布的《无公害食品海水养殖水质NY5052-2001》要求的≤0.05 mg/L。但贝类对重金属具有很强的富集作用, 当养殖海水水质达标时也多加关注, 应及时采取措施, 减少不必要的损失。
3.2 Pb2+胁迫对免疫相关酶活性的影响
酸性磷酸酶(ACP)是动物代谢过程中重要的调节酶。在酸性内环境下催化磷酸单酯水解, 参与磷酯的代谢和其他重要的生物学功能, 通常认为酸性磷酸酶主要存在于溶酶体内, 是溶酶体的标志酶之一[17]。卢斌等[18]将白氏文昌鱼()分别暴露在Cd2+安全浓度的水体中7 d, 发现Cd2+随时间的推移, 酸性磷酸酶的活性在第1 d、7 d高于对照组, 呈先诱导后抑制的趋势; 白秀娟等[19]的实验表明, 在较高浓度的重金属暴露下文昌鱼的ACP表现为显著抑制; 本实验结果与上述研究一致, 本实验中低Pb2+浓度的SC组ACP活性整体表现为先诱导后抑制趋势, 而高Pb2+浓度的TC组整个试验期间均受到抑制。
碱性磷酸酶是一种含锌的糖蛋白[20], 广泛分布于动物的各个组织内, 在碱性环境中(最佳pH值约为10)可以催化各种醇和磷酸苯酚的水解[21], 对生物体的免疫作用具有重要意义。赖德荣等研究表明[22]镉污染对翡翠贻贝()碱性磷酸酶的影响有明显的抑制作用, 在Cb2+浓度在1~500 µg/L范围内就会有明显的抑制作用, 并且与水体中的镉浓度增加而出现的抑制作用且作用随着镉浓度的增加越来越显著。本实验中, SC组和TC组AKP活性在实验前期出现短暂的诱导作用, 但随后便一直受抑制作用, 且高Pb2+浓度的TC组受抑制程度要大于安全浓度的SC组。
溶菌酶(lysozyme) 又名 N-乙酰胞壁质聚糖水解酶或胞壁质酶, 是一种小分子质量的碱性蛋白水解酶, 是体内最重要的非特异性免疫因子之一, 它不仅可以催化细菌细胞壁的水解, 还可以使细菌在体内免疫过程中溶解和死亡, 诱导其他免疫因子的合成和分化, 参与机体内多种免疫反应, 并在机体特异性免疫和非特异性免疫中发挥重要作用, 常作为评价机体免疫水平的重要指标之一[23]。贝类溶菌酶是由在研究美洲牡蛎()血淋巴液的过程中发现的[24]。丁鉴峰等[25]研究证实, 海洋污染物浓度对所在海区的菲律宾蛤仔血细胞的亮氨酸氨基肽酶和溶菌酶活性有显著的抑制作用, 污染物浓度越高抑制作用越大。李晓梅等[26]研究表明, 近江牡蛎长期处于低pH、铅胁迫或Pb2+胁迫共存的条件下, 会导致其组织溶菌酶含量降低和耐受性降低。本实验中实验组SC组和TC组的溶菌酶活性在实验前期表现为诱导-抑制的变化趋势, 在第4 d时产生最大诱导作用, 随后两实验组LSZ活性迅速被抑制, 期间两实验组均与对照组差异显著(<0.05)。
当外来物质进入体内或随着环境的变化, 贝类溶酶体含有的各种水解酶, 如酸性磷酸酶, 碱性磷酸酶和溶菌酶, 会参与杀害和消除异物[26]。本实验中对照组青蛤的酸性磷酸酶、碱性磷酸酶或溶菌酶的活性随时间呈先降低再升高趋势, 可能由于青蛤体内被异物入侵, 它们参与了体内杀害和消除异物的过程。本实验中青蛤在两种Pb2+浓度(SC组和TC组)胁迫下血淋巴液中ACP、AKP和LSZ活性均出现先诱导后抑制的变化趋势, 而且高Pb2+浓度的TC实验组酶活性受到的抑制作用明显大于低Pb2+浓度的SC实验组; 这种促进酶活性在胁迫初期升高的现象可能是由于“毒性兴奋效应”造成的, Stebbing[27]认为低剂量毒物可以引起一系列修复和维持机制, 例如通过激活转录因子和激酶, 增加细胞保护和修复蛋白(例如, 抗氧化酶, 伴侣蛋白, 生长因子, 免疫因子等), 称为“毒物兴奋作用”。但随着胁迫时间的延长以及有毒物质浓度的增大, 毒物会改变血细胞内溶酶体膜的通透性、减少修复性蛋白表达量甚至引起血细胞溶解, 导致溶酶体失活及酶合成量减少, 造成酶活性受抑制。
[1] 张永静, 徐维娜, 刘文斌, 等. 饲料铅对建鲤生产性能及组织酶活性的影响[J]. 浙江农业学报, 2012, 24(2): 0-227. Zhang Yongjing, Xu Weina, Liu Wenbin, et al. Effect of feed lead on production performance and tissue enzyme activity of Jianyu[J]. Zhejiang Journal of Agricultural Sciences, 2012, 24(2): 0-227.
[2] 赵鹏, 张荣灿, 覃仙玲, 等. 北部湾钦州港近江牡蛎重金属污染分析[J]. 水产学报, 2017, 41(5): 806-815.Zhao Peng, Zhang Rongcan, Yan Xianling, et al. Heavy metal pollution analysis of oyster in Qinzhou Port of Beibu Gulf[J]. Journal of Fisheries of China, 2017, 41(5): 806-815.
[3] 王凡, 赵元凤, 吕景才, 等. 栉孔扇贝对铜、铅、镉的累积效应[J]. 水产科学, 2007, 26(2): 63-66. Wang Fan, Zhao Yuanfeng, Lü Jingcai, et al. Cumulative effects of scallops on copper, lead and cadmium[J]. Fisheries Science, 2007, 26(2): 63-66.
[4] 陈惠光, 刘仁沿. 菲律宾蛤仔Cu, Pb, Zn, Cd及遗传杂合度的相互关系研究[J]. 海洋环境科学, 1999, 1: 29-32.Chen Huiguang, Liu Renyan. Relationship between Cu, Pb, Zn, Cd and Genetic Heterozygosity in Clam Clam[J]. Marine Environmental Science, 1999, 1: 29-32.
[5] 刘兵钦, 刘爱芬, 廖燕哉. 重金属Cu、Zn和Pb对白蛤酯酶同工酶活性的影响[J]. 宁德师范学院学报(自然科学版), 2015, 27(3): 247-251.Liu Bingqin, Liu Aifen, Liao Yanzai. Effects of Heavy Metals Cu, Zn and Pb on Isoenzyme Activity of Angelin[J]. Journal of Ningde Teachers College (Natural Science), 2015, 27(3): 247-251.
[6] 王兴强, 阎斌伦, 曹梅. 氯化镉、硝酸铅和氯化高汞对缢蛏存活率的影响[J]. 水生态学杂志, 2006, 26(6): 82-83.Wang Xingqiang, Pei Binlun, Cao Mei. Effects of Cadmium Chloride, Lead Nitrate and Chloride Mercury on the Survival Rate of Alfalfa[J]. Journal of Water Ecology, 2006, 26(6): 82-83.
[7] 谢清清, 陈彩芳, 吴林德, 等. 铅(Pb)胁迫对泥蚶血液MT及Vg基因表达的诱导效应研究[J]. 海洋科学, 2017, 41(11): 75-81. Xie Qingqing, Chen Caifang, Wu Linde, et al. Induced effects of lead stress on MT and Vg gene expression in loach blood[J]. Ocean Science, 2017, 41(11): 75-81.
[8] 王舟, 黄薇, 潘柳波, 等. 深圳海域贝类铅和镉污染及其膳食暴露评估[J]. 华南预防医学, 2017, 4: 322- 326.Wang Zhou, Huang Wei, Pan Liubo, et al. Assessment of lead and cadmium contamination and dietary exposure in shellfish in Shenzhen sea area[J]. South China Journal of Preventive Medicine, 2017, 4: 322-326.
[9] 戚原野, 王李宝, 万夕和, 等. 江苏沿岸四种贝类软体铅的含量特征及其风险评价[J]. 农业环境科学学报, 2016, 2: 253-260.Qi Yuanye, Wang Libao, Wan Xihe, et al. Content Characteristics and Risk Assessment of Lead in Four Shellfish Softs along the Coast of Jiangsu Province[J]. Journal of Agro-Environment Science, 2016, 2: 253-260.
[10] 陈大红, 李桓, 陈涛. 闽北地区淡水贝类有害金属铅镉含量调查与食用建议[J]. 中国卫生检验杂志, 2010, 9: 2320-2322.Chen Dahong, Li Huan, Chen Tao. Investigation and Edible Recommendations of Lead and Cadmium in Freshwater Shellfish in Weibei Area[J]. Chinese Journal of Health Inspection, 2010, 9: 2320-2322.
[11] 梁健, 雷雅雲, 李永仁, 等. Cu2+对青蛤的胁迫效应[J].海洋科学, 2015, 39(11): 74-78. Liang Jian, Lei Yayun, Li Yongren, et al. Stress effects of Cu2+on barley[J]. Marine Science, 2015, 39(11): 74-78.
[12] 张宜奎, 宋秀凯, 刘爱英, 等. 重金属Cd2+、Cu2+对文蛤的急性毒性[J]. 海洋湖沼通报, 2011, 3: 51-56. Zhang Yikui, Song Xiukai, Liu Aiying, et al. Acute toxicity of heavy metals Cd2+and Cu2+to wenyu [J]. Ocean Lakes Bulletin, 2011, 3: 51-56.
[13] 沈燕飞, 张咏, 厉以强. 水质生物毒性检测方法的研究进展[J]. 环境科技, 2009, 22(S2): 68-72. Shen Yanfei, Zhang Yong, Li Yiqiang. Research progress on water toxicity test methods for water quality[J]. Environmental Science and Technology, 2009, 22(S2): 68-72.
[14] 刘亚杰, 王笑月. 锌、铜、铅、镉金属离子对海湾扇贝稚贝的急性毒性试验[J]. 水产科学, 1995, 14(1): 10-12. Liu Yajie, Wang Xiaoyue. Acute Toxicity Test of Zinc, Copper, Lead and Cadmium Metal Ions on Bay Scallop Juveniles[J]. Fisheries Science, 1995, 14(1): 10-12.
[15] 符修正, 于淑池, 袁艳菊, 等. 铅对波纹巴非蛤的急性毒性和组织蓄积性研究[J].安徽农业科学, 2016, 44(10): 137-139, 143.Fu Xiuzheng, Yu Shuchi, Yuan Yanju, et al. Study on Acute Toxicity and Tissue Accumulation of Lead to Corrugated Paeoniae[J]. Journal of Anhui Agricultural Sciences, 2016, 44(10): 137-139, 143.
[16] 刘琼玉, 洪华生, 蔡立哲. 重金属锌、铅对菲律宾蛤仔的急性毒性试验[J].台湾海峡, 1997, 1: 50-54.Liu Qiongyu, Hong Huasheng, Cai Lizhe. Experimental Test on Acute Toxicity of Heavy Metals Zinc and Lead to Philippine Clam[J].Journal of Taiwan Strait, 1997, 1: 50-54.
[17] Duff S M G, Sarath G, Plaxton W C. 2010. The role of acid phosphatases in plant phosphorus metabolism., 2010, 90(4): 791-800.
[18] 卢斌, 柯才焕, 王文雄. 低浓度镉、锌暴露对白氏文昌鱼的毒性累积及其几种重要酶活性的影响[J]. 厦门大学学报(自然科学版), 2012, 51(4): 767-773. Lu Bin, Ke Caihuan, Wang Wenxiong. Effects of Low Concentration of Cadmium and Zinc on Toxicity Accumulation and Several Important Enzyme Activities of Amphioxus sinensis[J]. Journal of Xiamen University (Natural Science), 2012, 51(4): 767-773.
[19] 白秀娟, 卢伙胜, 唐峰华. Cu2+、Zn2+和Cd2+对茂名海域文昌鱼酸、碱性磷酸酶的影响[J]. 水产科学, 2009, 28(9): 513-517.Bai Xiujuan, Lu Huosheng, Tang Fenghua. Effects of Cu2+, Zn2+and Cd2+on Ampicillin and Alkaline Phosphatase in Maoming Sea Area[J]. Journal of Fisheries Science, 2009, 28(9): 513-517.
[20] Kaplan M M. Alkaline phosphatase[J]. Nihon Rinsho Japanese Journal of Clinical Medicine, 1972, 286(4): 200-205.
[21] 常杰, 牛化欣, 张文兵. 刺参免疫系统及其免疫增强剂评价指标的研究进展[J]. 中国饲料, 2011, 6: 8-12. Chang Jie, Niu Huaxin, Zhang Wenbing. Research progress on evaluation index of immune system and immune enhancer of sea cucumber[J]. China Feed, 2011, 6: 8-12.
[22] 赖德荣, 金秀美, 林岳夫, 等. 镉污染对翡翠贻贝碱性磷酸酶的影响[J]. 海洋学报(中文版), 1983, 5(2): 230-235.Lai Derong, Jin Xiumei, Lin Yuefu, et al. Effects of cadmium pollution on alkaline phosphatase of jade mussels[J]. Acta Oceanologica Sinica, 1983, 5(2): 230- 235.
[23] 陈艳, 江明锋, 叶煜辉, 等. 溶菌酶的研究进展[J]. 生物学杂志, 2009, 26(2): 64-66.Chen Yan, Jiang Mingfeng, Ye Yihui, et al. Research progress of lysozyme[J]. Journal of Biology, 2009, 26(2): 64-66.
[24] Mcdade JE, Tripp MR. Lysozyme in oyster mantle mucus[J]. Journal of Invertebrate Pathology, 1967, 9(4): 581-582.
[25] 丁鉴锋, 闫喜武, 赵力强, 等. 海洋污染物对菲律宾蛤仔的免疫毒性[J]. 生态学报, 2013, 33(17): 5419- 5425.Ding Jianfeng, Yan Xiwu, Zhao Liqiang, et al. Immunotoxicity of marine pollutants to C. philippinarum[J]. Chinese Journal of Ecology, 2013, 33(17): 5419-5425.
[26] 李晓梅, 郭体环, 张来军, 等. 海洋酸化背景下铅胁迫对近江牡蛎溶菌酶活性的影响[J]. 江苏农业科学, 2016, 44(12): 297-299. Li Xiaomei, Guo Tihuan, Zhang Laijun, et al. Effects of lead stress on lysozyme activity of Oyster oyster under marine acidification background[J]. Jiangsu Agricultural Sciences, 2016, 44(12): 297-299.
[27] Stebbing ARD. Hormesis-The stimulation of growth by low level of inhibitors[J]. Science of the Total Environment, 1982, 22(3): 213-234.
Acute Pb2+toxicity inand its effect on immune-related enzyme activity in hemolymph
WANG Rui1, HUANG Yu-chen1, XIONG De-dong1, HUANG Ya1, TIAN Tian1, MENG Bin1, LIANG Jian1, 2
(1. Tianjin Key Laboratory of Aqua-ecology and Aquaculture, Department of Fishery Sciences, Tianjin Agricultural College, Tianjin 300384, China; 2. Tianjin Marine Ranching Technical Engineering Center, Tianjin 300457, China)
Acute lead toxicity has emerged as a serious environmental and health concern in China. The present study aimed to evaluate the effects of acute Pb2+toxicity onusing static acute toxicity test. Effects of Pb2+on the activity of three immune-related enzymes—acid phosphatase (ACP), alkaline phosphatase (AKP), and lysozyme (LSZ)—present in hemolymph were studied under stress concentration of 1/10 (TC group) and 1/100 (SC group) of LC50at 96 h. The results of the study indicated that LC50of Pb2+was 7.938 mg/L at 96 h post exposure. The activity of ACP in the SC group showed an induction–inhibition trend that was significantly different from the control group, except for 4 days (<0.05).The inhibition trend for ACP in the TC group was significantly different from the control group and was the lowest among the three groups (<0.05). For both the SC and TC groups, the activities of AKP and LSZ were significantly induced in early stage, followed by inhibition in middle and late stages of lead exposure. This trend was significantly different from that of the control group (<0.05), and the activity reported in the TC group was lower than that in the SC group at all stages. The results of this study indicated that high Pb2+toxicity inwas accompanied by the inhibition of immune-related enzymes, thereby affecting the immunity in barley. Therefore, the inhibition of enzyme activity inincreased with the increase in the stress concentration of Pb2+.
; Pb2+; acute toxicity; immune-related enzyme
Jul. 14, 2019
S917.4
A
1000-3096(2020)03-0059-07
10.11759/hykx20190714002
2019-07-14;
2019-11-20
天津市大学生创新创业训练计划项目(201810061254); 天津市农业科技成果转化与推广项目(201903010); 国家贝类产业技术体系项目(CARS-49); 国家重点研发计划“蓝色粮仓科技创新”项目(2018YFD0901404); 天津市种业科技重大专项(17ZXZYNC00020); 天津市水产产业技术体系创新团队(ITTFRS2017013)
[Tianjin University Students Innovation and Entrepreneurship Training Program, No. 201810061254; Tianjin Agricultural Science and Technology Achievements Transformation and Promotion Project, No. 201903010; National Shellfish Industry Technology System Project, No. CARS-49; National Key R&D Program “Blue Granary Technology Innovation” Project, No. 2018YFD0901404; Tianjin Seed Industry Science and Technology Major Project, No. 17ZXZYNC00020; Tianjin Aquatic Industry Technology System Innovation Team, No. ITTFRS2017013]
王瑞(1997-), 女, 吉林永吉人, 本科生, 主要从事贝类遗传育种研究, 电话: 15900256672, E-mail: 1227435023@qq.com; 梁健,通信作者, 实验师, E-mail: liangjian@tjau.edu.cn
(本文编辑: 康亦兼)

