肠癌患者肠道菌群分析及携带β-葡萄糖醛酸酶基因特征
严斌斌,戴桂花,王 彬,马琳琳,包学英,李明成
(1.北华大学医学技术学院,吉林 吉林 132013;2.北华大学附属医院,吉林 吉林 132011)
肠癌是发生于结肠和直肠的恶性肿瘤[1],肠癌的发生与遗传因素、社会环境、饮食习惯及结构等密切相关,高龄、体型肥胖、抗菌药物滥用等均是肠癌的高危因素[2].癌前病变有一定的可能和概率转变为癌症.腺瘤(包括锯齿状腺瘤等)及腺瘤病(包括家族性、非家族性腺瘤性息肉病)、炎症性肠病(包括克罗恩病、溃疡性结肠炎等)均可视为肠癌的癌前病变.随着中国居民的生活节奏加快及高脂饮食等习惯[3],肠癌患者数量显著上升,早期筛查具有现实价值.由于肠道微生物在营养代谢及免疫调节上具有举足轻重的作用,因此,被认为与大肠癌的发生有直接的关联[4].近来越来越多的证据[5]表明:肠道菌群结构的紊乱与肠癌的发展及预后有密不可分的相关性.β-葡萄糖醛酸酶(β-Glucuronidase,GUS)可分解、游离和活化肠道内无毒物质,导致致癌物在肠道内蓄积增多,提高了罹患肠癌的风险.
采集肠癌前病变、肠癌患者及健康人粪便样品,选取大肠埃希菌、肠球菌、金黄色葡萄球菌、酵母菌为代表的需氧菌和乳酸杆菌、消化球菌、双歧杆菌为代表的厌氧菌对肠道菌群和β-葡萄糖醛酸酶基因特征进行分析,探讨肠癌前病变及肠癌早期肠道菌群变化和早期诊断的生物学指标[6].
1 材料与方法
1.1 标本来源
收集2017年9月—2017年12月北华大学附属医院肠癌患者3例,其中,男2例(直肠癌,51岁;结肠癌,47岁),女1例(直肠癌,63岁),平均年龄(53.6±8.3)岁,中位年龄51岁;肠癌前病变患者2例,其中,男1例(家族性腺瘤息肉病,46岁),女1例(管状腺瘤,52岁),平均年龄(49.0±4.2)岁,中位年龄49岁.以上患者均经肠镜及病理检查明确诊断,且于采集样品前2周未使用抗菌药物、微生物活菌制剂及聚乙二醇等泻剂[7].同期收集4例北华大学医学技术学院健康师生作为对照组,其中,男2例(49岁、26岁),女2例(53岁、46岁),平均年龄(43.5±12.0)岁,中位年龄47.5岁.健康对照组排除慢性消化道病史,并未使用上述药物.本研究均得到研究对象同意并签署知情同意书.
1.2 试 剂
2×Taq PCR Master Mix(批号:N20630)、D2000 DNA Marker(批号:MD114)、pGM-T cloning Kit(批号:03707)、普通琼脂糖凝胶DNA回收试剂盒(批号:04211)、质粒小提试剂盒(批号:03914)(北京天根生化科技有限公司);琼脂糖(批号:89310510)、细菌培养基(批号:20151221)(青岛高科园海博生物技术有限公司).
1.3 仪 器
BP110S型电子分析天平(上海精科仪器厂);Bugbox-SM型厌氧工作站(北京隆福佳生物科技有限公司);ECT811型PCR扩增仪(广州东胜生物科技有限公司);JY-SPC型电泳槽、DYY-6C型电泳仪(北京市六一仪器厂);BSC-1600ⅡB2型生物安全柜(浙江苏净净化设备有限公司);GHP-9050型隔水式恒温培养箱(上海联科仪器设备有限公司);ZF-90型暗箱式紫外投射仪(上海顾村电光仪器厂).
1.4 肠道细菌的分离培养及计数
将0.1 g准确称量的新鲜粪便放入1.5 mL的灭菌EP管内,加入0.9 mL的灭菌生理盐水后充分震荡混匀,然后进行浓度梯度倍比稀释.取相应浓度梯度样品10 μL,在生物安全柜内滴加到相应的培养基内,用L棒均匀涂布整个平板后,按照参考文献[5]方法进行细菌培养并计数(见表1).

表1 肠道菌群培养条件Tab.1 Culture conditions of intestinal flora

1.5 提取肠癌前病变患者大肠埃希菌DNA
参照文献[8],应用水煮法提取DNA,于150 μL灭菌双蒸水中挑入单个菌落充分混匀,置于100 ℃水中煮沸10 min,并迅速将其转至-20 ℃冷却,然后12 000 r/min离心10 min,取上清于-20 ℃保存.
1.6 目的基因片段PCR扩增
从GeneBank数据库下载β-葡萄糖醛酸酶基因uidA(Acession No.S69414.1)的全部序列,利用软件Primer 5.0设计特异性引物.上游引物:5′G GGCAA CAA GCC GAA AGA 3′;下游引物:5′CC ATACCTGTTCACCGACGA3′(由上海生工生物工程股份有限公司合成),目的基因片段为309 bp.
PCR反应体系:2×Taq PCR Master Mix 12.0 μL,上、下游引物及DNA模板各1.0 μL,补足灭菌ddH2O至25 μL,阴性对照为灭菌ddH2O.PCR循环参数:94 ℃预变性5 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,循环30次,72 ℃延伸5 min.取6 μL PCR产物与1 μL 6×loading Buffer充分混匀后,1%琼脂糖凝胶电泳,在紫外光线投射仪下观察并拍照.
1.7 重组质粒构建
肠癌前病变患者大肠埃希菌PCR产物经普通琼脂糖凝胶DNA回收试剂盒回收,提纯后使用pGM-T cloning Kit进行转化及蓝白斑筛选,挑取阳性菌落过夜,培养后用质粒小提试剂盒提取重组质粒.
1.8 重组质粒测序及比对
提取肠癌前病变患者大肠埃希菌重组质粒,与GenBank中登录号为S69414.1的uidA基因序列进行比对.
1.9 统计学分析
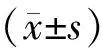
2 结 果
2.1 肠道菌群构成
对肠癌前病变、肠癌患者及健康人的肠道菌群进行培养及计数,肠癌前病变、肠癌患者大肠埃希菌、肠球菌及酵母菌显著增加,乳酸杆菌和双歧杆菌明显减低,需氧和厌氧菌比例与数量呈颠倒状态.对3组实验结果进行方差分析,大肠埃希菌、酵母菌、肠球菌以及厌氧菌的双歧杆菌、乳酸杆菌在3组间的差异具有统计学意义(P<0.05).各组两两比较,肠癌前病变患者与健康人比较差异具有统计学意义(P<0.05),而肠癌前病变与肠癌患者比较差异无统计学意义(P>0.05).见表2.
2.2 目的基因片段PCR扩增结果
将2例肠癌前病变患者大肠埃希菌水煮DNA进行PCR扩增,经1%琼脂糖凝胶电泳检测,在309 bp处均出现清晰单一的目的基因片段条带.见图1.


肠道菌群肠癌组(n=3)肠癌前病变组(n=2)健康对照组(n=4)P大肠埃希菌11.89±0.4811.37±0.339.01±1.550.033酵母菌11.10±1.538.95±3.175.43±1.690.024金黄色葡萄球菌3.12±0.914.23±0.532.88±1.190.361肠球菌10.21±1.099.69±0.936.78±1.710.039双歧杆菌8.40±0.477.90±0.6210.70±0.450.010乳酸杆菌7.78±0.239.00±1.0410.36±1.220.036消化球菌10.62±0.6510.14±1.3310.75±1.230.815
2.3 质粒测序及分析比对结果
经深圳华大基因科技有限公司所得测序结果经GenBank中BLAST分析见图2.肠癌前病变患者大肠埃希菌重组质粒目的基因片段与登记号S69414.1中β-葡萄糖醛酸酶序列比对:Score=566 bits(306),Expect=2×10-165,Identities=308/309(同源性为99%),Gaps=0/309(0%),第1497位置G突变成A.
3 讨 论
人体肠道中的细菌种类多样,存在结肠内的细菌超过400种.肠道微生物与人体在正常状态下经过物质代谢与能量交换等方式进行精密的代谢合作[9].当肠道内环境发生改变,微生态系统失衡,通常具有致病作用[10].细菌培养结果显示:肠癌、肠癌前病变患者大肠埃希菌、肠球菌及酵母菌增多,乳酸杆菌和双歧杆菌减低,肠道菌群结构改变表现为有益菌的减少和有害菌的增加,机会致病菌与益生菌比例反转.肠癌由非典型增生性腺瘤恶性转化往往需要10 a以上[11],同时有证据[12]表明:其肠道内pH及短链脂肪酸随时间延长分别增高和减少,因此,肠道菌群改变是癌变的始发因素而非继发改变,肠道菌群变化作为微生态指标可用于预估患者肠道生态系统状态以及发生肠癌的可能性.肠道环境中需氧菌显著增多可导致硫化氢、次级胆汁酸、乙醛、偶氮氧化甲烷(AOM)、烷基化合物在内的化学致癌剂、诱变剂和胞外过氧化物、氧自由基等负性代谢在肠道大量积累,从而损伤肠道细胞基因及染色体稳定,导致异型性增生的肠道细胞增多,加快了肠癌前病变向恶性肿瘤的转化.而益生菌如乳酸杆菌及其代谢产物等可以诱导产生包括IL-12、TNF-α等多种细胞因子阻止病原体入侵肠道,减少慢性炎症对肠道细胞的长期不良刺激.双歧杆菌可通过减少bcl-2的表达而增加bax基因的表达,诱导癌细胞凋亡[12],从而预防和抑制肿瘤的发生.
在细胞发生癌变时β-葡萄糖醛酸酶的活性明显增高,并在癌周结缔组织水解蛋白多糖及糖蛋白,监测其活性变化能够辅助诊断消化系统肿瘤[13].β-葡萄糖醛酸酶对大肠埃希菌具有一定的特异性,在细菌增殖过程中可引起GUS在肠道环境内积聚.戴起宝等[14]通过测定肠癌组癌灶黏膜细菌β-葡萄糖醛酸酶活性,发现其活性显著高于对照组;KIM等[15]研究表明:结肠癌患者粪便中β-葡萄糖醛酸酶活性比正常对照组高1.7倍.测序结果显示:肠癌前病变患者大肠埃希菌重组质粒基因序列与GenBank(Acession No.S69414.1)uidA基因序列比较同源性为99%,第1497位置G突变成A.同时本课题组前期工作表明:肠癌患者大肠埃希菌GUS基因第1141和1148位A缺失,第1149位和第1158位的A分别突变为T和G[16],这可能导致GUS活性改变并产生更多致癌物质.因此,大肠埃希菌uidA基因突变会增加癌前病变患者的癌变风险,可通过检测uidA基因mRNA转录及酶的蛋白表达来进一步验证.
本实验主要研究癌前病变、肠癌患者和健康人的肠道菌群改变情况,从而进一步明确了肠癌前病变患者肠道菌群的早期变化及uidA基因突变,为预测肠癌前病变患者癌变发生概率,寻找肠癌的早期筛查和确诊指标提供了新的思路及理论依据.

