Ⅱ~Ⅲ期食管癌根治性切除术后患者预后的影响因素分析
宋春洋,祝淑钗△,沈文斌,高丝娜,苏景伟,李娟,赵彦,许金蕊,李曙光,刘志坤
食管癌是我国常见的消化系统恶性肿瘤之一,手术切除目前仍是其主要的治疗手段。对于早期食管癌患者,单纯根治性切除术即可取得较好疗效,但对Ⅱ~Ⅲ期食管癌患者疗效欠佳,术后治疗失败的主要模式为区域性复发和(或)远处转移,其中以区域性复发最为常见。因此对于此类食管癌群体,术后辅助治疗具有重要价值。本研究回顾性分析了单中心716 例Ⅱ~Ⅲ期食管癌根治性切除术后患者的临床资料,探讨患者预后的影响因素及术后辅助治疗的价值,为临床治疗方案的选择提供依据。
1 资料与方法
1.1 一般资料 收集我院2007年1月—2010年12月食管癌患者病历资料,纳入标准:(1)术前未进行新辅助治疗,KPS评分>70分。(2)根治性手术切除(R0切除)。(3)病理明确为食管鳞癌。(4)术后病理资料完整,分期为Ⅱ或Ⅲ期[2002 国际抗癌联盟(UICC)第六版分期]。最终共716例患者符合入组标准,其中男511 例,女205 例,年龄37~78 岁,中位年龄60岁,见表1。
1.2 治疗依据 患者的术后病理、身体状况及个人意愿决定是否行术后辅助治疗,具体治疗情况见表1。342例Ⅱa期患者中,单纯手术组165 例,术后放疗组22 例,术后化疗组133例,术后放化疗组22 例;75 例Ⅱb 期患者中,单纯手术组23例,术后放疗组11例,术后化疗组32例,术后放化疗组9例;299 例Ⅲ期患者中,单纯手术组105 例,术后放疗组61 例,术后化疗组98例,术后放化疗组35例。
1.2.1 手术治疗 胸中下段食管癌绝大多数采用左胸入路经典的胸腹两野淋巴结清扫及食管癌切除、主动脉弓上或弓下吻合术;胸上段及少数胸中段食管癌采用右胸入路两野或三野淋巴结清扫及食管癌切除、主动脉弓上或颈部吻合术。手术行左开胸660 例,右开胸14 例,颈+腹正中13 例,颈+右胸+腹正中29例;行颈部吻合74例,弓上吻合556例,弓下吻合86例。其中41例胸上段癌患者中,接受左开胸16例,颈+腹正中11例,颈+右胸+腹正中14例;440例胸中段癌患者中,接受左开胸409 例,右开胸14 例,颈+腹正中2 例,颈+右胸+腹正中15例;235例胸下段癌患者均接受左开胸。术中清扫淋巴结数为0~31枚,中位数为9枚;共摘除淋巴结7 041枚,其中阳性790 枚,转移度为11.22%,平均摘除淋巴结(9.83±5.07)枚;有淋巴结转移者344例,转移率为48.04%。
1.2.2 术后放疗 术后辅助性放疗于术后4周后开始实行,患者经热塑体膜固定体位,于CT模拟机下扫描定位,所得图像传输进入治疗计划系统(ADAC Pinnacle38.0m, Philips Medical Systems,USA)。临床靶区(CTV)包括原瘤床区及相应淋巴引流区(依据美国胸科协会对胸部淋巴结的分组进行淋巴结引流区的勾画),其中胸上段淋巴结引流区包括双侧锁上、2区、食管旁、4区、5区、7区及8区,下界为气管隆突下2~3 cm;胸中段淋巴结引流区包括2区、食管旁、4区、5区、7区、8 区及9 区,下界为贲门旁淋巴结区;胸下段引流区包括食管旁、4区、5区、7区、8区、9区、贲门旁、胃左及腹腔干淋巴结区。勾画靶区定义为CTV,在CTV基础上前后左右方向各外放0.3~0.5 cm,上下方向各外放0.5~1.0 cm 为计划靶区(PTV),要求95%PTV接受剂量为50~60 Gy,1.8~2.0 Gy/次,5 次/周。双肺 V5≤55%、V20≤30%、V30≤20%,脊髓最大剂量(Dmax)<45 Gy,心脏平均剂量(Dmean)<30 Gy、V30<40%、V40<30%,胸腔胃V40<35%。本研究接受术后放疗者共160例,其中使用三维适形放疗技术(3DCRT)的137例,调强放疗技术(IMRT)的23例。(Vx表示接受x Gy剂量照射的体积占所在器官总体积的百分比。)
1.2.3 术后化疗 术后中位化疗疗程4 个周期(1~8 个周期)。术后化疗于术后4 周进行,化疗方案:LFP 方案(d1~5:亚叶酸钙200 mg/次+替加氟1.0 g/次+顺铂20 mg/次),TP 方案(紫杉醇135 mg/m2d1+顺铂75 mg/m2d1)。
1.2.4 术后放化疗 术后放化疗均采用序贯放化疗,即术后先行放疗,放疗结束后再进行化疗。化疗方案同上述术后化疗方案。
1.3 随访 患者术后或者末次辅助治疗后,每3个月复查胸腹部CT和食管造影,2年后改为每6个月复查1次;复发的诊断主要来源于胸腹CT,其次是食管造影、头颅MRI、全身骨扫描等检查。随访期内出现局部复发和(或)远处转移,定义为病情进展。随访以电话随访及门诊复查为主。本组病例共失访16例,失访率为2.23%。
1.4 统计学方法 运用统计软件SPSS 13.0 进行统计分析。Kaplan-Meier 法对生存时间行单因素分析,采用Log-rankχ2检验,选择Pairwise over strata 方法进行组间生存时间比较;多因素生存分析采用Cox回归模型:将单因素分析差异有统计学意义的变量作为自变量纳入回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 生存情况 全组716 例患者,截止随访日期2016 年 1 月:死亡 370 例,失访 16 例。死亡患者中:死于远处转移者141 例,死于局部复发者154 例,复发同时远处转移者44例,死于食管癌以外疾病者25例,死因不明者6例。全组患者的生存情况,见表2。
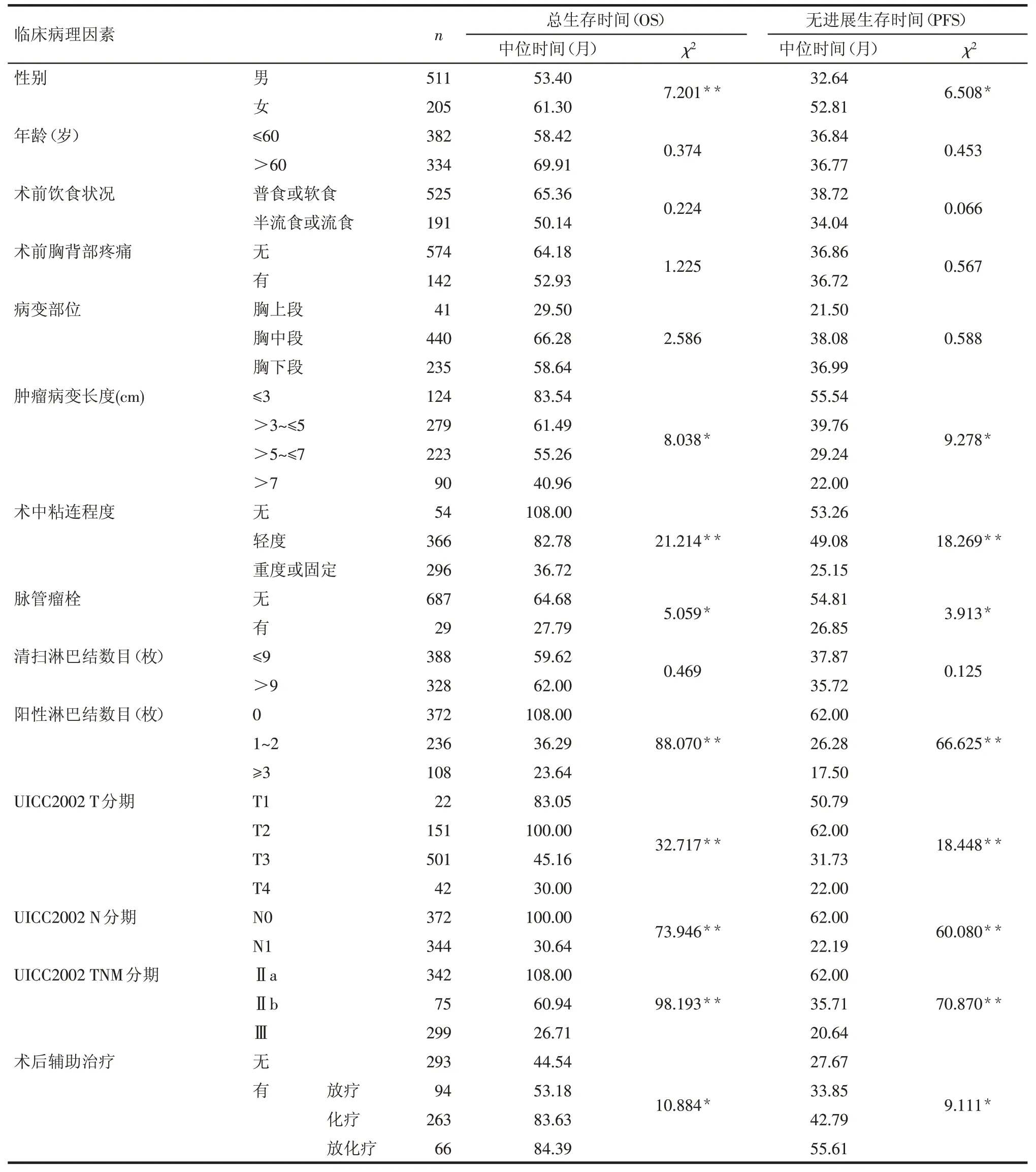
Tab.1 Clinicopathological characteristics and univariate analysis of patients with esophageal carcinoma表1 患者临床病理资料及单因素预后分析
2.2 总生存时间(OS)的影响因素分析 单因素预后分析显示:性别、肿瘤病变长度、术中粘连程度、脉管瘤栓、阳性淋巴结数目、T 分期、N 分期、TNM 分期、术后辅助治疗与患者OS有关(均P<0.05),见表1。以OS为因变量(0=生存,1=死亡),以单因素分析有统计学意义的临床病理因素性别(男=1,女=2)、肿瘤病变长度(≤3 cm=1,>3~≤5 cm=2,>5~≤7 cm=3,>7 cm=4)、术中粘连程度(无=0,轻度=1,重度或固定=2)、脉管瘤栓(无=0,有=1)、阳性淋巴结数目(0 枚=0,1~2 枚=1,≥3 枚=2)、T 分期(T1=1,T2=2,T3=3,T4=4)、N 分期(N0=0,N1=1)、TNM 分期(Ⅱa期=1,Ⅱb 期=2,Ⅲ期=3)、术后辅助治疗(无=0,有=1)为自变量,将各因素(其中自变量以哑变量方式)纳入Cox 风险比例模型,结果显示:男性、术中粘连程度严重、阳性淋巴结数目多、T 分期晚、未接受术后辅助治疗均为影响患者OS 的独立危险因素(均P<0.05),见表3。
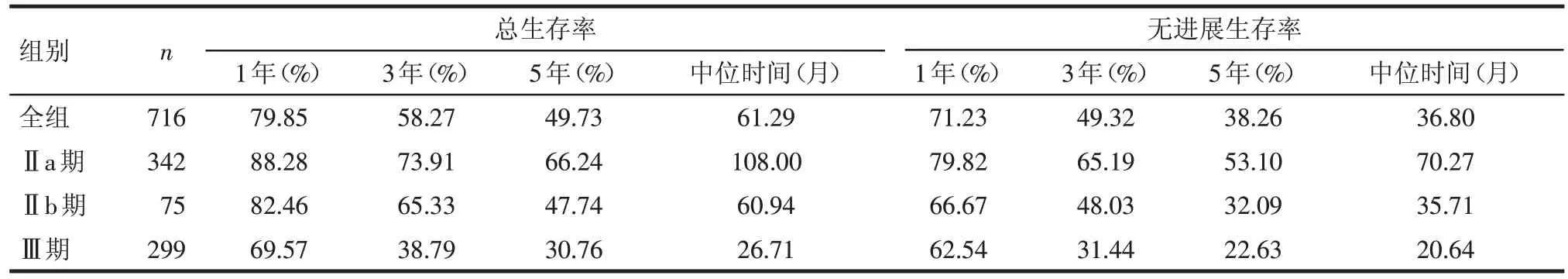
Tab.2 The survival distribution of 716 esophageal carcinoma patients treated with radical esophagectomy表2 716例食管癌术后患者的生存状况
分层分析显示术后辅助治疗方式均显著影响Ⅱa、Ⅱb、Ⅲ期患者OS(χ2分别为10.191、7.847、13.044,P<0.05 或P<0.01)。组间两两比较:Ⅱa 期患者中术后化疗组OS优于单纯手术组和术后放疗组(χ2分别为9.301、4.422,P<0.05 或P<0.01),余各组两两比较差异无统计学意义,见图1A;Ⅱb期患者中术后放化疗组、术后放疗组OS 优于单纯手术组(χ2分别为3.926、4.605,P<0.05),余各组两两比较差异无统计学意义,见图2A;Ⅲ期患者中术后放化疗组、术后放疗组OS 优于单纯手术组(χ2分别为8.504、7.435,P<0.01),余各组两两比较差异无统计学意义,见图3A。
2.3 无进展生存时间(PFS)的影响因素分析 单因素预后分析显示:性别、肿瘤病变长度、术中粘连程度、脉管瘤栓、阳性淋巴结数目、T分期、N分期、TNM分期、术后辅助治疗与患者的PFS 有关(均P<0.05),见表1。以PFS 为因变量(0=无进展,1=进展),以单因素分析有统计学意义的临床病理因素为自变量(赋值方法同2.2),将各因素(其中自变量以哑变量方式)纳入Cox 风险比例模型,结果显示:男性、术中粘连程度严重、TNM分期晚、未接受术后辅助治疗均为影响患者PFS 的独立危险因素(均P<0.05),见表4。
分层分析显示术后辅助治疗明显影响Ⅱa、Ⅱb、Ⅲ期患者的PFS(χ2分别为8.466、8.432、7.966,P<0.05)。组间两两比较:Ⅱa期患者中术后化疗组PFS优于单纯手术组(χ2=7.481,P<0.01),余各组两两比较差异无统计学意义,见图1B;Ⅱb期患者中术后放化疗组PFS优于单纯手术组(χ2=6.684,P<0.05),余各组两两比较差异无统计学意义,见图2B;Ⅲ期患者中术后放化疗组PFS 优于单纯手术组(χ2=5.741,P<0.05),余各组两两比较差异无统计学意义,见图3B。
3 讨论
食管癌的治疗方法目前仍以根治性切除术为主。近年来随着手术方式的改进和先进技术的应用,食管癌的手术适应证范围在不断扩大,并且术后选择性应用了放疗、化疗、放化疗等综合治疗方法,生存和局控均有所改善。刘晓等[1]对581 例Ⅱ期食管癌术后患者进行生存统计分析,其中Ⅱa期患者5年生存率为62.6%,Ⅱb期患者5年生存率为55.2%。另有相关文献报道食管癌根治术后Ⅱb、Ⅲ期患者的5年生存率分别为36.3%、27.6%,中位生存时间分别为 38.7 个月与 25.3 个月[2]。本研究中,Ⅱa、Ⅱb、Ⅲ期患者5 年生存率分别为66.24%、47.74%、30.76%。因此,Ⅱ~Ⅲ期食管癌术后的总体疗效欠佳,评价影响该类患者人群预后的高危因素,对其治疗方案的选择及评估预后具有重要意义。
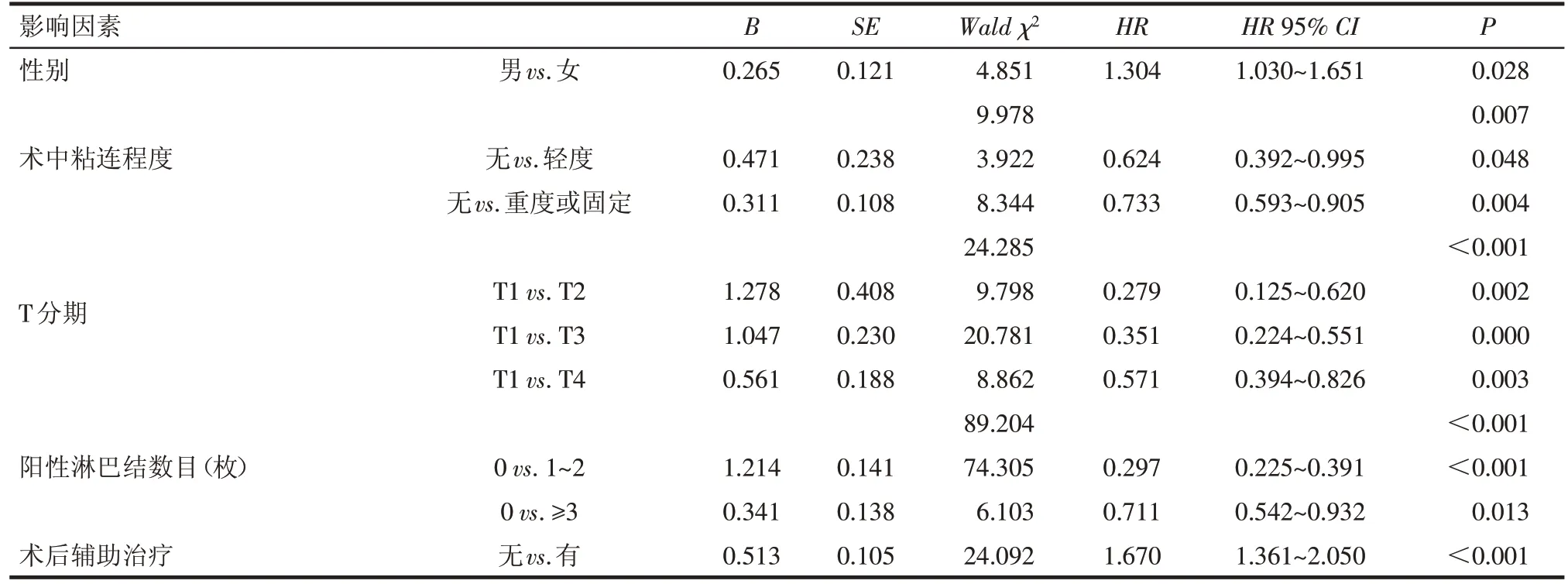
Tab.3 Multivariate analysis of OS for stageⅡ-Ⅲesophageal carcinoma patients after radical surgery表3 影响Ⅱ~Ⅲ期食管癌患者术后OS的COX多因素分析
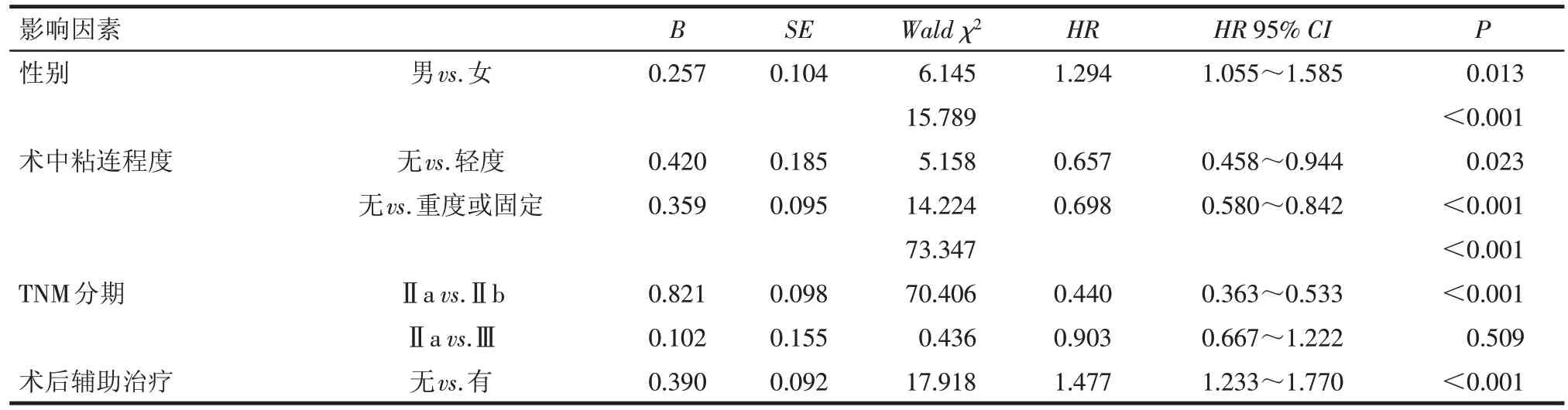
Tab.4 Multivariate analysis of PFS for stageⅡ-Ⅲ esophageal carcinoma patients after radical surgery表4 影响Ⅱ~Ⅲ期食管癌患者术后PFS的Cox多因素分析
影响食管癌根治术后患者的预后因素包括患者的临床特征、手术方式及病理分期等。本研究结果显示食管病变长度与预后明显相关,肿瘤长度越短,患者总生存及无进展生存预后均越好。与本课题组前期报道结果相似,其认为食管病变长度与淋巴结转移呈正相关,进而影响患者的预后[3]。食管肿瘤病变和周围组织的粘连程度与患者预后的相关性结论不一。杨琼等[4]对504 例术后病理分期为Ⅲ期的食管癌患者进行预后分析发现食管病变与周围组织粘连程度并非其预后影响因素(P=0.106)。本研究得到不同的结果,肿瘤病变与周围组织粘连程度越重,患者的总生存及无进展生存预后越差,且术中粘连程度为患者预后的独立影响因素。笔者认为食管肿瘤病变与周围组织的粘连程度反映了肿瘤病变的外侵程度,可直接影响手术中肿瘤病变是否可彻底切除,进而影响食管癌患者的预后。一旦肿瘤细胞侵犯脉管系统,出现脉管瘤栓,食管癌患者的预后往往很差。本研究结果显示,有、无脉管瘤栓患者的总生存中位时间分别为27.79 个月和64.68 个月,无进展生存中位时间分别为26.85 个月和54.81 个月,统计分析2 组患者间差异均有统计学意义,与既往文献报道结果相符[5]。
既往研究表明术后病理阳性淋巴结数目越多,食管癌患者的预后越差[6-7]。目前最新的食管癌TNM分期中N分期也是按照阳性淋巴结数目进行划分的。在本研究中按照术后病理阳性淋巴结数目将患者分为 0 枚、1~2 枚,≥3 枚3 组,3 组患者的总生存及无进展生存差异均有统计学意义,Cox 多因素分析显示术后阳性淋巴结数目为患者总生存时间的独立预后因素。食管癌术后病理T 分期、N 分期及TNM 分期为影响患者预后的重要因素,分期越早,预后越好,反之则预后越差[8]。本研究结果与其相似,单因素预后分析显示术后病理T分期、N分期及TNM 分期均为影响患者总生存时间及无进展生存时间的显著因素,Cox多因素分析显示术后T分期和TNM 分期分别为总生存时间和无进展生存时间的独立影响预后因素。目前临床上也把术后TNM 分期作为判断预后的重要指标。由于分期越晚,患者预后越差,因此术后的辅助治疗显得尤为重要。
目前,食管癌根治术后辅助治疗的作用仍存在争议[9-10],主要集中在食管癌术后是否行化疗、放疗或放化疗及获益人群的选择等方面。Zhang 等[11]报道食管癌术后病理为Ⅲ期或者淋巴结阳性患者接受术后辅助放疗较单纯手术者可明显降低局部复发率并使患者生存获益。齐战等[12]通过分析329例食管鳞癌根治术后患者发现接受术后辅助化疗可明显改善T3期、N2期及Ⅲb期患者的生存预后。本研究结果显示食管癌根治术后接受辅助治疗可显著改善患者的总生存及无进展生存预后,且为独立影响因素。分层分析显示,Ⅱa期患者根治术后接受辅助化疗可获得良好预后,根治术后接受辅助放疗或放化疗可改善Ⅱb 期、Ⅲ期患者的生存预后。笔者认为食管癌根治术后辅助化疗可以消灭患者体内仍残留的由休眠期进入增殖期的肿瘤细胞,而术后辅助放疗可以消灭原瘤床及其周围的亚临床病灶,进而使患者生存获益。从本研究中可见,对于Ⅱa、Ⅱb、Ⅲ期患者根治术后采取不同的辅助治疗方式可得到不同的预后疗效。
总之,影响Ⅱ~Ⅲ期食管癌根治术后患者预后的因素有很多,其中根治术后的辅助治疗十分重要。对Ⅱa期患者可仅行术后化疗即可获得良好疗效,而Ⅱb~Ⅲ期患者根治术后接受辅助放疗或放化疗可获得更优预后。因本研究为回顾性研究,还需要前瞻性研究证实。

