吸入氢气对脓毒症小鼠海马组织DNA甲基化的影响
于明懂,李佩,于泳浩,卢悦淳,陈会敏,王新,谢克亮
脓毒症可以造成严重的中枢神经系统并发症,引起严重的认知功能障碍,即脓毒症相关性脑病(sepsis-associated encephalopathy,SAE)。对脓毒症相关性脑病的机制研究和治疗措施是医学领域的重点。既往研究表明吸入氢气可以明显减轻脓毒症时脑功能损伤,改善认知功能,其机制与抑制氧化应激和炎症反应有关[1]。DNA甲基化是一种重要的表观遗传学修饰,在脑组织发生氧化应激和炎症反应时,DNA 甲基化水平也发生改变,引起严重的认知功能障碍[2-4]。改变中枢神经系统的DNA 甲基化状态,可抑制脑组织的氧化应激和炎症反应,改善认知功能[5-6]。因此,推测通过调控DNA 甲基化状态来抑制氧化应激和炎症反应是氢气治疗脓毒症相关性脑病的机制之一。本研究拟探讨吸入氢气时脓毒症小鼠海马组织的DNA甲基化状态发生的变化,为氢气治疗脓毒症相关性脑病研究提供新的参考。
1 材料与方法
1.1 实验动物及分组 健康雄性C57BL/6 小鼠54 只,6~8周龄,体质量20~25 g,均由中国军事医学科学院实验动物中心提供,饲养于自然昼夜交替的通风环境,自由饮水、饮食。采用随机数字表法分为3 组(均n=18):假手术组(Sham组)、脓毒症组(Sepsis组)和氢气治疗组(Sepsis+H2组)。
1.2 主要试剂与仪器 通用型柱式基因组提取试剂盒(北京康为世纪);全基因组甲基化定量检测试剂盒(Epigentek 公司,美国);Trizol试剂(Molecular Research 公司,美国);cDNA逆转录试剂盒(Thermo 公司,美国);SYBR Green Master Mix试剂盒(Thermo公司,美国);兔源DNMT1、DNMT3a、DNMT3b和GAPDH 一抗均购自Abcam 公司(英国);辣根过氧化物酶(HRP)标记的二抗(Sigma公司,美国);GCH-500高纯氢气发生器(天津同普分析仪器科技有限公司);PG610氢气检测仪(河南英特电器设备公司);多功能酶标仪(PerkinElmer公司,美国);Piko Real96 实时荧光定量PCR 检测系统(Thermo 公司,美国)。
1.3 脓毒症模型的制备 采用盲肠结扎穿孔(CLP)法建立小鼠脓毒症模型[7],以2%水合氯醛15 mL/kg 腹腔注射麻醉,腹正中线切开,Sepsis组和Sepsis+H2组用手术缝线在回盲瓣下方盲肠近段1/4 处结扎盲肠,用20G 无菌针头将被结扎盲肠贯穿穿孔,挤出盲肠内容物约0.3 mL,将盲肠及其内容物还纳腹腔后缝合腹壁切口。Sham 组不进行盲肠结扎和穿孔,其余操作同上。
1.4 干预和治疗 参考文献[8]的方法,使用GCH-500高纯氢气发生器生成氢气,将各组小鼠于手术后1 h和6 h放入有进气口和出气口的密封树脂箱子内,采用PG610氢气检测仪监测箱内氢气浓度。Sepsis+H2组吸入用空气混合的2%氢气1 h,其他2 组小鼠只置于相同环境中,不吸入氢气。在手术结束时各组小鼠均于颈部皮下给予生理盐水5 mL/100 g进行液体治疗,腹腔注射头孢曲松30 mg/kg和克林霉素25 mg/kg,每6 h注射1次,共3 d[9]。于术后1、3、7 d通过颈椎脱臼的方法处死小鼠(每个时点6只),沿腹部正中切口,暴露心脏,在右心耳处用一钝头注射器针头送至主动脉根部,用预配制的4 ℃肝素化生理盐水进行灌洗,待右心耳处流出清亮液体,表明灌洗充分。迅速断头取脑,于冰上分离脑海马组织,放入液氮冷冻备用。
1.5 全基因组甲基化水平的检测 每组取6 只小鼠海马组织,使用通用型柱式基因组提取试剂盒提取海马组织的基因组总DNA,测定DNA浓度;按照全基因组甲基化定量检测试剂盒操作步骤,利用多功能酶标仪检测全基因组甲基化水平。
1.6 PCR 检测 采用实时定量-PCR(Real-time PCR)法检测脓毒症小鼠海马组织DNA 甲基化转移酶(DNMTs,包括DNMT1、DNMT3a 和DNMT3b)的mRNA 水平。每组分别取6只小鼠海马组织,采用Trizol 试剂提取各组织中RNA,测定RNA 浓度;按照cDNA 逆转录试剂盒说明书步骤将mRNA 逆转录合成cDNA;使用SYBR Green 法进行模板的实时定量PCR 检测,以3-磷酸甘油醛脱氢酶(GAPDH)为内参。实时定量PCR 采用的引物序列见表1。按照SYBR Green Master Mix试剂盒说明书进行操作,采用20 μL体系进行PCR扩增,反应条件:95 ℃预变性10 min;95 ℃变性10 s,61 ℃退火30 s,72 ℃延伸32 s,共40 个循环。用Piko Real 96 实时荧光定量PCR检测系统进行扩增并分析处理数据。采用2-ΔΔCT法计算目的基因相对表达量。

Tab.1 Primer sequence of Real-time-PCR表1 实时定量PCR 引物序列
1.7 Western blot 检测 DNMT1、DNMT3a 和 DNMT3b 蛋白表达水平 取海马组织,加入RIPA 裂解液和蛋白酶抑制剂,4 ℃下14 000×g离心10 min,收集上清液,BCA法测定蛋白质浓度。加入4×蛋白上样缓冲液,经凝胶电泳、转膜、5%脱脂奶粉室温封闭1 h后,用含吐温20的磷酸盐缓冲液(TBST)洗膜 3 次,加入 DNMT1(1∶1 000)、DNMT3a(1∶2 000)、DNMT3b(1∶3 000)和GAPDH(1∶10 000)一抗,4 ℃ 孵育过夜。TBST洗膜后加入HRP 标记的二抗(1∶5 000),室温孵育1 h,TBST洗膜3次,底物化学发光显影,使用Image J软件分析灰度值。以目的蛋白与内参GAPDH的灰度值比值作为表达量检测表达情况。
1.8 统计学方法 采用SPSS 22.0 软件进行分析,正态分布的计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠全基因组DNA 甲基化水平比较 与Sham组比较,Sepsis 组1、3和7 d时全基因组甲基化水平均明显降低(P<0.05),与 Sepsis 组比较,Sepsis+H2组1、3 和7 d 时全基因组甲基化水平均明显升高(P<0.05),见图1。
2.2 各 组 小 鼠 DNMT1、DNMT3a 和 DNMT3b 的mRNA 表达水平 建立模型后 1、3、7 d 时 DNMT1、DNMT3a 和 DNMT3b 的 mRNA 表达水平发生了明显的 改 变 。 与 Sham 组比较,Sepsis 组 1、3、7 d 时DNMT1 和 DNMT3a 的 mRNA 表达水平明显升高(P<0.05),DNMT3b 的 mRNA 表达水平明显降低(P<0.05);与Sepsis 组比较,Sepsis+H2组1、3、7 d 时DNMT1 和 DNMT3a 的 mRNA 表达水平明显降低(P<0.05),DNMT3b 的 mRNA 表达水平明显升高(P<0.05),见图2。
2.3 各组小鼠海马组织DNMT1、DNMT3a 和DNMT3b 蛋白表达 与对照组相比,脓毒症时小鼠海马组织在1、3、7 d时DNMT1和DNMT3a的表达水平均明显升高(P<0.05),DNMT3b 的表达水平明显降低(P<0.05);氢气治疗后,Sepsis+H2组小鼠海马组织在1、3、7 d时DNMT1和DNMT3a的表达水平比Sepsis 组降低(P<0.05),DNMT3b 的表达水平较Sepsis组升高(P<0.05),见图3、表2。
3 讨论
Tab.2 Comparison of the expression levels of DNMT1,DNMT3a and DNMT3b at different time points between three groups表2 各组小鼠海马组织DNMT1、DNMT3a和DNMT3b蛋白表达的比较 (n=6,)
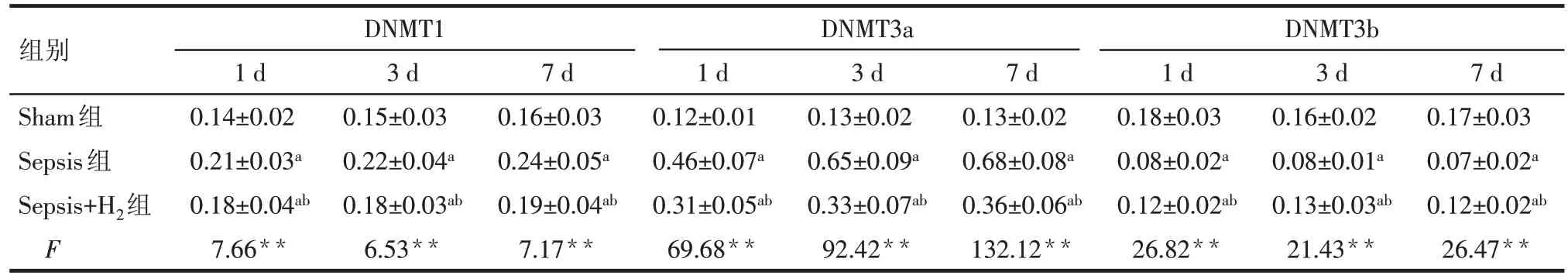
Tab.2 Comparison of the expression levels of DNMT1,DNMT3a and DNMT3b at different time points between three groups表2 各组小鼠海马组织DNMT1、DNMT3a和DNMT3b蛋白表达的比较 (n=6,)
**P<0.01;a与Sham组比较,b与Sepsis组比较,P<0.05
组别Sham组Sepsis组Sepsis+H2组F DNMT1DNMT3a DNMT3b 1 d 0.14±0.02 0.21±0.03a 0.18±0.04ab 7.66**3 d 0.15±0.03 0.22±0.04a 0.18±0.03ab 6.53**7 d 0.16±0.03 0.24±0.05a 0.19±0.04ab 7.17**1 d 0.12±0.01 0.46±0.07a 0.31±0.05ab 69.68**3 d 0.13±0.02 0.65±0.09a 0.33±0.07ab 92.42**7 d 0.13±0.02 0.68±0.08a 0.36±0.06ab 132.12**1 d 0.18±0.03 0.08±0.02a 0.12±0.02ab 26.82**3 d 0.16±0.02 0.08±0.01a 0.13±0.03ab 21.43**7 d 0.17±0.03 0.07±0.02a 0.12±0.02ab 26.47**
脓毒症是急危重症患者死亡的重要原因,SAE是脓毒症患者的常见并发症,能够明显提高患者病死率[10],并可造成严重的急性和远期认知功能障碍,严重影响患者治愈后的生活质量[11-12],SAE 的发病机制尚不十分明确,可能与氧化应激、炎症反应、线粒体和血管功能障碍、神经传递障碍和细胞凋亡等有关[13-14]。氢气是一种还原剂,具有抑制炎症反应、抗氧化应激、抗凋亡和促进能量代谢等作用[15],无论是吸入氢气还是口服或注射富氢水对缺血/再灌注损伤、创伤、脓毒症、糖尿病、神经系统退行性病变等多种不同动物模型均有保护作用[16-17]。笔者前期动物实验表明给脓毒症小鼠吸入2%氢气可明显增加Morris 水迷宫实验中小鼠在目标象限时间的百分比和穿过站台的次数,改善脓毒症小鼠的认知功能障碍,对SAE起到治疗作用,其机制与氢气可以减少脑海马组织中肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和高迁移率族蛋白B1(HMGB1)等炎症因子表达水平,增加超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性,降低丙二醛(MDA)和8-异前列腺素F2α(8-iso-PGF2α)水平等有关,但是否与其他机制有关尚不十分明确[1]。
DNA 甲基化是一种表观遗传学修饰,其动态变化贯穿于生命的始终,且对基因组的功能调控和稳定性维持具有重要意义。在中枢神经系统,DNA 甲基化对维持大脑的认知功能起到重要作用,通过基因调控等机制参与了神经突触可塑性和认知记忆的形成过程[18],如果DNA 甲基化异常,则可导致中枢神经退行性病变和功能障碍[19-20]。创伤应激时,中枢神经系统的DNA甲基化水平发生改变,通过调控Gdnf、Bdnf、Dlgap2、Gad、Reln 等突触可塑性相关基因在海马等区域的表达,影响神经突触可塑性和记忆能力,造成认知功能障碍[21]。本研究结果显示脓毒症小鼠海马组织全基因组DNA甲基化水平降低,在吸入氢气后明显升高,说明在SAE 这种急性脑损伤情况下,DNA 甲基化状态发生了改变,全基因组甲基化水平降低,吸入氢气有明显的改善作用,能够一定程度上升高全基因组甲基化水平。
DNA的甲基化过程是在DNMTs的催化下,将甲基供体S-腺苷蛋氨酸(S-adenosylmethionine,SAM)中的甲基转移到DNA特定碱基上,DNA甲基化可以发生在胞嘧啶的C-5 位、腺嘌呤的N-6 位及鸟嘌呤的N-7位等多个位点,但在高等真核细胞中DNA甲基化主要发生在CpG 中胞嘧啶的C-5 位,使其变为5-甲基胞嘧啶(5mc)。DNMTs 主要包括DNMT1、DNMT3a 和 DNMT3b。DNMT1 在 DNA 复制的过程中,识别母链已甲基化的CpG位点,催化相应子链上的CpG 位点甲基化,将母链的甲基化状态复制到子链中,称为维持甲基转移酶,在成熟大脑中,DNMT1主要表达在有丝分裂后的神经元和神经胶质细胞,主要作用是维持局部的甲基化状态[22];DNMT3a 和DNMT3b可将双链DNA上未甲基化的CpG位点重新建立新的甲基化状态,称为重新甲基转移酶,中枢神经系统中DNMT3a主要表达在发展、成熟的神经元,以及少突胶质细胞及星形胶质细胞中,对中枢神经系统的复杂行为学功能起到关键作用,DNMT3b 则主要表达在胚胎及神经前体细胞,在成熟神经元内表达较少,但对突触可塑性和记忆形成有一定的调节作用[23]。本研究结果显示在1、3、7 d 时脓毒症小鼠海马组织DNMT1 和DNMT3a 的mRNA 和蛋白表达水平增强,DNMT3b 的表达mRNA 和蛋白表达水平减弱,在吸入氢气后,DNMT1 和DNMT3a 的表达减弱,DNMT3b的表达增强,说明脓毒症时小鼠海马组织内的DNA 甲基化转移酶的表达发生了明显的紊乱,并且吸入氢气可以在一定程度上纠正这些紊乱。因此,笔者推测能够纠正DNA甲基化的紊乱状态是氢气治疗SAE的重要机制之一。
正常情况下,DNA 甲基化处于一种相对稳定的状态,有赖于甲基化和去甲基化过程的动态平衡,去甲基化过程是指在去甲基化酶的作用下移除5mc上的甲基,使其重新变为胞嘧啶的过程[24]。本研究中脓毒症组小鼠虽然在 1、3、7 d 时 DNMT1 和DNMT3a的mRNA 和蛋白表达均明显增加,但全基因组DNA甲基化水平却有不同程度的降低,可能与其他因素影响有关,如甲基供体不足,去甲基化酶活动增强等,然而氢气能够纠正脓毒症小鼠海马组织DNA甲基化状态的具体机制还需进一步研究。
综上所述,吸入氢气能在一定程度上纠正脓毒症小鼠海马组织的DNA甲基化状态的紊乱,升高全基因组DNA甲基化水平,使DNMT1和DNMT3a的表达增强,DNMT3b 的表达减弱。改善DNA 甲基化紊乱状态是氢气治疗SAE的重要机制之一。

