瓜子金基于HMG-COA/SREBP/LXRa通路的LO2细胞脂代谢研究
董晶晶 刘富岗 郝鹏飞
1 河南省郑州市第六人民医院药务科 450000; 2 河南中医药大学药学院; 3 南阳理工学院 张仲景国医国药学院
瓜子金,系芸香目远志科远志属植物的带根全草,气微,味微辛苦[1];始载于《植物名实图考》,主要分布于华北、华中、西南等地,在河南南阳桐柏山区也有发现;该药材内服主治活血散瘀,外用主治疔疮疖肿,民间应用较为广泛,具有潜在的科研、经济价值[2]。本研究以瓜子金为研究对象,主要探讨其不同萃取部位对人肝细胞(LO2)胆固醇、甘油三酯代谢的干预情况,为瓜子金药材的临床应用提供初步理论基础。
1 仪器与试药
1.1 仪器 Lambda 750型紫外可见分光光度计(美国珀金埃尔默股份有限公司);XH-100A型电脑微波萃取仪(北京祥鹄科技发展有限公司);BT25S型分析天平(赛多利斯科学仪器有限公司);Synergy2酶标仪(基因有限公司);CKX31型倒置显微镜(奥林巴斯有限公司);HCB-1300V型垂直层流洁净工作台(青岛海尔特种电器有限公司)等。
1.2 试剂 小牛血清白蛋白、胎牛血清(杭州四季青有限公司);油酸、胆固醇、25-羟胆固醇、洛伐他汀、非诺贝特(Sigma 公司);总胆固醇测试盒(南京建成生物工程研究所)。兔抗人SREBP-2、HMG-COA、LXRa一抗(Santa Cruz公司);辣根过氧化物酶标记羊抗兔二抗、LO2细胞(武汉博士德生物工程有限公司);MTT、DMEM培养液、Western blot荧光检测试剂盒(Hyclone-Pierce公司);胰酶(Boster);RAPI蛋白提取试剂盒(碧云天生物技术公司)。
1.3 试药 瓜子金采自河南省南阳市桐柏山区,经南阳理工学院张仲景国医国药学院黄显章副教授鉴定为远志科远志属植物瓜子金(Polygala japonica Houtt.)。
2 方法与步骤
2.1 供试品的制备 称取已粉碎的瓜子金干燥全草100g,置索氏提取器中,以80%的乙醇连续回流提取3h,得母液,而后回收溶剂至无醇味,得到浸膏;以适量水混悬浸膏,并分别用环己烷、二氯甲烷、水饱和正丁醇三种溶剂萃取,进而得到环己烷部位、二氯甲烷部位、正丁醇部位及水部位;全部回收溶剂后,分别得到干燥固体:环己烷部位(Ⅰ)1.08g、二氯甲烷部位(Ⅱ)1.35g、正丁醇部位(Ⅲ)2.27g、水部位(Ⅳ)3.11g。
2.2 试剂的配置
2.2.1 药物的配置:精密称取Ⅰ、Ⅱ、Ⅲ部位5.00mg分别溶于100μl DMSO中,精密称取Ⅳ部位5.00mg溶于100μl超纯水中;各自混匀后0.22μm滤膜滤过细菌,分装,-20℃储存备用。
2.2.2 阳性对照药的配置:取洛伐他汀、非诺贝特胶囊中粉末,研细后根据每粒胶囊所含成分,计算所需粉末质量,最终浓度均为1×10-5mol/L。
2.3 实验方法
2.3.1 细胞的培养:LO2细胞依传统培养方法[3],在37℃、5%CO2及饱和湿度条件下,培养于10%胎牛血清的DMEM中;当细胞铺满细胞瓶后,用胰酶进行消化传代。
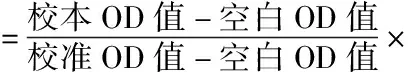
2.3.2 MTT检测不同部位对LO2细胞增殖的影响:取对数生长期的LO2细胞,以0.25%的胰酶消化后,接种于96孔板,每孔约2×103个,置于37℃、5%CO2培养箱中孵育24h;之后,加入不同浓度梯度的各萃取部位,分别为0.1、0.2、0.4、0.8、1.6mg/ml;另设空白组(无细胞培养基)、阴性对照组(溶剂组);每组设6个复孔,培养48h后,每孔加入10μl MTT试液,再次孵育4h,除去上清,每孔加入150μl DMSO,振荡15min,并于酶标仪测定490nm处OD值。再依据以下公式计算细胞存活率:

2.3.3 LO2高胆固醇细胞模型的建立[4]:细胞正常传代后,于10%胎牛血清的DMEM培养基中培养24h后,弃去原培养基,改以1% BSA培养,同时加入10μg/ml胆固醇+1μg/ml 25-羟胆固醇作用24h后即得。
2.3.4 LO2高甘油三酯细胞模型的建立[4]:细胞正常传代后,于10%胎牛血清的DMEM培养基中培养24h后,弃去原培养基,改以1% BSA 培养,同时加入50μmol/L的油酸作用24h后即得。
2.3.5 药物对LO2细胞脂代谢的影响:取对数生长期的LO2细胞,以0.25%的胰酶消化后,接种于96孔板,每孔约2×103个,于37℃、5%CO2培养箱中孵育24h;依照“2.3.3”“2.3.4”项下方法造模完成之后,加入不同浓度的各萃取部位,另设空白组、模型组、阳性对照组(高胆固醇模型选洛伐他汀、高甘油三酯模型选非诺贝特);培养24h后,倾去上清液,以PBS清洗2次后,以裂解液裂解,裂解好的液体不离心直接分别按照总胆固醇、总甘油三酯测定试剂盒操作步骤进行加样,然后于酶标仪下比色,记录数值后按照下列公式分别计算总胆固醇、总甘油三酯含量:
÷待测样本蛋白浓度
L)÷待测样本蛋白浓度
2.3.6 药物对HMG-COA还原酶、SREBP-2、LXRa的影响:取对数生长期的LO2细胞,分别设置空白组、模型组和各萃取部位组,给药培养24h后,以RAPI试剂盒提取总蛋白,BCA法对总蛋白进行定量;然后配胶、上样、电泳、转膜、封闭,再用相应的一抗4℃孵育过夜,TBST溶液洗涤后换对应的二抗,于摇床上低温低速摇动1h,再次用TBST洗膜3次;取ECL 发光试剂A液、B液按1∶1混匀,均匀滴加至膜上,除去多余发光液,待NC膜晾干后显影、定影,最后将NC膜放入成像仪中采集图像,以软件Quantity One分析条带灰度值。

3 结果
3.1 各萃取部位对LO2细胞增殖的影响 由图1可知,各萃取部位对LO2细胞增殖的影响随浓度的上升而逐渐加大,其中Ⅱ、Ⅲ、Ⅳ萃取部位随浓度变化较缓,而Ⅰ部位对其影响在0.8mg/ml时呈现显著性差异,故Ⅰ部位的给药浓度应该控制在0.4mg/ml以下。而根据该结果,选取细胞存活率约90%时的药物浓度为中浓度,以其1/2倍浓度为低浓度,以其2倍浓度为高浓度;最终选定Ⅱ、Ⅲ、Ⅳ萃取部位中浓度为0.4mg/ml,而Ⅰ部位中浓度为0.2mg/ml。

图1 各萃取部位对LO2细胞增殖的影响
3.2 各萃取部位对LO2细胞胆固醇代谢的影响 由图2可知,模型组总胆固醇量较空白组呈显著性差异,表明造模成功;而阳性对照药洛伐他汀对LO2细胞高胆固醇模型有降低作用,相较模型组呈现显著性差异;而在各萃取部位中,Ⅰ、Ⅱ部位的降胆固醇作用仅在高剂量呈现显著性差异,低、中剂量无显著性差异;Ⅲ部位的作用在中剂量时就表现出显著性差异,并且随着剂量加大,其降胆固醇的作用越明显;Ⅳ部位各剂量下均未呈现显著性差异。
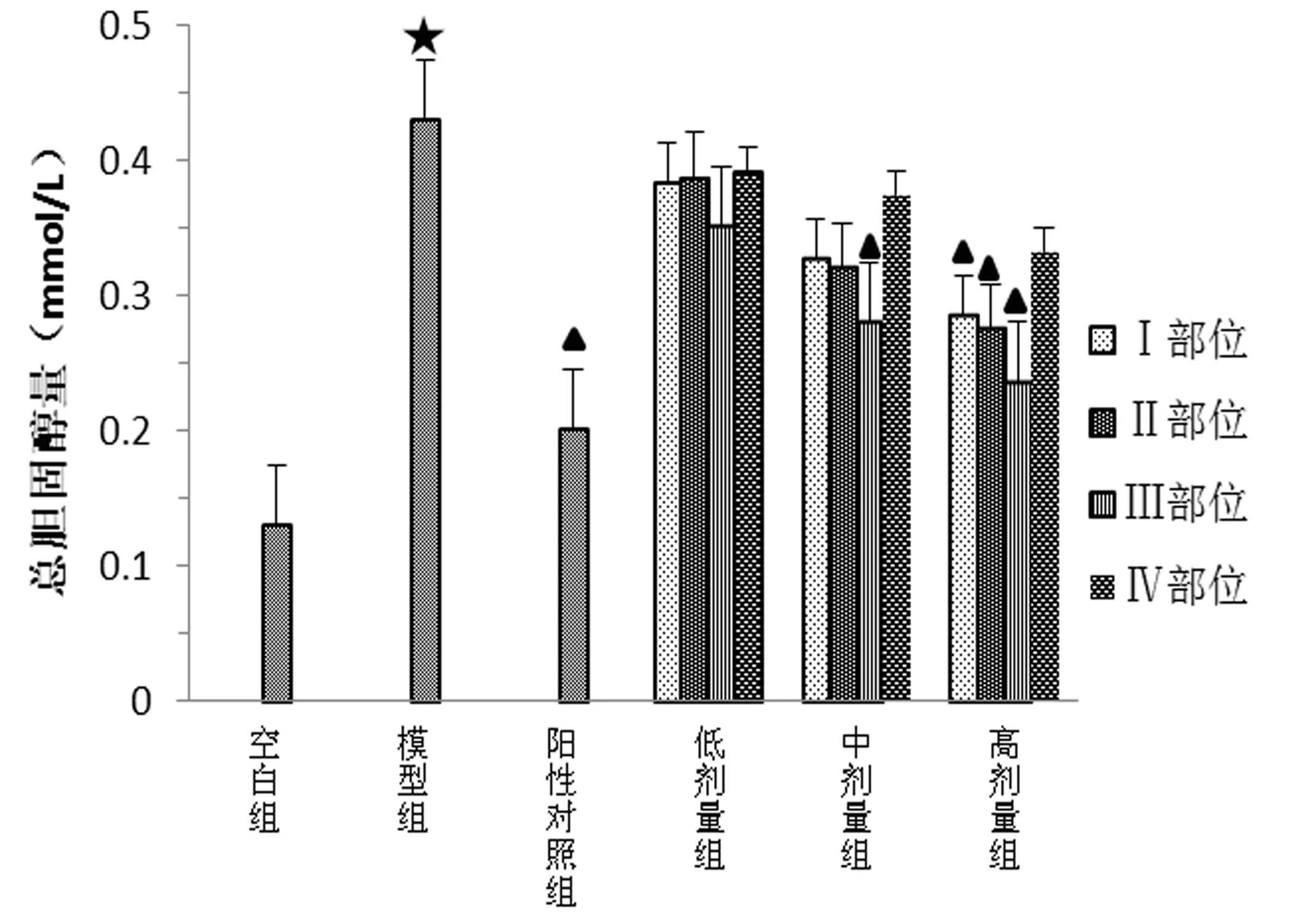
图2 各萃取部位对LO2胆固醇代谢的影响
3.3 各萃取部位对LO2细胞甘油三酯代谢的影响 由图3可知,模型组总甘油三酯量较空白组呈显著性差异,表明造模成功;阳性对照药非诺贝特对LO2细胞高甘油三酯模型有降低作用,相较模型组呈现显著性差异;在各萃取部位中,Ⅰ、Ⅳ部位在各剂量下对LO2细胞的高甘油三酯模型的降低作用均未呈现显著性差异;而Ⅱ、Ⅲ部位在中、高剂量时,对高甘油三酯模型的降低作用呈现显著性差异,且Ⅱ部位的效果优于Ⅲ部位。

图3 各萃取部位对LO2甘油三酯代谢的影响
3.4 药物在高胆固醇模型中对HMG-COA还原酶、SREBP-2、LXRa的影响 依据上述实验结果,只有Ⅱ、Ⅲ部位对LO2细胞脂代谢的干预作用呈现显著性差异,故而,该部分仅讨论这两个部位对HMG-COA还原酶、SREBP-2、LXRa的影响。
由图4、6可知,在高胆固醇模型中,Ⅱ部位仅会降低HMG-COA的表达,且对其影响有显著性差异;Ⅲ部位除了降低HMG-COA、SREBP-2的表达之外,还可提高LXRa蛋白的含量,且三者均有显著性差异。由图5、7可知,在高甘油三酯模型中,Ⅱ部位、Ⅲ部位对于HMG-COA的表达均无影响,但两者均可降低SREBP-2蛋白的表达,并呈显著性差异;另Ⅱ部位还可显著降低LXRa的表达。
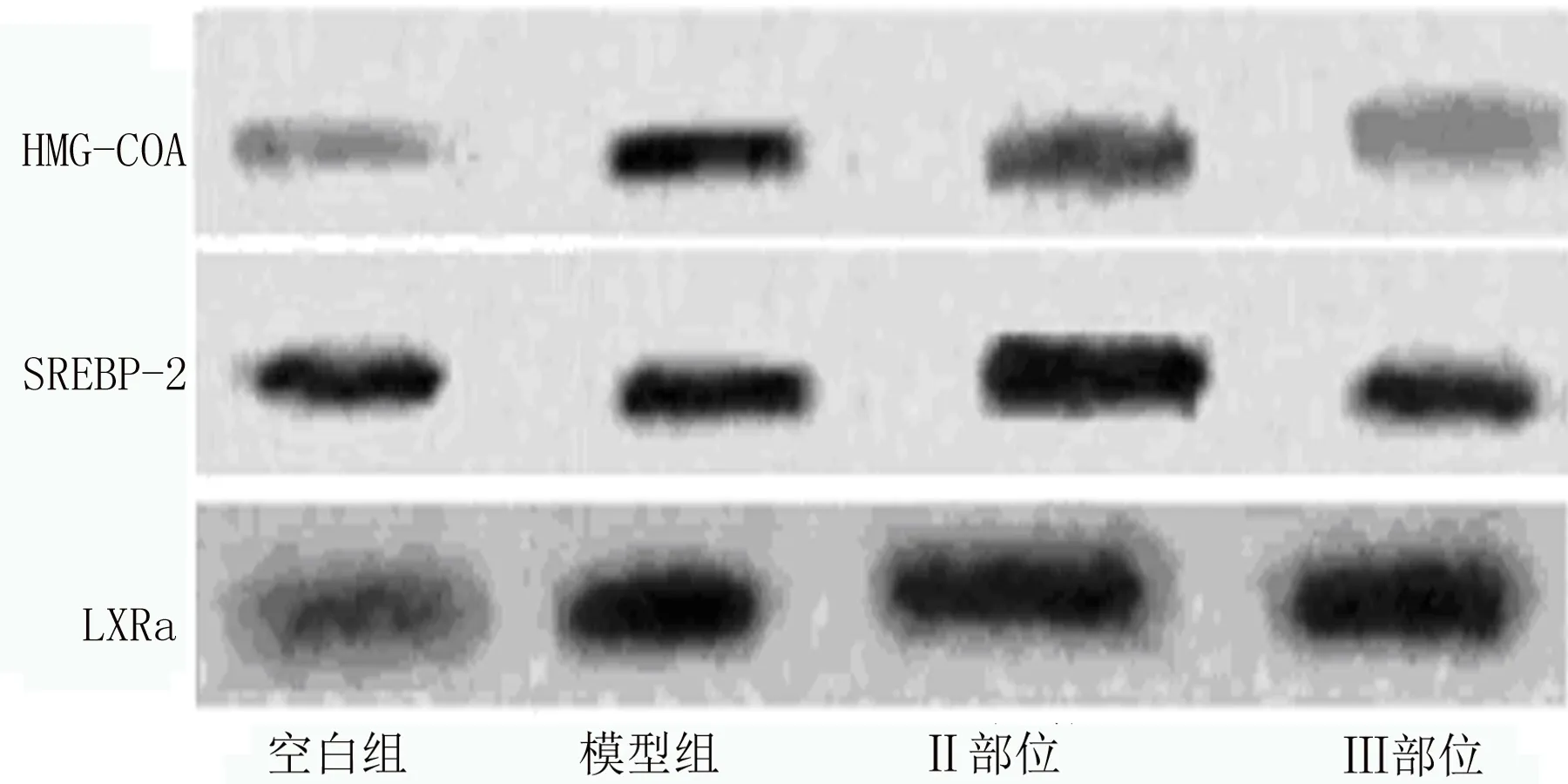
图4 高胆固醇模型Western-Blot结果图

图5 高甘油三酯模型Western-Blot结果图

图6 高胆固醇模型Western-Blot相对灰度

图7 高甘油三酯模型Western-Blot相对灰度
4 讨论
综合上述实验结果可知,Ⅱ部位和Ⅲ部位在不同的模型中,对HMG-COA、SREBP-2和LXRa的影响也是不同的:在高胆固醇模型中,Ⅱ部位和Ⅲ部位均可显著降低细胞中HMG-COA还原酶蛋白的表达,Ⅱ部位对SREBP-2蛋白和LXRa的影响无显著性差异,Ⅲ部位则表现出降低SREBP-2而升高LXRa的作用;在高甘油三酯模型中,Ⅱ部位和Ⅲ部位均对HMG-COA无影响且降低SREBP-2的表达,另Ⅱ部位对LXRa表达的降低呈显著性差异。
HMG-COA还原酶是胆固醇合成过程的关键限速酶,许多调节胆固醇的药物都是通过调节该酶达到治疗效果,它的下调可直接导致胆固醇合成的减少[5-8];SREBPs系列为胆固醇调节元件蛋白,通过Insig-Srebp-Scap途径对细胞内胆固醇进行反馈调节,该蛋白的下调会通过HMG-COA及LDLR影响胞内胆固醇的含量[9-12];LXRa则属于广泛分布于肝细胞中的核受体,该受体主要参与糖脂代谢,与脂肪酸的合成及胆固醇的逆转运关系紧密,当该受体被激活时,一方面会通过影响SREBPs而促使胆固醇逆转运以及加速生成胆汁酸促进胆固醇的排放,从而降低胞内胆固醇含量;另一方面会直接作用于FAS、ACC,而促进脂肪酸的合成及释放;故而当药物作用于这三者时,定将引起细胞内脂代谢的一系列变化[13-15]。
Ⅱ部位、Ⅲ部位对LXRa的调节作用完全相反,笔者猜测可能是两者作用于LXRa不同的上游因子所引起,抑或是作用于LXRa不同的受体所致;Ⅱ部位主要通过降低LXRa的含量继而实现其较为强大的调节甘油三酯的能力,而Ⅲ部位主要通过升高LXRa的含量从而加速胆固醇的排出,为接下来的逆转运做好准备;两者对该受体不同的作用,导致两者在LO2细胞中调节胆固醇、甘油三酯的能力的不同。而具体两者作用于何种因子而诱发LXRa不同的表达,调节胆固醇和甘油三酯的机制又是如何,还需要进一步的实验探索证实。

