天然黄酮山奈酚(Kaempferol)与Alpha-葡萄糖苷酶的相互作用机制分析
汪大伟,赵 杰,唐红进*
(1.安徽医科大学第二附属医院 药学部,安徽 合肥 230601;2.安徽工程大学 生物与化学工程学院,安徽 芜湖 241000)
糖尿病是一种以高血糖为主要生理特征的代谢性疾病,主要分为1型糖尿病和2型糖尿病。前者由胰岛素缺乏导致,约占糖尿病人群的5%~10%;后者主要由胰岛素抵抗引起,是最常见的发病类型[1]。流行病学调查表明,糖尿病世界发病率呈逐年上升趋势,且伴随出现多种严重的并发症,如中风、神经系统性疾病、心血管类疾病和肾衰竭等[2]。
对于2型糖尿病,调控机体餐后高血糖是其主要的治疗方向,而延迟或抑制机体内碳水化合物的消化和吸收是重要途径。因此,通过抑制α-葡萄糖苷酶的活性来调控餐后血糖水平是当前对于2型糖尿病治疗的重要途径[3-4]。α-葡萄糖苷酶(EC 3.2.1.20)是一种膜结合蛋白,在生物体内可将寡聚糖和双糖转化为葡萄糖,后者吸收进入血液,从而显著性升高血糖水平。随着对α-葡萄糖苷酶生理功能的认识不断加深,其现已被确认为2型糖尿病治疗的重要药物靶点。因此,α-葡萄糖苷酶抑制剂在机体餐后控制和延缓碳水化合物的消化水解以及单糖吸收等方面有着非常重要的生理作用[5]。许多天然来源或化学合成的结构新颖的α-葡萄糖苷酶抑制剂被筛选发现,有望开发成具有潜在成药性的新型2型糖尿病治疗药物。当前,临床应用的α-葡萄糖苷酶抑制剂主要包括伏格列波糖(Voglibose)、米格列醇(Miglitol)、阿卡波糖(Acarbose)和1-脱氧野尻霉素(1-Deoxynojirimycin,DNJ),化学结构如图1所示。但在治疗过程中,常伴随出现许多较为严重的不良反应,如肠胃胀气、腹痛、腹泻、过敏及皮肤问题等[6-7]。因此,发现高效低毒的新型α-葡萄糖苷酶抑制剂对于糖尿病及其并发症的治疗具有重要的研究价值。
一直以来,天然产物都是药物开发中药物先导化合物发现的重要源泉,并取得了丰硕的研究成果。临床许多针对特定生物靶点的各类型疾病治疗药物都直接或间接来源于天然产物,如青蒿素、紫杉醇、石杉碱、吗啡、托品烷类生物碱等药物[8-10]。因此,基于中药或天然产物寻找针对特定蛋白靶标的活性药物先导物,具有极其重要的研究意义和开发价值。黄酮类化合物是非常重要的一类天然产物,广泛存在于不同种类的植物中,尤其是中草药、蔬菜和水果中。黄酮类物质山奈酚(Kaempferol)被报道具有广泛的生物学活性,如清除自由基、抗氧化、免疫抑制、抗病毒、抗肿瘤等作用[11-12],化学结构如图1所示。近些年来,黄酮类活性分子已引起众多研究者的研究兴趣,很多针对特定生物靶点来寻找活性黄酮类化合物的研究工作被陆续展开。Zhang[13]等人综合应用多种光谱学方法探讨了山奈酚与黄嘌呤氧化酶的相互作用机制,发现山奈酚通过占据该酶催化活性中心,与该酶形成复合物并诱使其二级结构变化,从而发挥较好的酶抑制活性。结合前期实验筛选结果,综合应用酶抑制动力学实验、荧光光谱实验和分子对接从酶分子水平探讨了天然黄酮山奈酚与α-葡萄糖苷酶的相互作用机制,为以山奈酚为基础的2型糖尿病药物先导物开发提供参考。

图1 临床应用α-葡萄糖苷酶抑制剂类药物的化学结构
1 材料与方法
1.1 实验材料
天然黄酮山奈酚(纯度>99%,上海阿拉丁生化科技股份有限公司);α-葡萄糖苷酶(从SaccharomycesCerevisiae中分离获得)、底物4-硝基苯-α-D-葡吡喃糖苷和阳性对照药DNJ(Sigma-Aldrich公司(USA));其他化学试剂以及实验用溶剂为分析纯级,实验用水为超纯水。
1.2 实验方法
(1)体外山奈酚对α-葡萄糖苷酶抑制实验。工作液配制:α-葡萄糖苷酶用75 mM的磷酸缓冲液(PB,pH 7.4)配制为0.1 U/mL;山奈酚、阳性对照药DNJ用DMSO溶解后配制为10 mM的工作液,实验过程中用PB稀释至所需浓度;反应底物4-硝基苯-α-D-葡吡喃糖苷用PB配制为50 mM的母液。
实验测定:在96孔板上分别加入样品溶液100 μL和α-葡萄糖苷酶溶液50 μL,混合均匀后使用酶标仪(Thermo Multiskan Go V1.01.10,USA)于405 nm处记录吸光度值,并于37 ℃孵育10 min。随后,再向孔板中加入反应底物4-硝基苯-α-D-葡吡喃糖苷(50 μL,1 mM)以启动酶促反应,继续孵育20 min后,测定吸光度值。实验过程中,用PB作为空白对照实验组,DNJ作为阳性对照药,并设置3组复孔。抑制率通过如下公式计算:

式中,C0和S0分别表示空白对照组和待测样品组在0 min的吸光度值;C30和S30分别表示空白对照组和待测样品组在30 min的吸光度值。通过测定获得的山奈酚对α-葡萄糖苷酶的抑制率来计算半数抑制浓度(IC50)(GraphPad Prism V6.0.2),IC50代表在所述实验条件下,α-葡萄糖苷酶的活性被抑制50%时所需待测化合物的浓度。
(2)山奈酚对α-葡萄糖苷酶抑制的可逆性分析。将不同浓度的样品溶液100 μL和α-葡萄糖苷酶溶液50 μL加入孔板中,混合均匀后置于37 ℃孵育10 min。随后,加入反应底物4-硝基苯-α-D-葡吡喃糖苷(50 μL,1 mM),并于405 nm处每隔30 s读数一次,共计入5 min内的吸光度值。实验过程中,设置空白对照组和3组复孔。以酶促动力学反应速率(v,ΔA/min)对酶液浓度做图,来判断山奈酚对α-葡萄糖苷酶的抑制可逆性。
(3)山奈酚对α-葡萄糖苷酶的抑制类型分析。将不同浓度的样品溶液100 μL和α-葡萄糖苷酶溶液(50 μL,0.1 U/mL)加入孔板中,混合均匀后置于37 ℃孵育10 min。随后,再向孔板中加入反应底物4-硝基苯-α-D-葡吡喃糖苷(母液50 mM,用PB稀释至所需浓度)。于405 nm处每隔30 s读数一次,共计入5 min内的吸光度值。实验过程中,设置空白对照组和3组复孔。使用酶促动力学反应速率(v,ΔA/min)的倒数对不同浓度的底物4-硝基苯-α-D-葡吡喃糖苷的倒数来获得Lineweaver-Burk plots双倒数方程,以判断山奈酚对α-葡萄糖苷酶的抑制反应特性,并通过Dixon方程来判断抑制常数Ki值。
(4)山奈酚介导的荧光光谱分析。使用Hitachi F-7000荧光分光光度计进行山奈酚介导下的α-葡萄糖苷酶荧光谱分析,激发光波长为280 nm,发射光波长范围为300~500 nm,激发光和发射光狭缝宽度均为5 nm,配备150 W氙灯和1.0 cm四面光滑的石英比色皿,所有荧光实验测定均在室温下进行。同步荧光光谱的测定通过将激发光和发射光谱的波长差值(Δλ)设定为15 nm和60 nm,二者分别代表荧光发射基团酪氨酸(Tyr)和色氨酸(Trp)的荧光光谱学行为变化。取浓度为0.1 U/mL的α-葡萄糖苷酶酶液3.5 mL加入到比色皿中,再滴加山奈酚,混合均匀后静置5 min,测定其荧光值,如此往复进行多次滴加并测定多个待测物浓度下的荧光值。山奈酚浓度点(曲线a→k)依次为0、8.56 μM、17.11 μM、25.65 μM、34.17 μM、42.67 μM、51.17 μM、59.64 μM、68.10 μM、76.55 μM、84.99 μM。山奈酚(曲线m)的荧光曲线测定浓度为5 μM。同时,设置空白对照(PB缓冲液)以在数据处理中扣除背景荧光值从而校正所测得的荧光密度。
(5)分子对接实验。分子对接实验通过分子计算模拟软件AutoDock V4.2完成。α-葡萄糖苷酶/α-D-葡萄糖的蛋白晶体结构(PDB ID:3A4A)从RCSB蛋白数据库中获得。山奈酚通过Chem3D绘制其分子结构,并经SYBYL X-2.0进行小分子能量最优化处理。蛋白结构经过除水、加氢原子、加Gasteiger电荷和缺失残基修补以准备拟对接的生物大分子。在进行Auto Grid之前设定Grid Box参数,x、y、z值均选定为60 Å,且中心设定为0.375 Å(Space Center),使酶的活性催化中心被包含在所设定的盒子内部。在进行AutoDock运算时,选择拉马克遗传算法进行对接运算并设定100次(runs),其余的计算参数按照软件默认值进行设定。根据对接构象结果,结合簇类分析,自由能、氢键、疏水性的相互作用,范德华力等影响复合物构象稳定性的因素以探讨山奈酚—α-葡萄糖苷酶的相互结合机制并制图。
2 结果及分析
2.1 山奈酚对α-葡萄糖苷酶抑制活性的评价
通过体外酶抑制活性实验来评价山奈酚对α-葡萄糖苷酶的抑制活性,结果如图2所示。由图2可以看出,与阳性对照药DNJ(IC50=9.87±0.34 μM)相比,随着山奈酚浓度的不断升高,对α-葡萄糖苷酶的抑制率也不断增加,呈现出浓度依赖性,计算获得的半数抑制浓度IC50为91.11±1.12 μM。体外酶抑制活性实验数据表明,天然黄酮山奈酚是潜在的α-葡萄糖苷酶抑制剂,可作为2型糖尿病治疗的药物先导物,有待于进一步研究开发。
2.2 山奈酚对α-葡萄糖苷酶抑制可逆性的判断
体外酶抑制可逆性评价试验结果如图3所示。在不同α-葡萄糖苷酶酶液浓度下,随着山奈酚的浓度不断增加,所有曲线均相交于原点位置,同时各条曲线的斜率呈现不断降低的趋势,由此表明该黄酮对α-葡萄糖苷酶的抑制效应为可逆性抑制,否则为相交于X轴且斜率保持不变的平行曲线,即非可逆性抑制效应。Zhang[14]等在探讨天然黄酮木犀草素与α-葡萄糖苷酶相互作用机制时,发现木犀草素与α-葡萄糖苷酶之间也表现为类似的可逆性抑制作用。

图2 山奈酚对α-葡萄糖苷酶抑制活性的评价 图3 山奈酚对α-葡萄糖苷酶反应速率的影响
2.3 山奈酚对α-葡萄糖苷酶抑制类型的分析
酶动力学抑制类型评价实验测定结果如图4所示。由图4可以看出,筛选得到的抑制剂山奈酚表现为非竞争性抑制剂,表明它可以和α-葡萄糖苷酶或α-葡萄糖苷酶—底物复合物结合。同时,根据Dixon作图(1/v vs[kaempferol])得知,山奈酚和α-葡萄糖苷酶相互作用时的竞争性抑制常数Ki为20.10 μM。Zhang[14]等在探讨天然黄酮木犀草素与α-葡萄糖苷酶相互作用机制时,发现木犀草素与α-葡萄糖苷酶之间也表现为类似的非竞争性抑制作用。

图4 山奈酚对α-葡萄糖苷酶抑制类型Lineweaver-Burk plots的分析
2.4 山奈酚对α-葡萄糖苷酶的荧光谱分析
山奈酚介导下α-葡萄糖苷酶荧光淬灭谱分析如图5a所示。随着山奈酚浓度的不断增加,α-葡萄糖苷酶的内置荧光值不断降低(a→k),表明山奈酚可以与α-葡萄糖苷酶结合并发生相互作用,且显著猝灭山奈酚的内置基团荧光(主要为荧光发射团:芳香氨酸残基Tyr、Trp、Phe)。Zhang[13]等发现山奈酚在与黄嘌呤氧化酶相互作用过程中也表现出类似的荧光淬灭效应。此外,在不同Δλ值、山奈酚介导下,α-葡萄糖苷酶同步荧光谱分析如图5b、图5c所示。当Δλ=15 nm时,在山奈酚的介导下,α-葡萄糖苷酶的荧光发射基团Tyr的荧光密度由290 nm蓝移到285 nm处,表明残基Tyr周围的微环境疏水性增加,极性降低。当Δλ=60 nm时,在山奈酚的介导下,随着浓度不断增加,α-葡萄糖苷酶的荧光发射基团Trp的荧光密度由280 nm红移到284 nm处,表明残基Trp周围的微环境疏水性降低,极性增加。山奈酚介导下α-葡萄糖苷酶同步荧光谱RSFQ值分析如图5d所示。由图5d可知,氨基酸残基Tyr、Trp的RFSQ(%)趋于非常接近,表明山奈酚在酶活性中心处与氨基酸残基Tyr、Trp在空间上距离较为相近,二者对α-葡萄糖苷酶的内置荧光效应呈现相似的贡献。同时,从同步荧光光谱还可以发现,随着化合物浓度不断增加,α-葡萄糖苷酶的内置荧光密度不断降低。由此可以得知,山奈酚可以与α-葡萄糖苷酶直接结合并发生相互作用,诱导其酶的二级结构变化,从而表现出潜在的抑制效应,并淬灭其内置荧光。
2.5 分子对接模拟
α-葡萄糖苷酶由一条亚基(589个氨基酸)组成,蛋白晶体结构分辨率为1.6 Å。在对接实验中,根据分子对接结果中的结合自由能(Free Binding Energy)分析确定,化合物与α-葡萄糖苷酶结合自由能最低的构象,即为最优势结合构象,并对其做进一步相互作用分析。分子对接簇类分析结果如图6a所示,共产生6类构象簇(42/100,红色条标记),山奈酚与α-葡萄糖苷酶结合自由能为-6.64 kcal/mol。山奈酚在α-葡萄糖苷酶活性口袋处的结合构象如图6b所示,其活性位点主要由氨基酸残基Lys156、Tyr158、Phe159、His280、Asp307、Pro312、Leu313、Phe314、Arg315、Tyr316、Glu411、Asn415组成。山奈酚在α-葡萄糖苷酶活性结合位点处的相互作用分析如图6c所示。山奈酚与α-葡萄糖苷酶相互作用过程中,分别与氨基酸残基Tyr158(2.19 Å)、Pro312(1.96 Å)、Arg315(2.20 Å)、Asn415(1.85 Å)之间共形成了4根氢键作用。而且,还可以观察到山奈酚结构中的芳香环与残基Phe314、Tyr316的芳香环以face-to-edge的方式形成了π-π相互作用。此外,由对接结果还可得知,山奈酚与α-葡萄糖苷酶之间存在疏水性相互作用,如残基Tyr158、Phe314、Tyr316、Asn415等。
山奈酚和α-葡萄糖苷酶的分子对接结果如表1所示。综上可以看出,小分子抑制剂与α-葡萄糖苷酶之间形成的氢键、疏水性相互作用以及范德华力等非共价键作用力的存在对于维系蛋白受体—配体复合物构象的稳定和小分子对酶的抑制效应发挥着非常重要作用。

图5 山奈酚介导下α-葡萄糖苷酶荧光淬灭谱、同步荧光谱、RSFQ值分析

图6 山奈酚与α-葡萄糖苷酶分子结合构象的簇类分析结果、山奈酚在α-葡萄糖苷酶活性口袋处的结合构象以及结合位点处的相互作用分析
3 结论
综上所述,天然产物山奈酚表现出潜在的α-葡萄糖苷酶抑制活性,其IC50值为91.11±1.12 μM。山奈酚通过非竞争性且可逆性抑制α-葡萄糖苷酶,并呈现浓度依赖性。同时,结合荧光淬灭光谱和二维荧光谱分析,通过分子对接分析山奈酚—α-葡萄糖苷酶结合构象可以推断,山奈酚能够与底物竞争性结合于α-葡萄糖苷酶的活性中心。如果山奈酚浓度较低,则酶活性被轻度抑制。随着山奈酚浓度不断增加,抑制剂山奈酚可能通过诱导酶二级结构构象发生变化,阻止底物进入活性位点,从而表现出潜在的酶抑制效应。因此,天然产物山奈酚可作为新型α-葡萄糖苷酶抑制剂的备选化合物,用于2型糖尿病及其并发症药物先导物进行后续研究。
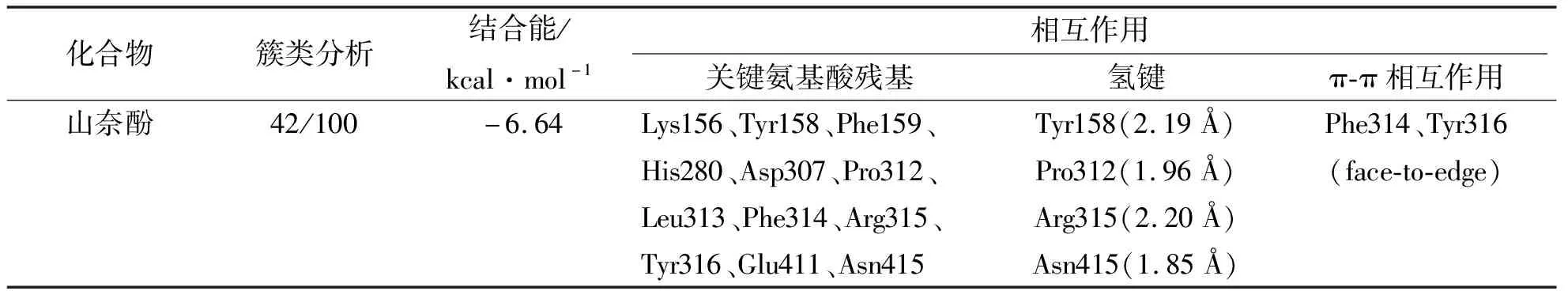
表1 山奈酚和α-葡萄糖苷酶的分子对接结果

