基于R5 ELISA和RP-HPLC法的小麦发芽过程中主要致敏蛋白含量变化
胡慧敏,潘雪峰,杨恒,陈晨,陈银基
基于R5 ELISA和RP-HPLC法的小麦发芽过程中主要致敏蛋白含量变化
胡慧敏,潘雪峰,杨恒,陈晨,陈银基
(南京财经大学食品科学与工程学院,南京 210023)
【目的】探索不同萌发状态小麦麸质蛋白、醇溶蛋白和谷蛋白等主要致敏蛋白含量的动态变化规律,以及醇溶蛋白、谷蛋白亚基的含量变化,为无麸质食品的研发和发芽小麦的利用提供科学依据。【方法】控制发芽条件获得7种不同萌发状态的小麦,采用SDS-PAGE分析不同萌发状态小麦醇溶蛋白(Gliadins)、谷蛋白(Glutenin)的亚基组成变化,通过R5 ELISA和RP-HPLC进一步测定小麦发芽过程中麸质蛋白、醇溶蛋白和谷蛋白亚基的含量变化。【结果】以R5 ELISA法和RP-HPLC法两种方法可有效测定小麦中麸质蛋白、醇溶蛋白和谷蛋白亚基的含量,发芽处理对上述过敏蛋白及亚基有不同程度的影响;麸质蛋白含量在发芽初期变化不大,后期显著减少;ω-醇溶蛋白相对含量变化不显著;-/-醇溶蛋白的相对含量在发芽过程中大幅度降低(从未处理小麦籽粒的41.85%降低到发芽处理后的31.51%—35.35%,<0.01),-醇溶蛋白相对含量从31.37%显著增加到发芽处理后的36.69%—39.02%(<0.05);高分子量麦谷蛋白亚基(high molecular weight glutenin subunit,HMW-GS)和低分子量麦谷蛋白亚基(low molecular weight glutenin subunit,LMW-GS)的相对含量变化不显著,HMW-GS略有减少,从8.66%(未处理组)降低到5.94%(芽长1/4),再回升到7.28%(芽长=籽粒长);LMW-GS略有增加,从8.30%(未处理组)增加到10.45%(芽长=籽粒长)。【结论】R5 ELISA法和RP-HPLC法两种方法都可以有效进行小麦致敏蛋白定量分析;发芽过程中小麦的致敏蛋白含量总体呈下降趋势,特别是在发芽芽长达籽粒长1/2时,含有最多致敏肽的-/-醇溶蛋白下降尤为显著,提示小麦进行适度发芽处理可以降低致敏性。
乳糜泻;醇溶蛋白;谷蛋白;麸质蛋白;R5 ELISA;RP-HPLC
0 引言
【研究意义】乳糜泻(Celiac disease)是由基因易感个体摄入小麦、黑麦和大麦中的麸质蛋白引起的T细胞介导的自身免疫病[1]。乳糜泻不同于一般蛋白质过敏,一般蛋白质过敏不是自身免疫病,通常不会引起严重的肠道损伤或营养不良。乳糜泻患者目前的治疗方法是终生坚持严格的无麸质饮食。乳糜泻的患病率约为0.5%—2%,在发达国家发生率较高,且在发展中国家呈快速增长趋势[2-3]。麸质蛋白由麦醇溶蛋白和麦谷蛋白组成,约占小麦贮藏蛋白的80%,麦醇溶蛋白和麦谷蛋白参与面筋网络的形成,影响面团的流变学特性。麦醇溶蛋白可分为-/-、-和-醇溶蛋白,分子量分布在30—60 kD[4]。麦谷蛋白按分子量大小可分为高分子量麦谷蛋白亚基(HMW-GS,80—130 kD)和低分子量麦谷蛋白亚基(LMW-GS,30—70 kD)[5]。研究表明,麦醇溶蛋白中含有丰富的脯氨酸和谷氨酰胺,是麸质蛋白中最主要的抗原成分,能够触发免疫反应,其中包含刺激性表位最多的是-/-醇溶蛋白[6]。虽然小麦中的麸质蛋白是由基因决定的,但麸质蛋白的积累在很大程度上受环境的影响[7]。小麦收获季节如遇到阴雨天气,容易出现发芽现象,会给广大农民及食品加工企业带来巨大经济损失[8]。因此,研究小麦发芽过程中麸质蛋白、醇溶蛋白、谷蛋白及其亚基的含量变化,有利于提高发芽小麦的应用潜力,提高其利用率和经济价值。【前人研究进展】董召荣等[9]研究发现,随着发芽程度加深,小麦籽粒蛋白质含量递减,湿面筋含量逐渐降低。OLAERTS等[10]研究田间小麦收获前发芽对蛋白质性质的影响,发现小麦发芽过程中LMW-GS含量增加。基于R5和G12抗体的酶联免疫吸附法(R5 ELISA & G12 ELISA)是最常用的检测食品中麸质蛋白的方法,因其特异性、敏感性和作为常规检测的适应性,是国际食品法典委员会(CAC)官方认可的方法[11]。然而,由于食品中蛋白质及其他成分的复杂性和抗体的局限性,ELISA法可能会导致假阳性或阴性以及对实际刺激CD的T细胞表位的高估[12]。因此,有学者建立了基于蛋白质组学的方法如反相或凝胶渗透高效液相色谱(RP-HPLC & GP-HPLC)、质谱法和液相色谱法(LC-MS/MS)相结合的方法对麸质蛋白进行定量测定的非免疫学方法[13]。【本研究切入点】研究表明,发芽会降低小麦籽粒蛋白质含量以及小麦粉的加工品质,但不同发芽状态中小麦麸质蛋白、醇溶蛋白、谷蛋白以及其亚基的含量变化未有过系统性分析。【拟解决的关键问题】研究不同萌芽状态小麦麸质蛋白组分含量动态变化,并进一步探究其亚基组成和含量的动态变化规律,为无麸质食品的研发提供资料积累,为发芽小麦的利用提供新思路。
1 材料与方法
试验于2018—2019年在南京财经大学粮食储运国家工程实验室进行。
1.1 材料与试剂
小麦,品种:焦麦266,产于河南商丘。
乙醇、异丙醇、二硫苏糖醇(Dithiothreitol,DTT)、丙酮、三氯乙酸,分析纯;乙腈,三氟乙酸,色谱纯;考马斯亮蓝R-250、5×蛋白上样缓冲液,北京索莱宝科技有限公司;Cocktail提取液,ELISA试剂盒,德国拜发公司。
1.2 仪器与设备
Mini-PROTEAN电泳仪,ChemiDocTMXRS+凝胶成像系统,美国BIO-RAD公司;1260高效液相色谱仪,美国安捷伦公司;SpectraMax 190酶标仪,美国Molecular Devices公司。
1.3 方法
1.3.1 发芽小麦制备 取干净托盘铺上一层滤纸,小麦浸泡15 h后,平铺在滤纸上,室温下放于避风防晒处发芽,隔1—2 h喷一次水,保持小麦湿润。分别选取未浸泡、浸泡15 h、露白、芽突破种皮、芽长1/4、芽长1/2和芽长等于籽粒的小麦,40℃下干燥,磨粉,过60目筛。
1.3.2 麦醇溶蛋白提取 称取0.1 g小麦粉,加入1 mL蒸馏水,涡旋混匀,于50℃水浴中提取30 min,每隔5—210 min混匀一次,13 000 r/min离心10 min,重复提取2次,弃上清液;加入1 mL 0.5 mol·L-1NaCl溶液,50℃水浴中提取30 min,每隔5—10 min混匀一次,13 000 r/min离心10 min,重复提取两次,弃上清液;加入1 mL 70%乙醇溶液,50℃水浴中提取30 min,每隔5—10 min混匀1次,13 000 r/min离心10 min,重复提取2次,合并2次上清液,即为麦醇溶蛋白。
1.3.3 麦谷蛋白提取 除去醇溶蛋白后的沉淀加入1 mL提取液(50%异丙醇、80 mmol∙L-1Tris-HCl、1% DTT,pH 8.0),65℃水浴中提取30 min,13 000 r/min离心10 min,重复提取2次,合并上清液即为麦谷蛋白。
1.3.4 SDS-PAGE 每个样品加入4倍体积的100%丙酮,-20℃冷冻过夜。第2天取出样品,升温至4℃,10 000 r/min离心15 min,弃上清液,空气干燥沉淀。向沉淀中加入200 μL 1×蛋白上样缓冲液,100℃加热5 min,取5 μL上样。参考SHETTY[14]的方法并适当修改进行蛋白质电泳,采用12%的分离胶和4%的浓缩胶,电泳条件为恒流电压80 V。电泳结束后,用10%三氯乙酸溶液固定15 min,固定后用考马斯亮蓝R-250对蛋白进行染色过夜,脱色液脱色6 h,用凝胶成像系统成像。
1.3.5 R5 ELISA 称取0.25 g小麦粉,加入2.5 mL Cocktail提取液,涡旋混匀,50℃条件下孵育40 min;加入7.5 mL 80%乙醇,室温条件下回旋振荡1 h,7 000 r/min离心10 min,收集上清液,稀释5 000倍,取100 μL每孔进行检测。检测步骤如下:将100 μL标准品及样品溶液加到微孔中,均做2个平行,在室温条件下孵育30 min;倒出孔中液体,将微孔板倒置在吸水纸上拍打,完全除去孔中液体,每孔加入250 μL稀释后的洗涤缓冲液洗涤微孔,以上操作重复进行2遍;每孔加入100 μL稀释后的酶连接物溶液,室温条件下孵育30 min,倒出孔中液体,每孔加入250 μL洗涤缓冲液洗涤微孔2遍;每孔加入50 μL底物和50 μL发色剂,室温条件下暗处孵育30 min;每孔加入100 μL反应终止液,30 min内于450 nm处测量吸光度值。
1.3.6 RP-HPLC 所有样品过0.45 μm滤膜后上样,参考CHO等[15]的方法并适当修改进行RP-HPLC分析,分析条件如下:色谱柱:AcclaimTM120 C18(250 mm×4.6 mm,5 μm);流动相A:含0.1%三氟乙酸的水溶液;流动相B:含0.1%三氟乙酸的乙腈溶液;进样量:20 μL;流速:1 mL·min-1;检测波长:210 nm;柱温:60℃;洗脱梯度:0—60 min流动相B从21%到48%,60—65 min流动相B从48%到21%,65—70 min流动相B为21%,70 min停止。
1.4 数据处理
采用Excel整理数据,SPSS Statistics进行数据分析和OriginPro 8作图。
2 结果
2.1 不同发芽状态的小麦
选取小麦发芽的7个不同阶段,如图1所示。
2.2 不同发芽状态小麦醇溶蛋白、谷蛋白SDS-PAGE分析
从图2可以看出,醇溶蛋白亚基分子量主要集中在30—60 kD,但因-/-、-、-醇溶蛋白分子量较接近,无法完全区分开。从图3可以看出谷蛋白被成功分离,主要分为两个部分:高分子量谷蛋白亚基HMW-GS主要集中在80—140 kD,有5个条带;低分子量谷蛋白亚基LMW-GS主要集中在30—50 kD,同样有5个条带。两种蛋白质组分在小麦发芽过程中无显著变化。
2.3 不同发芽状态小麦麸质蛋白ELISA分析
R5 ELISA法测定小麦发芽过程中麸质蛋白含量变化如图4所示。可以看出,发芽处理对小麦麸质蛋白含量有一定影响,从未浸泡到突破种皮的过程中,小麦麸质蛋白含量变化不显著,到芽长1/4时含量明显降低,从未浸泡小麦籽粒的17 800 mg·kg-1降低到17 165 mg·kg-1,芽长1/2时有所回升,到芽长=籽粒时又下降到最低水平17 043 mg·kg-1。
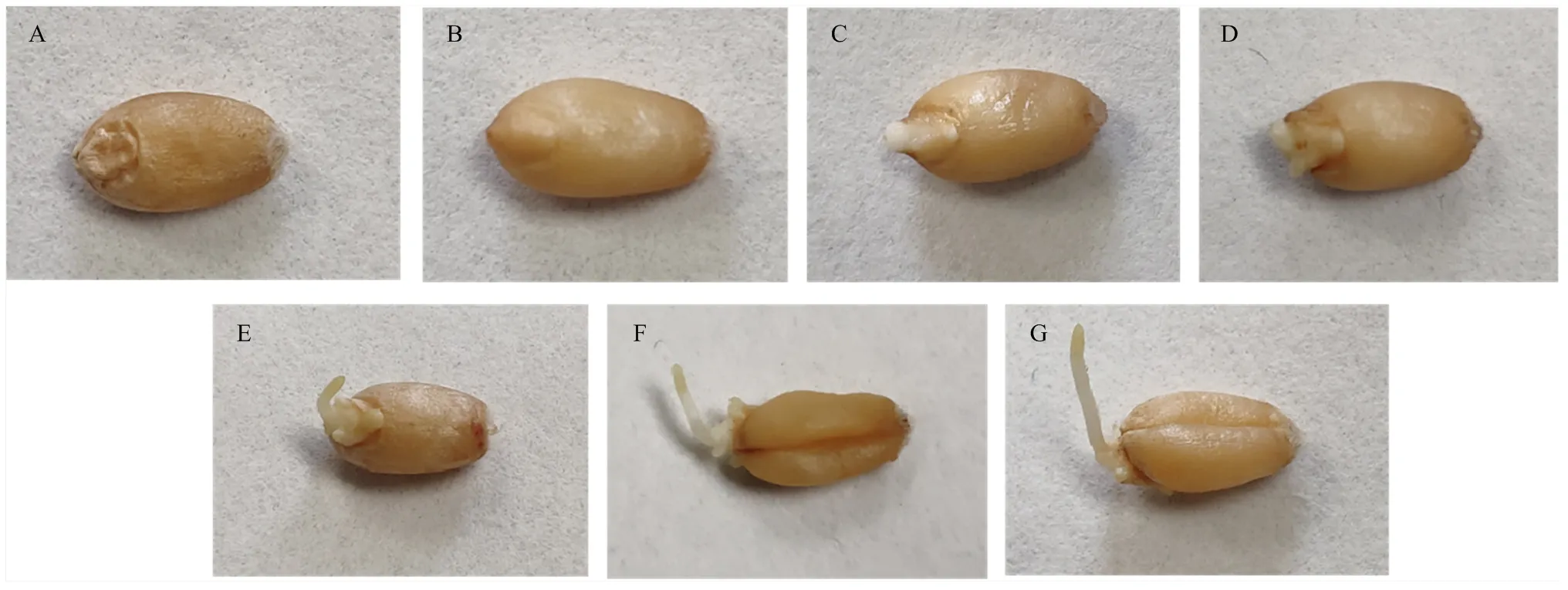
A-G分别为未浸泡、浸泡后、露白、突破种皮、芽长1/4、芽长1/2、芽长=籽粒。下同
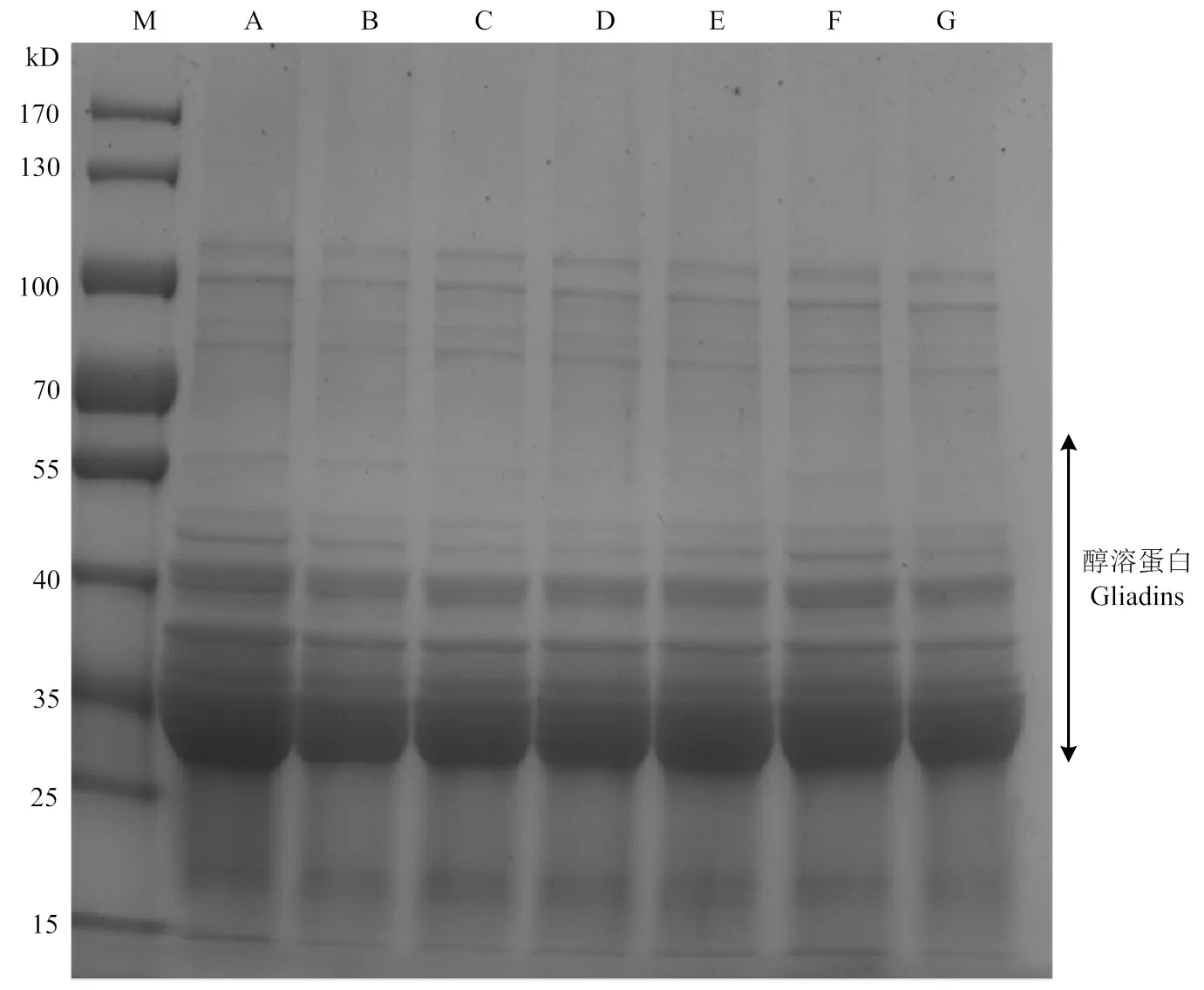
图2 不同发芽状态小麦醇溶蛋白SDS-PAGE图谱
2.4 不同发芽状态小麦醇溶蛋白、谷蛋白RP-HPLC分析
不同发芽程度小麦醇溶蛋白、谷蛋白RP-HPLC图谱如图5所示,根据保留时间判断各蛋白亚基的种类。ω-醇溶蛋白保留时间在25—34 min,-/-醇溶蛋白保留时间为35—45 min,-醇溶蛋白保留时间在46—56 min;HMW-GS保留时间在25—39 min,LMW-GS保留时间在40—54 min。根据RP-HPLC图谱中单个蛋白质亚基的峰面积占所有蛋白质亚基总峰面积的百分比计算各蛋白质亚基的相对含量,即亚基相对含量(%)=(各亚基峰面积/总峰面积)×100[16]。
不同发芽状态小麦醇溶蛋白和谷蛋白亚基的相对含量如表1所示。发芽处理对小麦醇溶蛋白、谷蛋白亚基的相对含量有不同程度的影响,-醇溶蛋白相对含量在发芽过程中变化不显著(>0.05),基本维持在与未发芽小麦籽粒相同的水平;-/-醇溶蛋白相对含量变化差异极显著(<0.01),在浸泡15 h后从41.85%急剧下降到33.81%,浸泡后到突破种皮的阶段-/-醇溶蛋白相对含量缓慢回升,从33.81%增加到35.35%,之后又下降至31.51%;-醇溶蛋白相对含量变化差异显著(<0.05),未浸泡到露白的过程中缓慢上升,从31.37%增加到39.02%,露白到芽长1/4过程变化不显著,之后下降到36.91%。HMW-GS与LMW-GS的相对含量在小麦发芽过程中的变化不显著(>0.05),其中HMW-GS相对含量在浸泡过程中变化较小,从浸泡到芽长1/4阶段有所减少,从8.98%降低到5.94%,之后回升到8.00%,最后阶段小幅减少,最终含量较原小麦籽粒低;LMW-GS相对含量在浸泡15 h后小幅增加,从浸泡后到突破种皮阶段小幅降低,从9.80%下降到8.73%,之后回升到10.45%,发芽后期相对含量较原小麦籽粒有所增加。
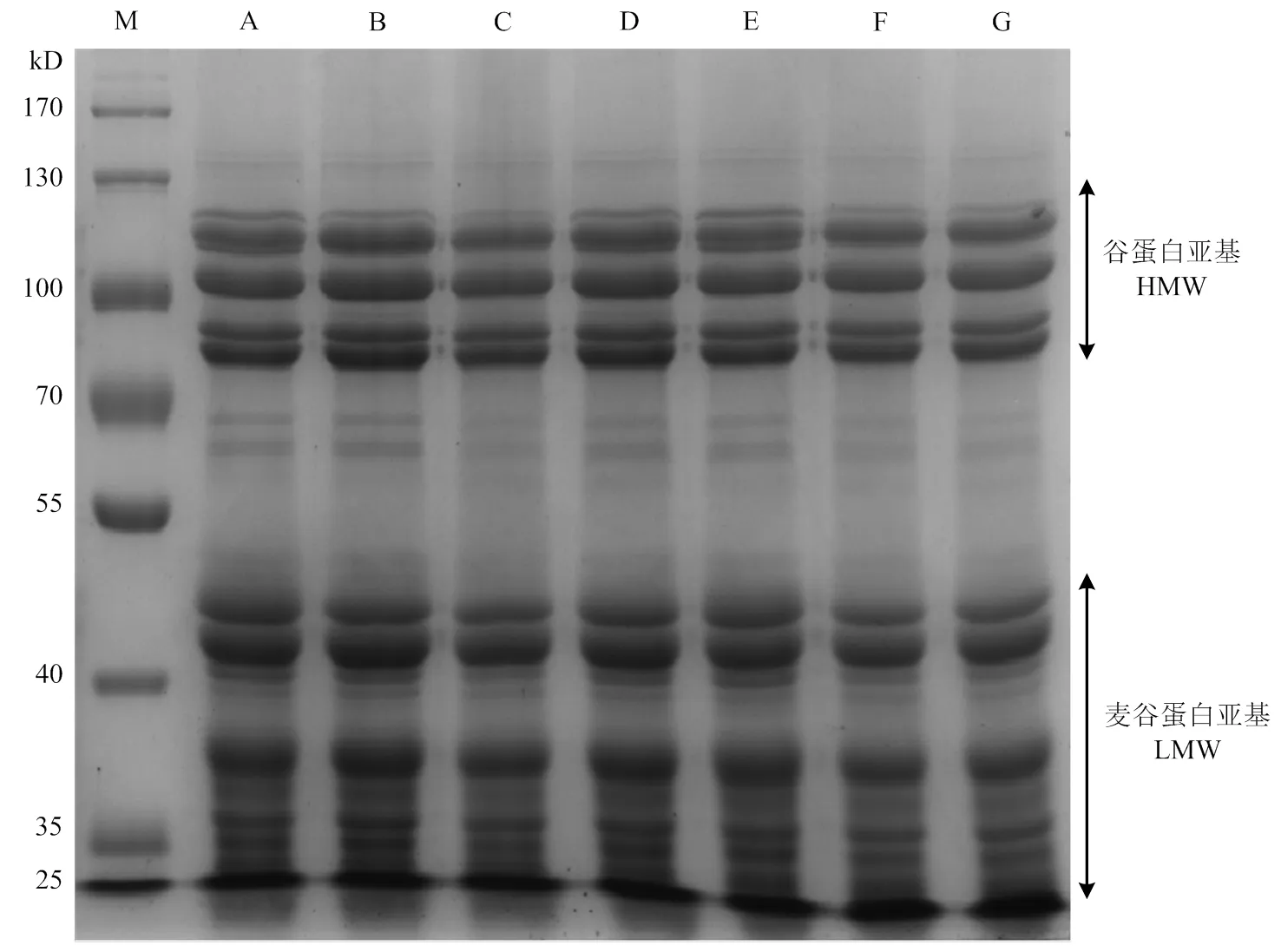
图3 不同发芽状态小麦谷蛋白SDS-PAGE图谱
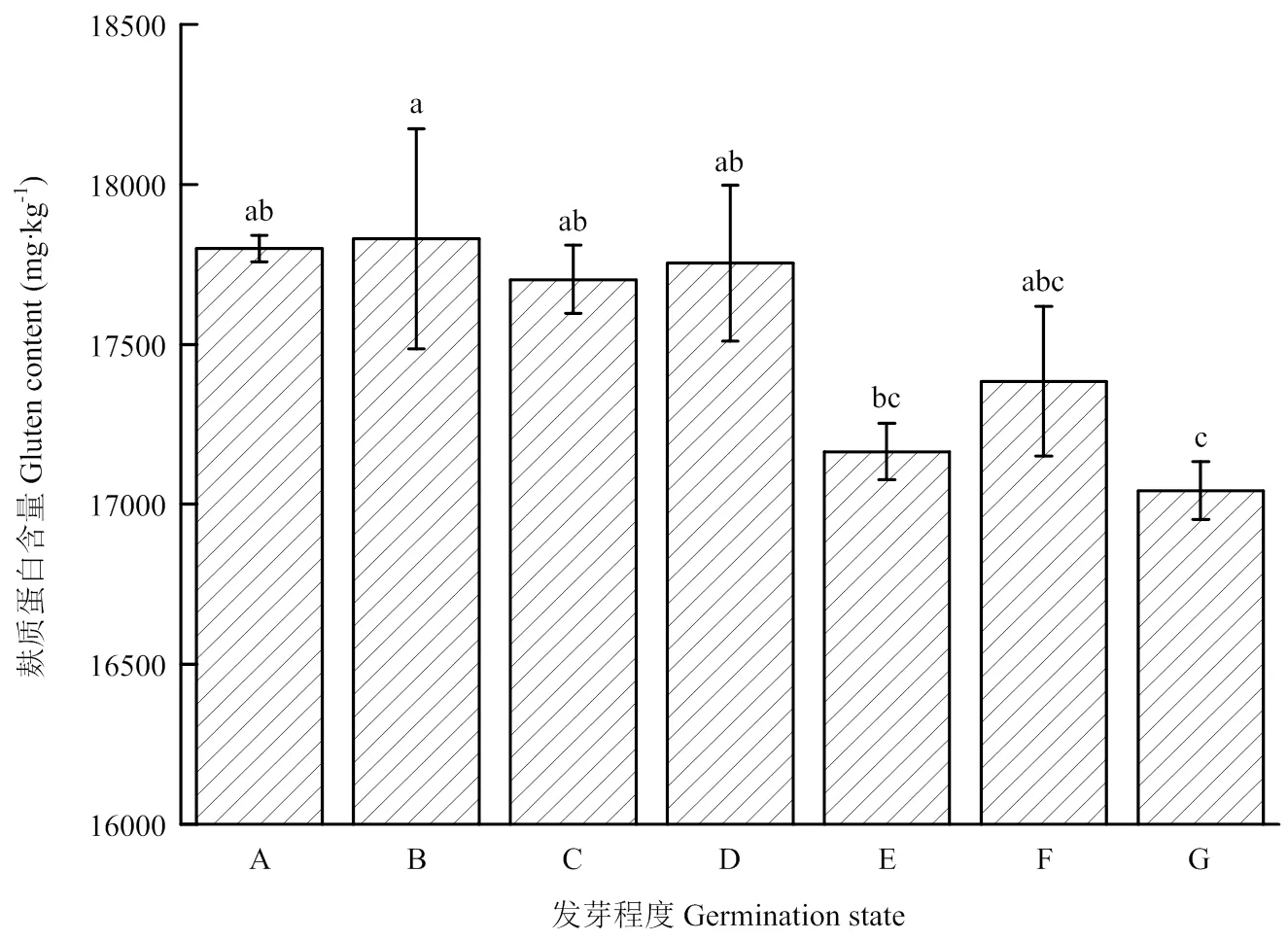
不同小写字母表示不同发芽程度小麦麸质蛋白含量的差异显著(P<0.05)
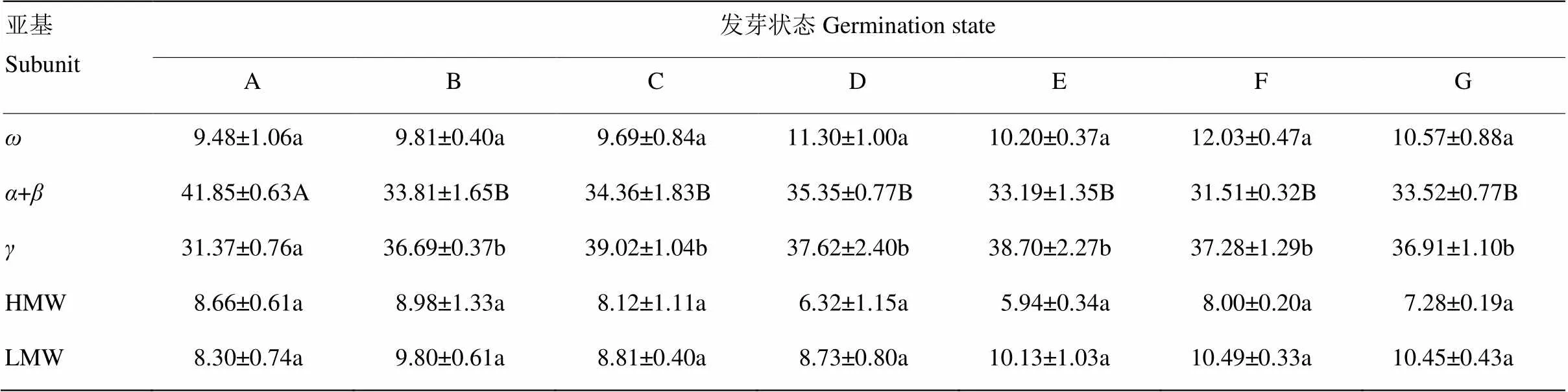
表1 不同发芽状态小麦中醇溶蛋白和谷蛋白相对含量(%)
表中小写字母表示在0.05水平差异显著,大写字母表示在0.01水平差异显著
The lowercase letters indicate significant differences at 0.05 level, and the capital letters indicate significant differences at 0.01 level
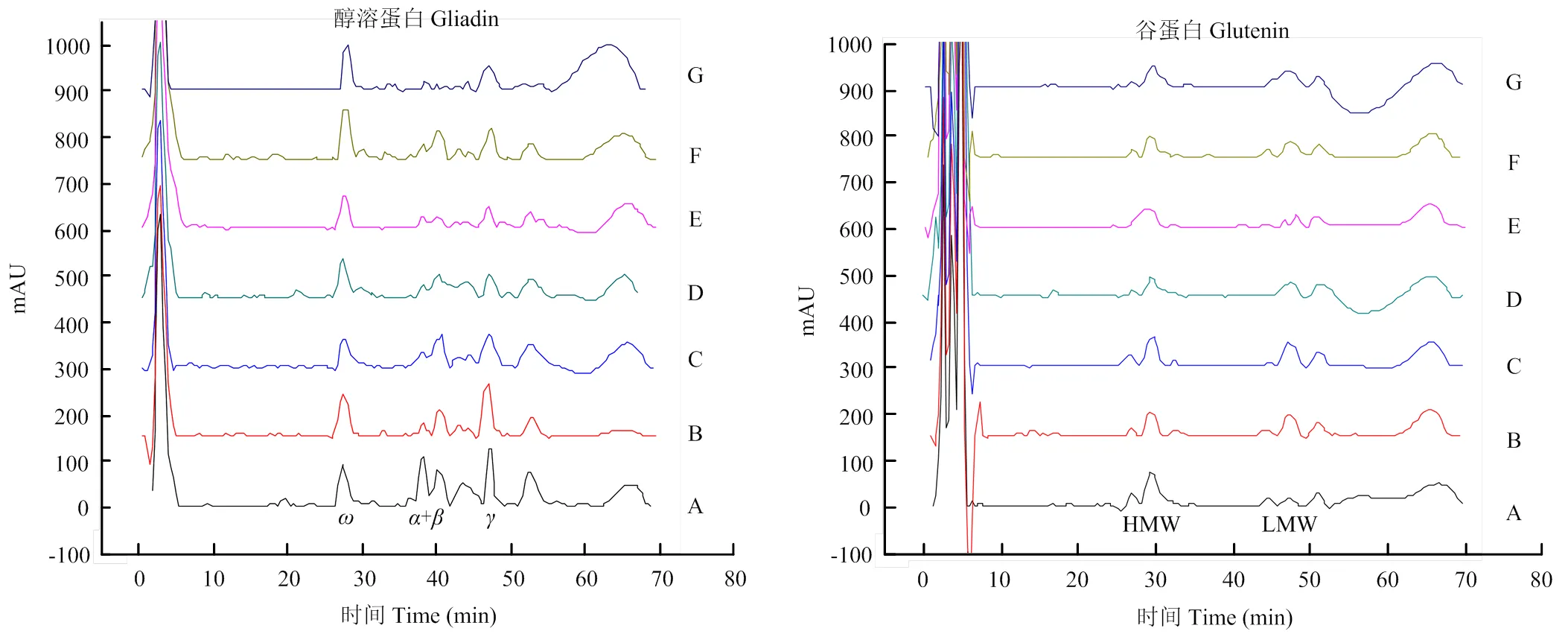
图5 不同发芽程度小麦醇溶蛋白、谷蛋白组成RP-HPLC图谱
3 讨论
麸质蛋白由麦醇溶蛋白和麦谷蛋白组成,约占小麦贮藏蛋白的80%,麦醇溶蛋白赋予面团延展性,麦谷蛋白赋予面团粘弹性,二者的组成和结构是决定面团形成及烘焙品质的重要因素[17]。小麦在发芽过程中呼吸作用增强,淀粉酶和蛋白酶活性也会增强,使蛋白质和淀粉发生水解,小麦粉的加工品质发生劣变,主要表现在面团的拉伸特性、粉质特性的下降[18-19]。对于小麦发芽过程中蛋白质的变化,前人多研究干、湿面筋含量的变化对小麦粉品质的影响,或其他功能性成分的含量变化,对组成面筋蛋白的醇溶蛋白、谷蛋白及其亚基的动态变化规律研究较少,且前人研究多以发芽时间为参照,研究发芽过程中蛋白质的变化,但小麦发芽过程受环境影响较大,仅以发芽时间为参照不能很好判断具体发芽状态。国家标准对生芽粒的定义为芽或幼根虽未突破种皮但胚部种皮已破裂或明显隆起且与胚分离的颗粒,或芽或幼根突破种皮不超过本颗粒长度的颗粒[20]。
本研究结果表明小麦发芽后期,麸质蛋白含量降低,这与张佳灵[21]、菅桂玲[22]等研究发现小麦发芽过程中湿面筋、干面筋含量和面筋指数均降低的结果一致。小麦发芽过程中LMW-GS含量增加,而HMW-GS减少,这与OLAERTS[10]、BOUKID[23]等的研究结果一致。小麦发芽过程中醇溶蛋白含量大幅度降低,这与邱然等[24]研究大麦发芽过程中醇溶蛋白含量的变化结果一致。蛋白质含量减少是由于小麦发芽时,贮藏蛋白在蛋白酶的作用下降解,为种子萌发提供必要的物质和能量。醇溶蛋白与谷蛋白含量变化趋势不同,说明蛋白酶在水解贮藏蛋白时具有一定的选择性,且种子发芽时内部发生一系列复杂的变化,其中蛋白质既发生分解又出现合成,LMW-GS的增加或许是以HMW-GS的减少为代价。PRANDI[25]、BOUKID[26]等研究不同品种小麦模拟胃肠消化物中致乳糜泻肽段肽的组成发现了13种-醇溶蛋白、3种-醇溶蛋白和1种低分子量麦谷蛋白。CICCOCIOPPO等[27]综述的36种致乳糜泻肽段包含21种-醇溶蛋白、10种麦谷蛋白和5种-醇溶蛋白。可见-醇溶蛋白是引起乳糜泻的最主要肽段,本试验可明显看出小麦发芽过程中-/-醇溶蛋白含量下降最为明显,其原因可能与半胱氨酸蛋白酶对醇溶蛋白水解的特异性有关,半胱氨酸蛋白酶以不同的速度水解所有醇溶蛋白组分,部分醇溶蛋白具有优先水解的可能性[28]。这一结果或可为无麸质食品的研发及发芽小麦的利用提供新的思路。
全球乳糜泻总患病率约为1.4%[29]。在一项对1 339名美国青少年易感基因型的长期研究中发现乳糜泻的发病率很高,平均发病率达到2.5%[30]。ABADIE等[31]发表了“乳糜泻冰山”模型,目的是证明具有经典乳糜泻症状的患者仅仅是少数患者。我国乳糜泻总发病率相比欧洲国家较低,但中国人口基数大,且有很多地区以小麦为主食,因此可能存在很多潜在乳糜泻患者。一项对19 778名16—25岁中国年轻人的研究显示,约2%的人血清乳糜泻标志物检测结果呈阳性[32]。因此,对于乳糜泻展开相关研究具有十分重要的意义,欧美国家开展研究较早,且已取得阶段性进展,而我国关于乳糜泻的研究才刚刚起步。本试验仅研究了小麦发芽过程中醇溶蛋白、谷蛋白亚基的相对含量变化,之后还需对致乳糜泻肽段展开更深入的研究。
4 结论
不同发芽状态小麦中麸质蛋白、醇溶蛋白、谷蛋白及其亚基含量变化具有一定差异,麸质蛋白在发芽前期含量变化不大,到后期开始显著减少。-/-醇溶蛋白的相对含量在发芽过程中有较大幅度降低,-醇溶蛋白相对含量无显著变化,-醇溶蛋白相对含量显著增加,HMW-GS和LMW-GS相对含量变化不显著;与未处理小麦相比,HMW-GS减少,LMW-GS增加。综上所述,适度发芽处理可降低小麦致敏肽含量。研究结果为低麸质食品的研发和发芽小麦的加工利用提供了科学依据。
[1] LEE G J, KAO J Y. Recent advances in pediatric celiac disease., 2017, 11(6): 583-592.
[2] BOUZIAT R, HINTERLEITNER R, BROWN J J,. Reovirus infection triggers inflammatory responses to dietary antigens and development of celiac disease., 2017, 356(6333): 44-50.
[3] HOLMES G K T, MUIRHEAD A. Epidemiology of coeliac disease in a single centre in Southern Derbyshire 1958-2014., 2017, 4(1): e000137.
[4] CHO K, BEOM H R, JANG Y R, ALTENBACH S B, VENSEL W H, SIMON-BUSS A, LIM S H, KIM M G, LEE J Y. Proteomic profiling and epitope analysis of the complex α-, γ-, and ω-gliadin families in a commercial bread wheat., 2018, 9: 818.
[5] JIANG Y R, BEOM H R, ALTENBACH S B, LEE M K, LIM S H, LEE J Y. Improved method for reliable HMW-GS identification by RP-HPLC and SDS-PAGE in common wheat cultivars., 2017, 22(7): 1055.
[6] WIESER H, KOEHLER P. The biochemical basis of celiac disease., 2008, 85(1): 1-13.
[7] KOGA S, BÖCKER U, WIESER H, KOEHLER P, UHLEN A K, MOLDESTAD A. Polymerisation of gluten proteins in developing wheat grain as affected by desiccation., 2017, 73: 122-129.
[8] 赵艳丽. 发芽小麦粉的利用研究[D]. 郑州: 河南工业大学, 2013.
ZHAO Y L. Study on the use of germinated wheat flour[D]. Zhengzhou: Henan University of Technology, 2013. (in Chinese)
[9] 董召荣, 柯建国, 马传喜. 不同品种小麦籽粒发芽深度对其加工品质的影响. 南京农业大学学报, 2000, 23(2): 9-12.
DONG Z R, KE J G, MA C X, Effect of different germinating conditions on kernel qualities in common wheat., 2000, 23(2): 9-12. (in Chinese)
[10] OLAERTS H, ROYE C, DERDE L J, SINNAEVE G, MEZA W R, BODSON B, COURTIN C M. Impact of preharvest sprouting of wheat () in the field on starch, protein, and arabinoxylan properties., 2016, 64: 8324-8332.
[11] Codex Committee of Methods of Analysis and Sampling. MAS/36 CRD/15. Report on the 36th session in Budapest, Hungary, 2015.
[12] DIAZ-AMIGO C, POPPING B. Accuracy of ELISA detection methods for gluten and reference materials: A realistic assessment., 2013, 61(24): 5681-5688.
[13] SCHERF K A, POMS R E. Recent developments in analytical methods for tracing gluten., 2016, 67: 112-122.
[14] SHETTY R, VESTERGAARD M, JESSEN F, HÄGGLUND P, KNORR V, KOEHLER P, PRAKASH S H, HOBLEY T J. Discovery, cloning and characterisation of proline specific prolyl endopeptidase, a gluten degrading thermo-stable enzyme from,., 2017, 107: 56-63
[15] CHO S W, KANG C S, KANG T G, CHO K M , PARK C S. Influence of different nitrogen application on flour properties,gluten properties by HPLC and end-use quality of Korean wheat., 2018, 17(5): 982-993.
[16] GIANIBELLI M C, ECHAIDE M, LARROQUE O R, CARRILLO J M, DUBCOVSKY J. Biochemical and molecular characterisation of Glu-1 loci in Argentinean wheat cultivars., 2002, 128(1): 61-73.
[17] ZHOU J X, LIU D M, DENG X, ZHEN S M, WANG Z M, ZHOU J W. Effects of water deficit on breadmaking quality and storage protein compositions in bread wheat (L.)., 2018, 98: 4357-4368.
[18] ŚWIECA M, DZIKI D, GAWLIK-DZIKI U. Starch and protein analysis of wheat bread enriched with phenolics-rich sprouted wheat flour., 2017, 228: 643-648.
[19] 刘可欣, 杨润强, 顾振新, 王沛. 发芽对小麦营养和加工品质影响研究进展. 中国粮油学报, 2018, 33(5): 135-140.
LIU K X, YANG R Q, GU Z X, WANG P. Research progress for effect of germination on wheat nutrition and processing quality., 2018, 33(5): 135-140. (in Chinese)
[20] 中华人民共和国国家标准. 小麦. GB 1351-2008.
State Standard of the People’s Republic of China. Wheat. GB 1351-2008. (in Chinese)
[21] 张佳灵. 芽萌动对小麦粉品质影响的研究[D]. 武汉: 武汉轻工大学, 2015.
ZHANG J L. Influence of germination on wheat flour quality [D]. Wuhan: Wuhan Polytechnic University, 2015. (in Chinese)
[22] 菅桂玲, 田建珍, 郑学玲, 刘翀, 韩小贤. 发芽时间对不同系统小麦粉品质的影响. 粮食与饲料工业, 2015(3). doi: 10.7633/j.issn. 1003-6202.2015.03.003.
JIAN G L, TIAN J Z, ZHEN X L, LIU C, HAN X X. Impact of germination time on wheat flour quality in different milling streams., 2015(3). doi: 10.7633/j.issn.1003-6202. 2015.03.003. (in Chinese)
[23] BOUKID F, PRANDI B, BUHLER S, SFORZA S. Effectiveness of germination on protein hydrolysis as a way to reduce adverse reactions to wheat., 2017, 65(45): 9854-9860.
[24] 邱然, 杨文洲, 张春玲. 萌发大麦种子内肽酶活力、醇溶蛋白及氨基酸含量变化. 食品与生物技术学报, 2007, 26(5): 48-52.
QIU R, YANG W Z, ZHANG C L. Changes in endopeptidase activity, content of hordein and free amino acids in barley seeds during germination., 2007, 26(5): 48-52. (in Chinese)
[25] PRANDI B, BENCIVENNI M, FACCINI A, TEDESCHI T, DOSSENA A, MARCHELLI R, GALAVERNA G, SFORZA S. Composition of peptide mixtures derived from simulated gastrointestinal digestion of prolamins from different wheat varieties., 2012, 56(2): 223-231.
[26] BOUKID F, PRANDI B, SFORZA S, SAYAR R, SEO Y W, MEJRI M, YACOUBI I. Understanding the effects of genotype, growing year and breeding on tunisian durum wheat allergenicity. 1. The Baker’s Asthma case., 2017, 65(28): 5831-5836.
[27] CICCOCIOPPO R, DI SABATINO A, CORAZZA G R. The immune recognition of gluten in coeliac disease., 2005, 140(3): 408-416.
[28] BIGIARINI L. Hydrolysis of gliadin during germination of wheat seeds., 1995, 147(2): 161-167.
[29] SINGH P, ARORA A, STRAND T A, LEFFLER D A, CATASSI C, GREEN P H, KELLY C P, AHUJA V, MAKHARIA G K. Global prevalence of celiac disease: Systematic review and meta-analysis., 2018, 16(6): 823-836.
[30] LIU E, DONG F, BARÓN A E, TAKI I, NORRIS J M, FROHENERT B I, HOFFENBERG E J, REWERS M. High incidence of celiac disease in a long-term study of adolescents with susceptibility genotypes. Gastroenterology, 2017, 152(6): 1329-1336.
[31] ABADIE V, SOLLID L M, BARREIRO L B, JABRI B. Integration of genetic and immunological insights into a model of celiac disease pathogenesis., 2011, 29: 493-525.
[32] YUAN J L, ZHOU C Y, GAO J Y, LI J J, LU J, LI X, WANG X Z, TONG P, WU Z H, YANG A S, YAO Y H, NADIF S, SHU H, JIANG X, WU Y J, GILISSEN L, CHEN H B. Prevalence of celiac disease autoimmunity among adolescents and young adults in China., 2017, 15(10): 1572-1579.
Wheat Gluten, Gliadins and Glutenin Content Changes during Germination Based on the Methods of R5 ELISA and RP-HPLC
HU HuiMin, PAN XueFeng, YANG Heng, CHEN Chen, CHEN YinJi
(College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023)
【Objective】 The current study was conducted to determine the dynamic changes of gluten, gliadins and glutenin contents in different germination states of wheat, so as to provide a scientific basis for the development of gluten-free food and utilization of germinated wheat. 【Method】Seven wheat grains with different germination states were obtained by controlling the germination conditions. Changes of composition of gliadins and glutenin were analyzed by sodium dedecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE), and changes of gluten, gliadins and glutenin subunits during wheat germination were further determined by enzyme-linked immunosorbent assay based on R5 antibody (R5 ELISA) and reversed-phase high-performance liquid chromatography (RP-HPLC). 【Result】The content of gluten, gliadins and glutenin subunits in wheat could be determined by R5 ELISA and RP-HPLC. Germination treatment had different effects on the allergic proteins and subunits mentioned above. The content of gluten changed little at the early stage of germination, but decreased significantly at the later stage. The relative content of-gliadins did not change significantly. During the germination process, the relative content of-/-gliadins was significantly reduced, with the percentage of untreated wheat seeds decreased from 41.85% to 31.51%-35.35% after germination (<0.01). The relative content of-gliadins increased significantly from 31.37% to 36.69%-39.02% after germination (<0.05). The relative content changes of high molecular weight glutenin subunit (HMW-GS) and low molecular weight glutenin subunit (LMW-GS) were not significant. HMW-GS decreased slightly from 8.66% (untreated group) to 5.94% (1/4 bud length) and then to 7.28% (bud length=grain length). LMW-GS increased slightly from 8.30% (untreated group) to 10.45% (bud length=grain length).【Conclusion】Both of the methods R5 ELISA and RP-HPLC could be used for quantitative analysis of wheat sensitized proteins. The content of allergenic protein in wheat decreased during germination. In particular, when the germinating bud was up to 1/2 long, the-/-gliadin which containing the most sensitive peptide decreased significantly. It was suggested that moderate germination treatment could reduce sensitization of wheat.
celiac disease; gliadin; glutenin; gluten; R5 ELISA; RP-HPLC
2019-07-30;
2019-10-30
国家自然科学基金面上项目(31871822)
胡慧敏,E-mail:1044647411@qq.com。通信作者陈银基,E-mail:chenyinji@hotmail.com
(责任编辑 赵伶俐)

