硅对籼稻和粳稻品种磷积累的影响①
王晓君,胡安永,车 景,沈仁芳,马建锋,*
硅对籼稻和粳稻品种磷积累的影响①
王晓君1,2,胡安永1,2,车 景3,沈仁芳1,马建锋1,3*
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008; 2 中国科学院大学,北京 100049; 3 日本冈山大学植物科学与资源研究所,日本冈山 710-0046)
硅(Si)可以改善磷(P)的营养,但是其内在机制尚不明确。本研究以4个籼稻和3个粳稻品种为研究对象,通过水培试验探究硅对不同水稻品种磷积累的影响。在营养液中添加硅显著降低了籼稻和粳稻品种的地上部磷含量,但几乎不影响根部磷含量。加硅处理不影响所有供试水稻品种的磷吸收及磷从根系向地上部的转移,但提高了磷的利用效率,增加了植株P/Mn 和 P/Zn比率。磷转运蛋白(PT)基因表达分析表明,在粳稻品种中只有被硅下调,而在籼稻品种中没有显著性变化;其他PT基因的表达不受硅的影响。由此,硅对不同水稻品种的磷积累有不同的影响,磷利用率的提高可能归因于较高的P/Mn和P/Zn比率,从而导致植物中较高的有效磷。
籼稻;粳稻;硅;磷转运蛋白;基因表达;水稻
水稻()是一种非常重要的粮食作物,世界上超过1/2的人口都将水稻作为主要食物来源[1]。在我国,水稻也是第一大粮食作物,它的栽种面积约占粮食作物面积的30%,产量占全国粮食总产量的40.4%。
磷(P)作为作物生长发育所必需的大量营养元素之一,它不仅是作物体内多种重要化合物的组成成分,比如核酸、磷脂和ATP[2],同时,它也以多种方式参与植物体内生物化学反应,比如光合作用、呼吸作用等[3],磷对作物的生长发育、新陈代谢、产量以及品质都有重要作用[4-5]。
虽然磷在农业生产活动中起着至关重要的作用,但土壤磷缺乏也制约着作物的生产[6-7]。据统计,全世界约有57亿hm2土壤处于缺磷的状态,不足以维持作物正常生长的需要[8],而我国约1.07亿hm2的耕地中有2/3严重缺磷[9]。在农业生产中,主要通过增加磷肥施用量或者改变磷肥施加方式来提高作物对磷肥的吸收[10-11]。虽然施加磷肥可以暂时解决农作物缺磷的性状,但从长远发展的角度考虑,这不是最理想的方法。因为磷矿是一种不可再生资源,过量施磷不仅会造成磷矿浪费枯竭,而且还会引起一系列的环境污染问题,同时也增加农业生产成本[12]。因此很多科研工作者都在寻找提高磷利用效率的方法[13-14]。
已有的很多研究表明,硅(Si)是植物生长和发育的有益元素[15-18]。硅可以有效缓解植物的生物胁迫,如植物病原菌和害虫[19-21],同时硅也可以改善植物在非生物胁迫下的生长发育,比如干旱、倒伏、寒冷和营养失衡等[22]。在缓解的各种非生物胁迫中,硅在磷缺乏和过量胁迫下的有益作用已经在很多植物中进行了相关研究报道。英国诺桑实验站一个长期田间试验表明,在同样不施加磷肥条件下,施用硅酸钠的试验田大麦产量更高[23]。营养液中加硅在较低磷水平下比在中等磷水平下更多地增加了水稻的地上部干重[24-25]。最新报道,在低磷的酸性土壤条件下,施硅可以增加小麦对磷的吸收[26]。硅在磷缺乏下的有益影响可能是由于通过减少锰(Mn)和铁(Fe)的吸收,改善植株体内磷的利用效率[25,27],并且增加了根系有机酸的分泌和磷转运基因的表达[26]。此外,加硅也能够改善水培高磷条件下的水稻生长,这可能是由于根系中硅的沉积,减少了磷通过质外体流和渗透向中柱鞘的转移,从而减少了磷的吸收[28-29]。最近发现,水稻地上部硅的累积下调了磷转运基因的表达,从而减少了磷的吸收[30]。尽管对于硅和磷互作的研究报道已经很多,但籼稻和粳稻对于硅响应的研究则鲜有报道。因此,本研究采用水培试验,研究了籼稻和粳稻对硅的响应规律。
1 材料与方法
1.1 试验材料及生长环境
试验所用水稻品种是从实验室中现有水稻品种随机挑选的,分别是籼稻Kasalath(7001)、Bei Khe (7021)、Vary Futsi(7040)、Deegeowoogen(7124)和粳稻日本晴(7069)、Shinsyu(7081)、八束穂(7101)(表1)。水稻种子用水浸泡,并放置于30℃黑暗培养箱中催芽2 d,然后转移到漂浮的塑料网上萌发,此塑料网置于含有 0.5 mmol/L CaCl2溶液的1.5 L塑料容器中,其上覆铝箔以避光。5 d后转移到1/2 木村B营养液中培养(pH 5.6)。营养液每2 d换1次,植物在温室(25 ~ 30℃,自然光)中培养。

表1 供试水稻品种
1.2 试验设计
所有水稻品种的幼苗在加硅(+Si)、减硅(-Si)营养液中进行处理,减硅处理不含硅,加硅处理所用硅酸的浓度为1 mmol/L。硅酸是将硅酸钾溶液通过含有阳离子交换树脂(Amberlite IR-120B, H+form)的离子交换柱收集所得[31]。每个处理均设置3个生物学重复。
1.3 测定项目及方法
1.3.1 相关元素测定 经过7 d加硅、减硅处理后,用提前放置于冷库过夜的5 mmol/L CaCl2溶液清洗水稻根系3次,然后分别收集水稻根系和地上部用于相关元素的测定。所有样品在70℃条件下烘干3 d,然后加入60% 的硝酸进行消解。样品消解液经过稀释相应倍数后用ICP-MS(Inductively coupled plasma- mass spectrometer, 7700X; Aglient Technologies)测定。
1.3.2 磷转运蛋白基因的表达分析 经过7 d加硅、减硅处理后,取水稻根系样品,在液氮中冷冻,用RNeasy Plant Mini Kit(Qiagen)提取总RNA,并按照说明书使用ReverTra Ace qPCR RT Master Mix with gDNA Remover(TOYOBO)转化成cDNA。使用SYBR Premix Ex TaqTM(Takara Bio, Inc., Japan)为荧光染料,并于 LightCycler 480 (Roche,瑞士)上进行实时荧光定量 PCR。的引物序列为CCAGAAACACTCACATGATCACC (forward)和GATGAGAGCAAACATGCTGAAAAC(reverse);的引物序列为5′-CGCTTCCGTACGAGTGG TAGT-3′ (forward)和5′-GGTTCTTTCAAATCCAGGG AAA-3′(reverse);的引物序列为5′-TGTCATA AACATGCCGTCTCG-3′ (forward)和5′-GCAGGGAA AGTTCACAAAATC-3′ (reverse);的引物序列为AACTCCACGACCTTCATCGTG(forward)和CAT CGTCATCGTCCTCGTTCTC(reverse);的引物序列为5′-CCGACGCCTATGACCTCTTCTG-3′ (forward)和 5′-ACCTGCAGCACCTTGGACATGT-3′ (reverse);的引物序列为5′-ATCCAGGAGGAG CAGGACAAG-3′ (forward)和5′-CACGATGAAGGT GGTGGAGTT-3′ (reverse)。、、和也被称为、、、[28]。所使用的内参基因为,其引物序列为5′-AGTTTGGTCGCTCTCGATTTCG-3′ (forward)和 5′-TCAACAAGTTGACCACGTCACG-3′ (reverse)。所有基因的相对表达量用ΔΔCt计算获得。
1.4 数据处理与分析
数据处理采用 Microsoft Office 2003 和 SPSS 16.0软件,所有数据测定结果均以平均值± 标准差的形式表示。数据之间的差异显著性采用Duncan’s test分析。
磷吸收量=Pt/RDW,磷利用效率=SDW/Pt,式中:Pt代表整个植株磷含量(mg),RDW代表根干重(g),SDW代表地上部干重(g)。
2 结果与分析
2.1 硅对不同水稻品种磷含量的影响
由图1可以看出,硅对水稻植株磷含量的影响主要表现在地上部,加硅处理(+Si)显著降低了籼稻和粳稻品种地上部磷含量(图1A),而其根系磷含量在加硅处理后几乎不变(图1B)。
2.2 硅对不同水稻品种磷吸收、利用效率和转移的影响
从图2可以看出,加硅处理(+Si)所有水稻品种的磷利用效率均显著性增加,磷吸收没有太大的变化,而磷从根系向地上部的转移几乎不变。
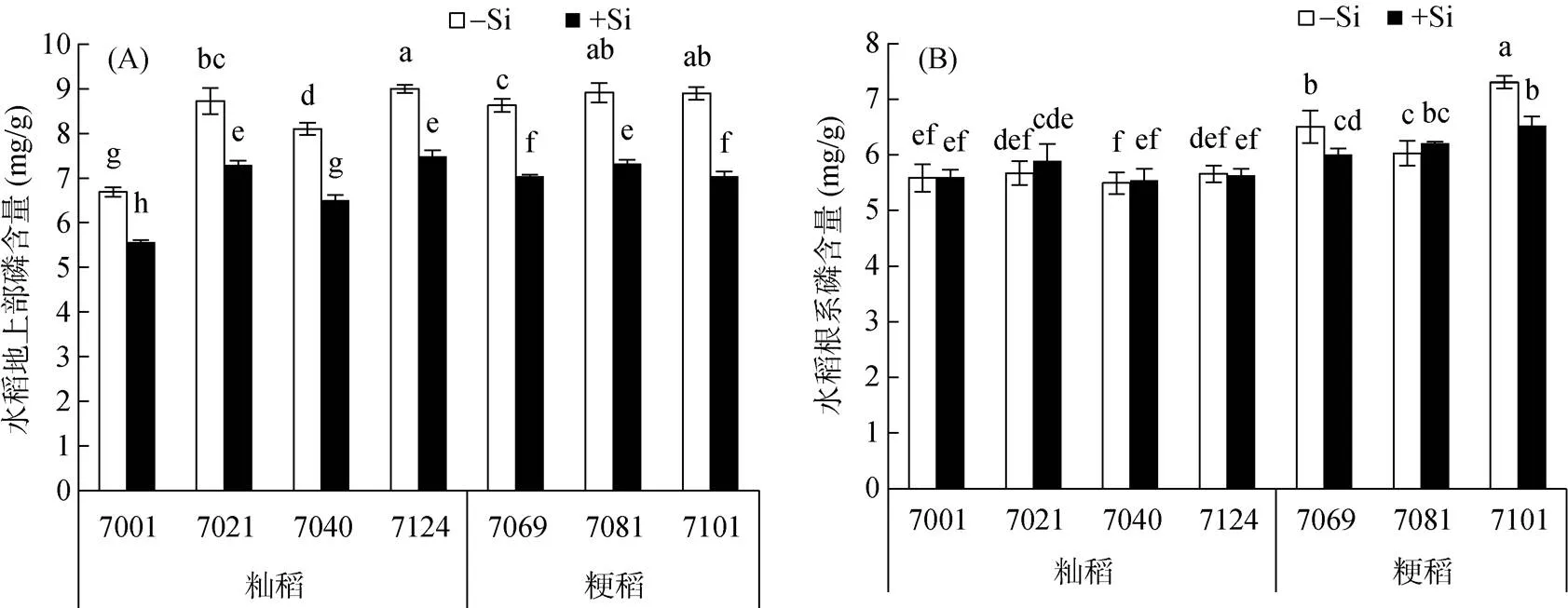
(图中不同小写字母表示不同处理及水稻品种间差异在P<0.05水平显著,下同)
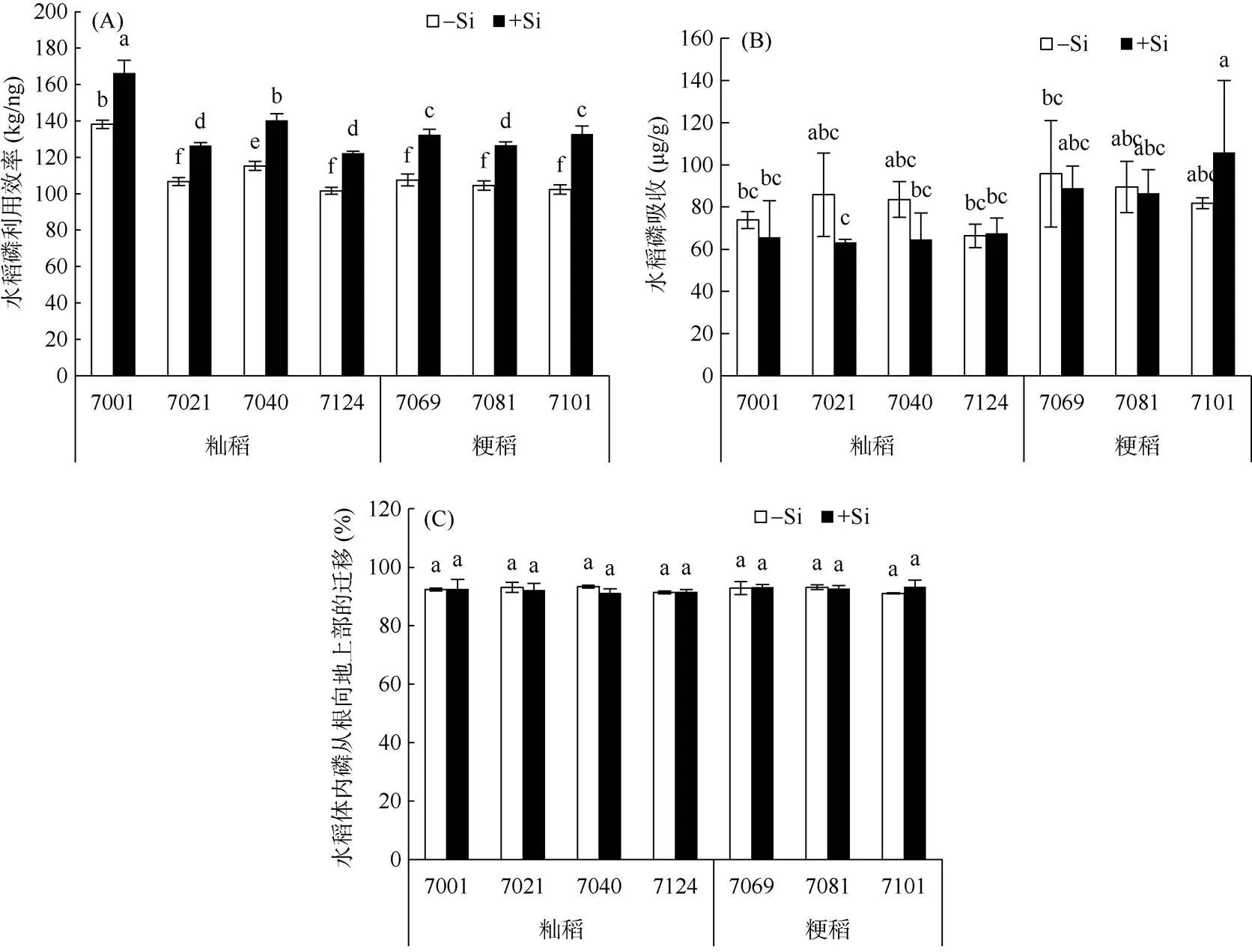
图2 硅对不同水稻品种磷利用效率(A)、吸收(B)、转移(C)的影响
2.3 硅对不同水稻品种P/Mn、P/Zn、P/Fe、P/Cu比率的影响
由图3可以看出,加硅处理(+Si)所有水稻品种地上部的P/Mn和P/Zn比率均显著性增加,P/Cu比率也有不同程度的增加,但P/Fe比率没有显著性变化。
2.4 硅对不同水稻品种磷转运相关基因表达的影响
通过对磷转运相关基因表达的分析(图4)可以看出,在粳稻品种中只有被硅下调,而在籼稻品种中没有被下调或上调;其他PT基因的表达在加硅或减硅处理前后均没有太大的变化。
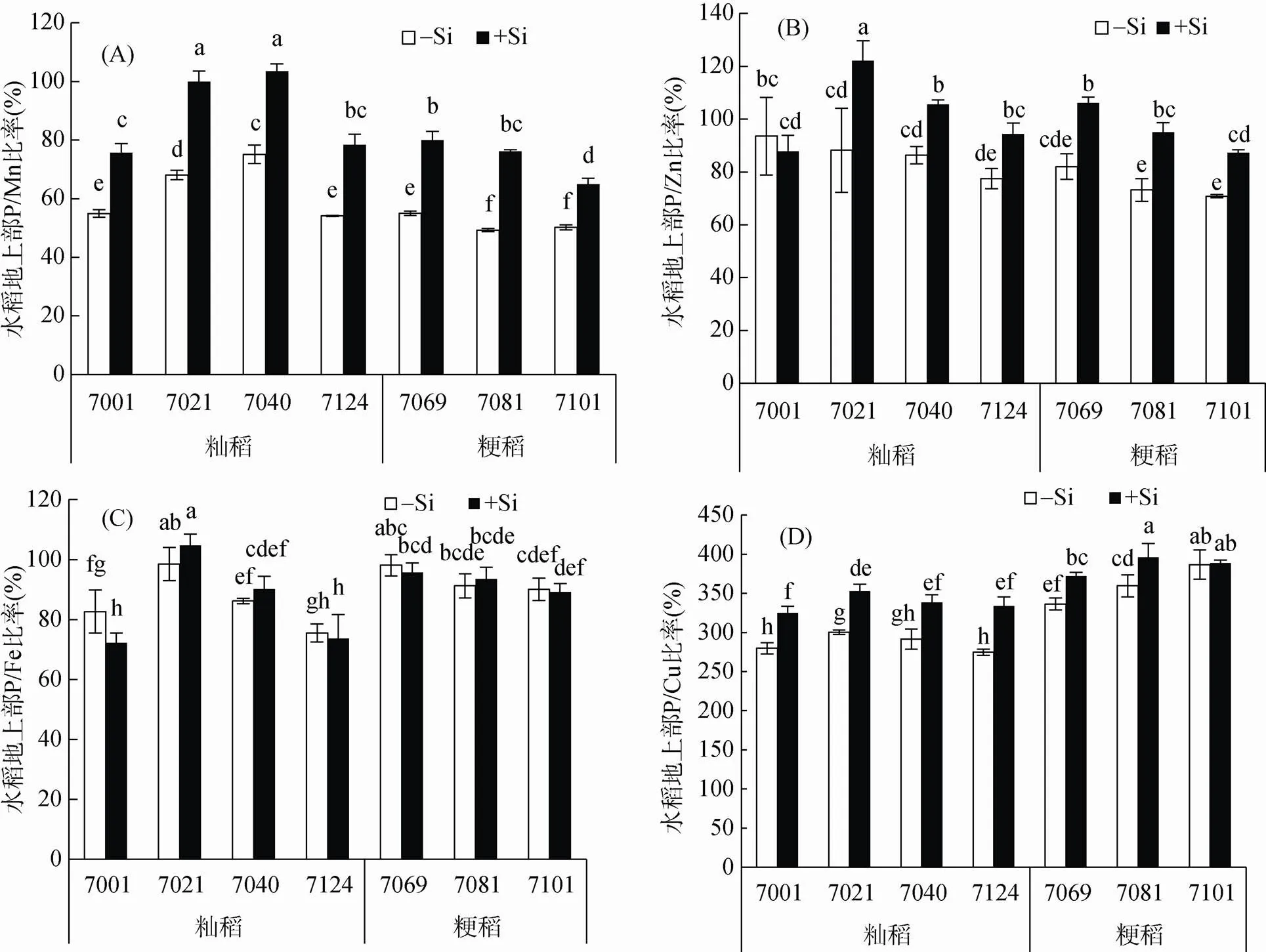
图3 硅对不同水稻品种地上部P/Mn(A)、P/Zn(B)、P/Fe(C)、P/Cu(D)比率的影响
3 讨论
前人的研究已经表明,硅能够增加水稻地上部的干物质量,并且在高磷条件下可以减少水稻中磷的积累[25],但是籼粳稻对硅的响应规律如何目前尚无研究。根据本研究结果,加硅处理显著降低了籼稻和粳稻品种的地上部磷含量,但几乎不影响根部磷含量。进一步的研究表明,硅不影响供试所有水稻品种的磷吸收及磷从根系向地上部的转移,但提高了磷的利用效率,显著增加了植物的P/Mn 和 P/Zn比率,不同程度地增加了P/Cu比率。硅的有益影响还有可能是由于通过减少Mn和Fe的吸收改善植株体内磷的利用效率[25,27]。
籼粳稻对硅的响应差异较大的重要原因可能是硅直接影响水稻根系磷转运基因的表达来影响磷吸收。本研究比较了不同水稻品种加硅、减硅条件下磷转运相关基因的表达情况。水稻基因组中的Pht1家族中有13个磷转运蛋白[33]。其中,、、和主要在水稻根系表达且负责磷的吸收和迁移[34-36]。基因表达定位于水稻主根和侧根的中柱鞘且负责磷的迁移,则表达定位于主根和侧根的表皮和皮层细胞,基因表达于水稻各个组织器官内且涉及植物体内磷的平衡[34-35]。最近有研究表明,加硅处理减少水稻磷的吸收是由于地上部硅的积累下调了基因的表达所造成的[30]。而在本试验加硅处理中,只有在粳稻中的相对表达量明显下调。此外,在低磷条件下,加硅处理能够上调小麦根系中磷转运基因的表达(和)[26]。导致这些差异的原因可能是由于试验中不同的磷浓度以及植物种类。和在小麦中被认为是高亲和力的磷转运蛋白,而在磷吸收方面则发挥着更加广泛的作用以应对土壤溶液处于不断变化的磷水平[34,37-39]。此外,当小麦种植于酸性土壤中时,它可能遭受到酸性土壤中存在的其他非生物胁迫,这也将会影响磷转运基因的表达。
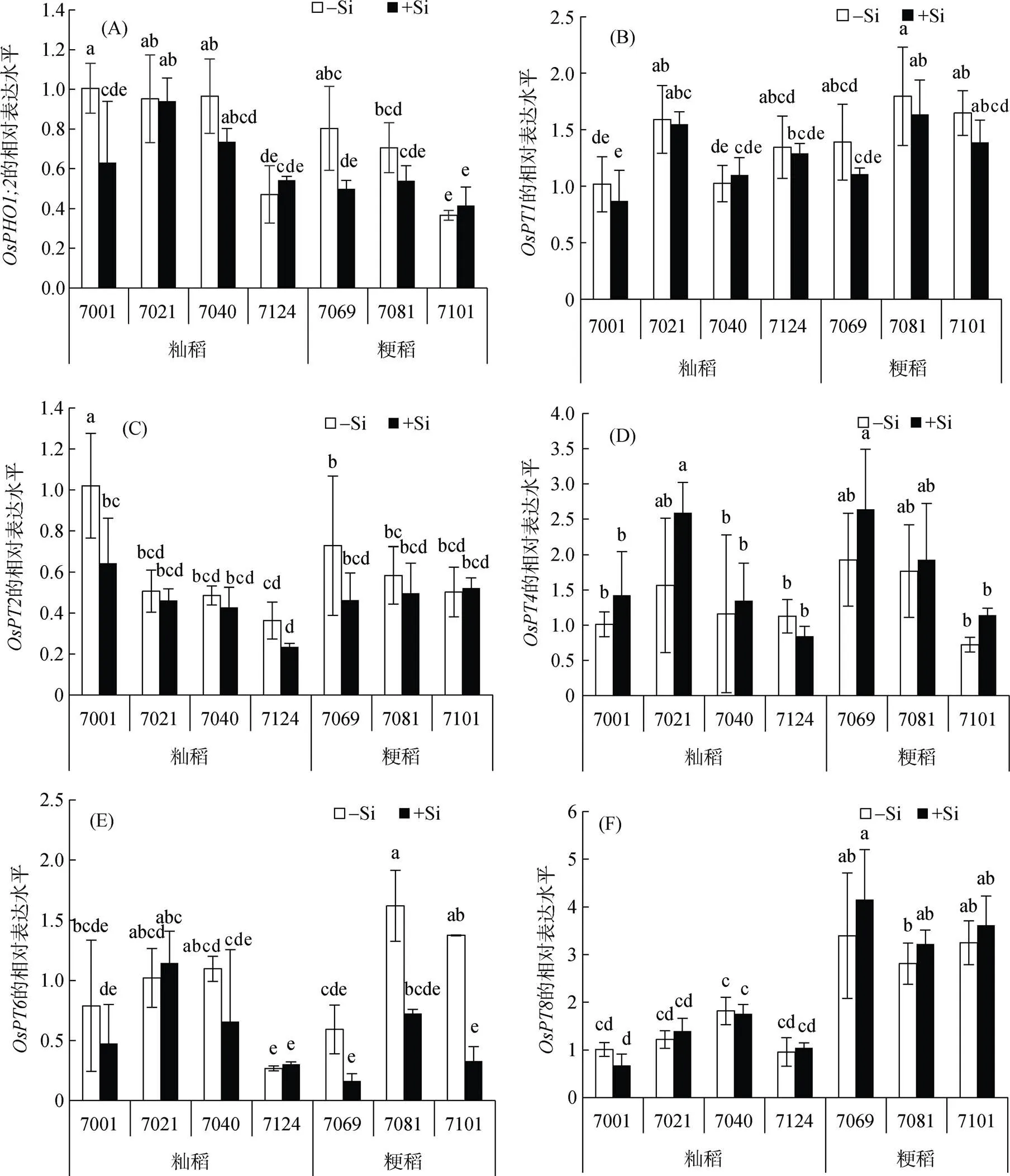
图4 硅对OsPHO1;2(A)、OsPT1 (B)、OsPT2 (C)、OsPT4(D)、OsPT6 (E) and OsPT8 (F)基因表达的影响
4 结论
加硅处理降低了水稻植株地上部的磷含量,但根系磷含量不受影响;加硅处理不影响磷从水稻根系向地上部的转移,也不影响磷的吸收,但增加了磷的利用效率。磷转运相关基因的表达分析结果显示,只有在粳稻中的相对表达量明显被硅下调,而在籼稻品种中没有变化。其他PT基因的表达不受硅的影响。磷利用率的提高可能归因于较高的P/Mn和P/Zn比率,加硅处理可能减少了Mn、Zn的吸收,从而导致植物中较高的有效磷。
[1] Nagaraju J, Kathirvel M, Kumar R R, et al. Genetic analysis of traditional and evolved Basmati and non-Basmati rice varieties by using fluorescence-based ISSR-PCR and SSR markers[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(9): 5836–5841.
[2] Plaxton W C, Carswell M C. Metabolic aspects of the phosphate starvation response in plants[M]//Lerner H R. Plant responses to environmental stresses: From phytohormones to genome reorganization. New York, USA: Dekker, 1999, 349–372.
[3] Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use: Critical adaptations by plants for securing a nonrenewable resource[J]. New Phytologist, 2003, 157(3): 423–447.
[4] Ticconi C A, Abel S. Short on phosphate: plant surveillance and countermeasures[J]. Trends in Plant Science, 2004, 9(11): 548–555.
[5] 王毅. 植物耐低磷胁迫遗传学研究策略[J]. 热带农业科学, 2004, 24(2): 34–41.
[6] Fairhust T, Lefroy R, Mutert E, et al. The importance, distribution and causes of phosphorus deficiency as a constraint to crop production in the tropics[R]. Agroforestry Forum, 1999, 9: 2–8.
[7] Hinsinger P. Bioavailability of soil inorganic P in the rhizosphere as affected by root-induced chemical changes: A review[J]. Plant and Soil, 2001, 237(2): 173–195.
[8] Batjes N H. A world dataset of derived soil properties by FAO-UNESCO soil unit for global modelling[J]. Soil Use and Management, 1997, 13(1): 9–16.
[9] 李继云, 李振声. 有效利用土壤营养元素的作物育种新技术研究[J]. 中国科学(B辑), 1995, 25(1): 41–48.
[10] 江尚焘, 王火焰, 周健民, 等. 磷肥施用对水稻生长和磷素吸收的影响[J]. 土壤, 2016, 48(6): 1085–1091.
[11] 王火焰, 周健民. 根区施肥——提高肥料养分利用率和减少面源污染的关键和必需措施[J]. 土壤, 2013, 45(5): 785–790.
[12] 张浩, 张凤文, 和忠, 等. 水稻耐低磷研究进展[J]. 云南农业大学学报, 2009, 24(5): 754–758.
[13] 宋春丽, 樊剑波, 何园球, 等. 不同母质发育的红壤性水稻土磷素吸附特性及其影响因素的研究[J]. 土壤学报, 2012, 49(3): 607–611.
[14] 王艳玲, 章永辉, 何园球. 红壤基质组分对磷吸持指数的影响[J]. 土壤学报, 2012, 49(3): 552–559.
[15] Ma J F. Role of silicon in enhancing the resistance of plants to biotic and abiotic stresses[J]. Soil Science and Plant Nutrition, 2004, 50(1): 11–18.
[16] Liang Y C, Sun W C, Zhu Y G, et al. Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants: A review[J]. Environmental Pollution, 2007, 147(2): 422–428.
[17] Ma J F, Yamaji N. A cooperative system of silicon transport in plants[J]. Trends in Plant Science, 2015, 20(7): 435–442.
[18] Pontigo S, Ribera A, Gianfreda L, et al. Silicon in vascular plants: uptake, transport and its influence on mineral stress under acidic conditions[J]. Planta, 2015, 242(1): 23–37.
[19] Rodrigues F Á, McNally D J, Datnoff L E, et al. Silicon enhances the accumulation of diterpenoid phytoalexins in rice: A Potential Mechanism for Blast Resistance[J]. Phytopathology, 2004, 94(2): 177–183.
[20] Datnoff L E, Rodrigues F Á. The role of silicon in suppressing rice diseases[J]. APSnet Feature, 1997.
[21] Fauteux F, Rémus-Borel W, Menzies J G, et al. Silicon and plant disease resistance against pathogenic fungi[J]. FEMS Microbiology Letters, 2005, 249(1): 1–6.
[22] Ma J F, Takahashi E. Soil, Fertilizer, and Plant Silicon Research in Japan[M]. Amsterdam: Elsevier Science, 2002.
[23] Fisher R A. A preliminary note on the effect of sodium silicate in increasing the yield of barley[J]. The Journal of Agricultural Science, 1929, 19(1): 132–139.
[24] Okuda A, Takahashi E. Studies on the physiological role of silicon in crop plant (part 7): Effect of silicon supply on the growth of rice plant on various phosphorus levels[M]. Japanese Society of Soil Science and Plant Nutrition, 1962, 33: 65–69.
[25] Ma J F, Takahashi E. Effect of silicon on the growth and phosphorus uptake of rice[J]. Plant and Soil, 1990, 126(1): 115–119.
[26] Kostic L, Nikolic N, Bosnic D, et al. Silicon increases phosphorus (P) uptake by wheat under low P acid soil conditions[J]. Plant and Soil, 2017, 419(1/2): 447–455.
[27] Ma J F, Takahashi E. The effect of silicic acid on rice in a P deficient soil[J]. Plant and Soil, 1990, 126(1): 121–125.
[28] Ma J F, Takahashi E. Effect of silicic acid on phosphorus uptake by rice plant[J]. Soil Science and Plant Nutrition, 1989, 35(2): 227–234.
[29] Gong H J, Randall D P, Flowers T J. Silicon deposition in the root reduces sodium uptake in rice (L.) seedlings by reducing bypass flow[J]. Plant Cell and Environment, 2006, 29(10):1970–1979.
[30] Hu A Y, Che J, Shao J F, et al. Silicon accumulated in the shoots results in down-regulation of phosphorus transporter gene expression and decrease of phosphorus uptake in rice[J]. Plant and Soil, 2018, 423(1/2): 317-325.
[31] Ma J F, Tamai K, Ichii M, et al. A rice mutant defective in Si uptake [J]. Plant Physiology, 2002, 130(4): 2111–2117.
[32] Nussaume L, Kanno S, Javot H, et al. Phosphate import in plants: Focus on the PHT1 transporters[J]. Frontiers in Plant Science, 2011, 2: 83.
[33] Paszkowski U, Kroken S, Roux C, et al. Rice phosphate transporters include an evolutionarily divergent gene specifically activated in arbuscular mycorrhizal symbiosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(20): 13324–13329.
[34] Ai P H, Sun S B, Zhao J N, et al. Two rice phosphate transporters,and, have different functions and kinetic properties in uptake and translocation[J]. The Plant Journal, 2009, 57(5): 798–809.
[35] Jia H F, Ren H Y, Gu M, et al. The phosphate transporter gene;involved in phosphate homeostasis in rice[J]. Plant Physiology, 2011, 156(3): 1164–1175.
[36] Sun S B, Gu M, Cao Y, et al. A constitutive expressed phosphate transporter, OsPht1;1, modulates phosphate uptake and translocation in phosphate-replete rice[J]. Plant Physiology, 2012, 159(4): 1571–1581.
[37] Tittarelli A, Milla L, Vargas F, et al. Silva H. Isolation and comparative analysis of the wheat TaPT2 promoter: identification in silico of new putative regulatory motifs conserved between monocots and dicots[J]. Journal of Experimental Botany, 2007, 58(10): 2573–2582.
[38] Miao J, Sun J H, Liu D C, et al. Characterization of the promoter of phosphate transporter TaPHT1.2 differentially expressed in wheat varieties[J]. Journal of Genetics and Genomics, 2009, 36(8): 455–466.
[39] Teng W, Zhao Y Y, Zhao X Q, et al. Genome-wide identification, characterization, and expression analysis of PHT1 phosphate transporters in wheat[J]. Frontiers in Plant Science, 2017, 8:543.
Effects of Silicon on Phosphorus Accumulation in Different Rice Varieties
WANG Xiaojun1,2, HU Anyong1,2, CHE Jing3, SHEN Renfang1, MA Jianfeng1,3*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China; 3 Institute of Plant Science and Resources, Okayama University, Gangshan 710-0046, Japan)
Silicon (Si) is able to improve phosphorus (P) nutrition, but the underlying mechanism is still poorly understood. The aim of this study is to investigate the effects of silicon on phosphorus accumulation in different rice varieties including four indica and three japonica accessions in hydroponic solution. Addition of silicon significantly decreased shoot P concentration in both indica and japonica rice varieties, but hardly affected the root P concentration. Si did not affect P uptake, root-to-shoot translocation of P in all rice varieties, but improved P-use efficiency and increased ratios of P/Mn and P/Zn in plant. Gene expression analysis of P transporter (PT) genes showed that onlywas down-regulated by Si in japonica varieties, but not in indica varieties. The expression of other PT genes was unaffected by Si. Taken together, Si has different effects on P accumulation in different rice varieties and improved P-use efficiency is probably attributed to higher P/Mn and P/Zn ratios, resulting in higher P availability in plants.
Japonica rice; Indica rice; Silicon; Phosphorus transporter; Gene expression; Rice
Q819
A
10.13758/j.cnki.tr.2020.01.008
王晓君, 胡安永, 车景, 等. 硅对籼稻和粳稻品种磷积累的影响. 土壤, 2020, 52(1): 54–60.
国家重点基础研究发展计划(973计划)项目(2014CB441000)和中国科学院战略性先导科技专项 (XDB15030302;XDB15030202)资助。
王晓君(1990—),女,山东烟台人,硕士研究生,研究方向为磷高效水稻的筛选和机制。E-mail:wangxj@issas.ac.cn

