地西他滨对小鼠肾缺血再灌注损伤作用的实验研究*
赵艳龙,田普训,程小红,丁晨光,田 耘,于小勇,史 健,徐 薇,张 鹏,宋阿苗
1.陕西省中医医院肾病医院血液透析室(西安710003);2.西安交通大学第一附属医院肾脏病医院肾移植科(西安710061);3.陕西省中医医院肾病医院肾病科(西安710003)
肾缺血再灌注损伤 (Ischemia reperfusion injury,IRI)与急性肾损伤、慢性肾脏病及肾纤维化、移植肾急慢性排斥、移植肾功能延迟恢复等疾病的发病密切相关,有较高的发病率和病死率,目前仍缺乏有效的干预措施。DNA甲基化是一种表观修饰方式,参与基因表达调整,与IgA肾病、慢性肾脏病的纤维化进展、糖尿病肾病等密切相关[1-4]。抑制DNA甲基化可能减低或阻止IRI导致的急性肾损伤(Acute kidney injury,AKI)向慢性肾脏病(Chronic kidney disease,CKD)进展的纤维化过程,但抑制DNA甲基化对早期肾IRI的影响未见报道。DNA甲基化参与氧化应激、炎症反应等病理过程[5-7],而氧化应激、炎症反应是肾IRI发病的重要病因,因此,我们推测干预DNA甲基化可能成为防治肾IRI的新策略或新方法。
地西他滨(Decitabine,DCA),即5-脱氧杂氮胞苷(5-aza-2deoxycytidine),是临床上治疗骨髓增生异常综合征、慢性粒细胞白血病和急性髓性白血病等疾病的常用药物[8],属于DNA甲基转移酶抑制剂(DNA methyltransferases,Dnmts),主要作用于增殖期(S期)细胞,使高甲基化的抑癌基因恢复正常的去甲基状态,从而重新激活这些抑癌基因,发挥抑癌功能,恢复细胞正常终末分化[9-10]、肺炎[11-12]。有报道 DCA 可以增强脑对IRI的抵抗[13],因此,我们将DCA用于肾IRI,探索其治疗肾IRI的可能。
材料和方法
1 实验动物 雄性C57BL/6小鼠(8~10周,20~25g)购买并饲养于西安交通大学实验动物中心SPF动物房,温度20~26℃;相对湿度50%~80%,白天、夜晚时间均为12h,自由接触水和饲料。
2 主要试剂 胎牛血清(Gibco公司);DMEM/F12培养基(Hyclone公司);地西他滨DCA(Pharmachemie B.V.);苏木素伊红(HE)染色试剂盒(博士德公司);细胞凋亡检测试剂盒(南京凯基生物);羊抗鼠PCNA一抗(abcam公司);大鼠抗小鼠Ly6B一抗(AbD Serotec);调整性 T淋巴细胞(Treg)检测试剂盒(ebioscience公司);流式抗体:PE标记抗鼠F4/80、PerCP标记抗鼠CD206(ebioscience公司);Tunel细胞凋亡检测试剂盒(Roche公司);胶原酶Ⅳ、DNA酶Ⅰ(Worthington公司);小鼠淋巴细胞分离液(Cedarlane公司)。
3 体外HK-2培养及MTT检测 用含100ml/L胎牛血清的完全培养基悬浮HK-2细胞,接种到培养皿中,轻轻吹打混匀,37℃50ml/L CO2饱和湿度条件下培养。取处于对数生长期、生长状态良好的HK-2细胞,以2.0×103cells/孔接种于96孔板,每孔100μl细胞悬液,同时设空白组,37℃培养过夜,每孔再加入10μl MTT,37℃孵育4h,酶标仪测定各孔吸光值A568,判断不同剂量DCA对肾小管上皮细胞增殖的影响。
4 HK-2凋亡检测及缺氧-复氧模型建立 HK-2细胞以每孔5×105个接种于细胞培养6孔板,37℃、50ml/L CO2培养箱中培养过夜,更换含不同DCA浓度的培养基处理72h,流式细胞仪检测不同浓度DCA对HK-2凋亡的影响;上述条件培养的细胞再予缺氧培养(20ml/L O2,930ml/L N2,50ml/L CO2)24h及复氧培养6h后,建立缺氧-复氧(A/R)或A/R+DCA模型。
5 小鼠肾IRI建立及DCA干预 20g/L水合氯醛按小鼠体重(0.02ml/g)腹腔注射麻醉,肋下脊柱两侧备皮1.5cm2,切口采用脊柱旁0.5cm、肋下0.5cm、平行脊柱的双侧切口,长1cm。先行左侧切口,提取肾脏,钝性分离肾蒂,暴露血管,无损伤血管夹夹闭左侧肾动脉30min,使肾脏缺血。同法暴露右肾及血管,0号线结扎血管,切除右肾,间断缝合皮下及皮肤。左肾血管夹闭到30min后,去掉血管夹,使肾脏再灌注,见肾脏变红后回纳腹腔,缝合(IRI组)。假手术组(Sham)除夹闭血管步骤外,执行相同的手术过程。DCA组为建立IRI手术前4d应用DCA[溶于PBS中,0.1mol/L,按 DCA0.5mg/(kg·d)腹腔注射]预处理C57BL/6小鼠,行肾IRI,术后DCA继续干预2d。
6 样本收集及检测 每组6~8只小鼠,肾IRI后2d处死小鼠,抗凝全血400g,室温,离心10min,取上层血清,全自动生化分析仪测定肾功血肌酐(Scr)、尿素氮(BUN)。1/3肾组织40g/L多聚甲醛固定后石蜡包埋。4μm切片用于 HE染色和凋亡细胞(Tunel染色)、增殖细胞核抗原(PCNA)的免疫荧光染色及嗜中性粒细胞(Ly6B)的免疫组化染色。其余肾组织胶原酶Ⅳ消化后,淋巴细胞分离液分离单个核细胞,流式细胞仪检测Treg、M2型巨噬细胞表达。
7 病理观察及判定 每只小鼠4张切片,每张切片随机于400×视野下选择10个非重复视野。HE染色结果的病理学评分:根据皮髓交界以及外髓质部位的损伤肾小管细胞坏死、小管腔膨胀、微绒毛脱落及管型形成等病理改变的比例进行小管损伤程度评分:0分,未见;1分,<10%;2分,10%~25%;3分,25%~50%;4分,50%~75%;5分,75%~100%。免疫荧光染色:计数每个400×视野下阳性的细胞数。
8 统计学方法 选用 Graph Pad Prism 6统计学软件分析,数据以均数±标准差(±s)表示。多个样本均数比较采用方差分析,三个样本间两两比较采用Newman-keuls法(q检验),多个样本间两两比较涉及重复测量时用Bonferroni校正。P<0.05认为差异具有统计学意义。
结 果
1 低剂量的DCA体外抑制HK-2细胞凋亡 不同剂量DCA干预体外培养的人肾小管上皮细胞系HK-2细胞,发现随着剂量增加HK-2细胞增殖明显受到抑制,其凋亡也逐步增加(P<0.05或0.01)(图1A、B、C)。低剂量的DCA对 A/R(模拟体内IRI过程)诱导的HK-2细胞凋亡具有明显的抑制作用(F=338.30,P<0.01)(图1D、E)。见表1、2。
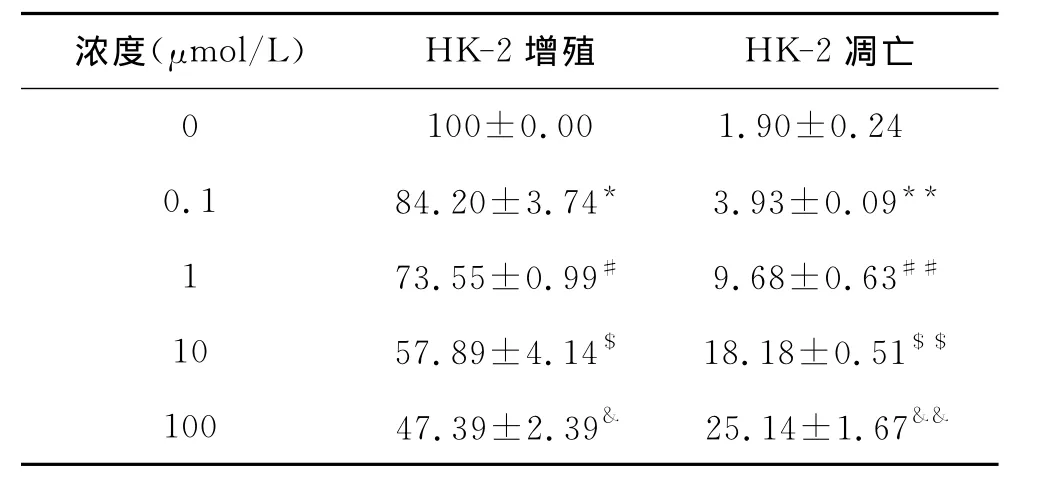
表1 不同浓度DCA对HK-2细胞增殖及凋亡影响
2 DCA减轻肾IRI 与假手术组比较(sham组),模型组(IRI组)SCr、BUN 明显升高(P<0.01);而DCA干预组肾功较IRI组明显下降(P<0.01)(图2A、B)。病理学检查亦提示DCA的肾脏保护作用,IRI导致严重的肾小管上皮细胞的凋亡、坏死、扩张及刷状缘脱落,但DCA组上皮细胞损伤程度轻于IRI组(P<0.05)(图2C、D)。见表3。

表2 DCA对缺氧-复氧(A/R)诱导的HK-2细胞凋亡影响

表3 各组肾功能及肾小管损伤评分
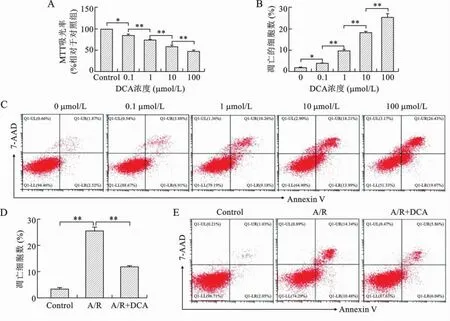
图1 DCA对HK-2细胞增殖及凋亡的影响
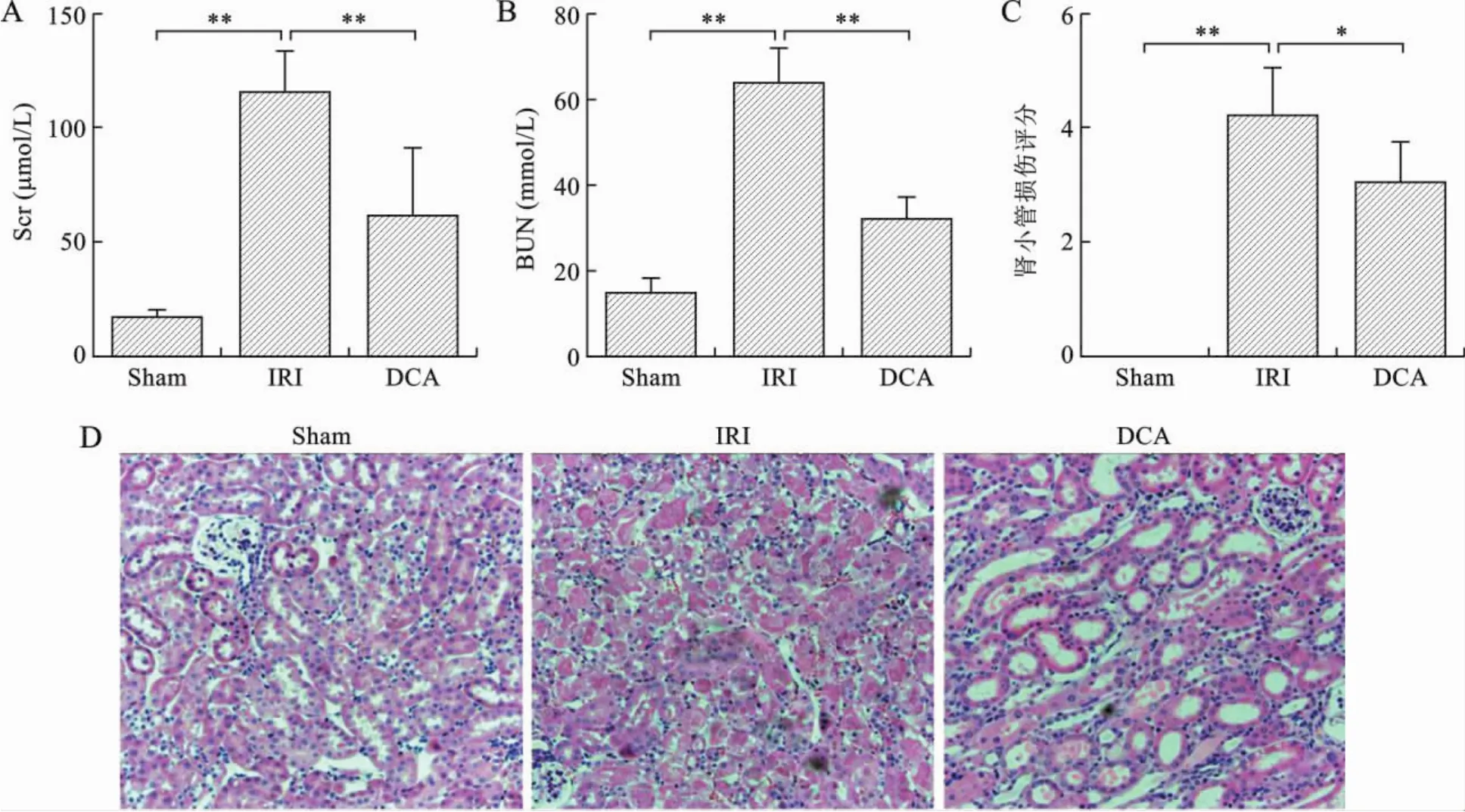
图2 DCA改善肾IRI小鼠肾功及病理损伤
3 DCA减低肾IRI小鼠肾小管上皮细胞凋亡体内研究结果发现,与IRI组比较,DCA同样减低了肾小管上皮细胞凋亡(P<0.01)(图3A、B)。应用PCNA为标记反映肾小管细胞的增殖状态,发现与IRI组比较,DCA并未促进肾小管上皮细胞增殖(P=0.15)(图3C、D)。见表4。
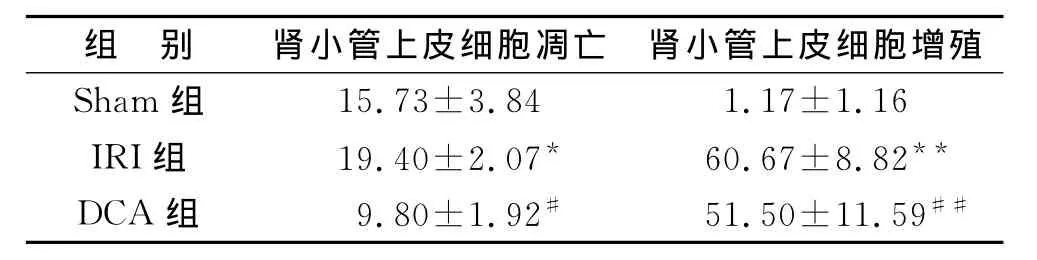
表4 各组肾小管上皮细胞凋亡及增殖情况
4 DCA减低肾IRI小鼠肾组织嗜中性粒细胞浸润,增加Treg、M2型巨噬细胞表达 各组肾组织嗜中性粒细胞染色提示,DCA减低IRI肾组织嗜中性粒细胞浸润(P<0.05或0.01)(图4A、B)。同时发现,肾IRI环境下,DCA可以促进肾组织Treg扩增及M2型巨噬细胞表达(P<0.01)(图4C、D、E、F)。见表5。

表5 各组肾组织中嗜性粒细胞、Treg及M2型巨噬细胞表达
讨 论
DNA甲基化是基因表达的重要调控机制,与IgA肾病、慢性肾脏病的纤维化进展、糖尿病肾病等密切相关。有研究报道,肾IRI过程中亦有DNA甲基化参与[14-15]。地西他滨(Decitabine,DCA)为 DNA 甲基转移酶抑制剂,使高甲基化的抑癌基因恢复正常的去甲基状态,从而重新激活这些抑癌基因,发挥抑癌功能,恢复细胞的正常分化。DCA除临床上用于肿瘤治疗外,基础研究提示DNA甲基化转移酶抑制剂能影响炎症反应过 程[5-7,10-12,16]。而 细胞凋亡、再生及炎症反应是肾IRI的重要特征。因此,DCA可能对肾IRI过程存在影响,但未见文献报道。本研究把抗肿瘤药物DCA应用于肾IRI过程,旨在探索其对肾IRI的影响,为开辟新的治疗策略提供依据。
DCA掺入DNA,抑制DNA甲基转移酶,引起DNA低甲基化和细胞分化或凋亡来发挥抗肿瘤作用。我们实验中,DCA针对肾小管上皮细胞的体外研究提示随着剂量的增加肾小管上皮细胞的增殖明显受到抑制,且随剂量增加其诱导肾小管上皮细胞凋亡作用也逐步增加。但是,能导致肾小管上皮细胞HK-2凋亡的DCA对缺氧-复氧诱导的HK-2细胞凋亡反而起到保护作用。这提示DCA可能对肾IRI存在保护作用。
DCA具有骨髓抑制(导致中性粒细胞、血小板减低)及致房颤,咳嗽、腹泻、便秘等副作用[9]。我们实验过程中,所有小鼠均未发现明显的腹泻、便秘、出血等副作用,结合临床上低剂量DCA应用剂量为10~30mg/m2、正常剂量为40~50mg/m2及相关文献在小鼠上的应用[8,10],我们给肾IRI小鼠腹腔注射剂量为0.5mg/kg,属于低剂量应用。在低剂量DCA干预肾IRI小鼠模型的研究中,我们观察到小鼠肾功较模型组明显改善,同时组织学检查也发现低剂量的DCA减低了IRI小鼠肾小管上皮细胞的刷状缘脱落、凋亡、坏死,结合体外研究结果,进一步确定DCA对肾IRI具有保护作用。
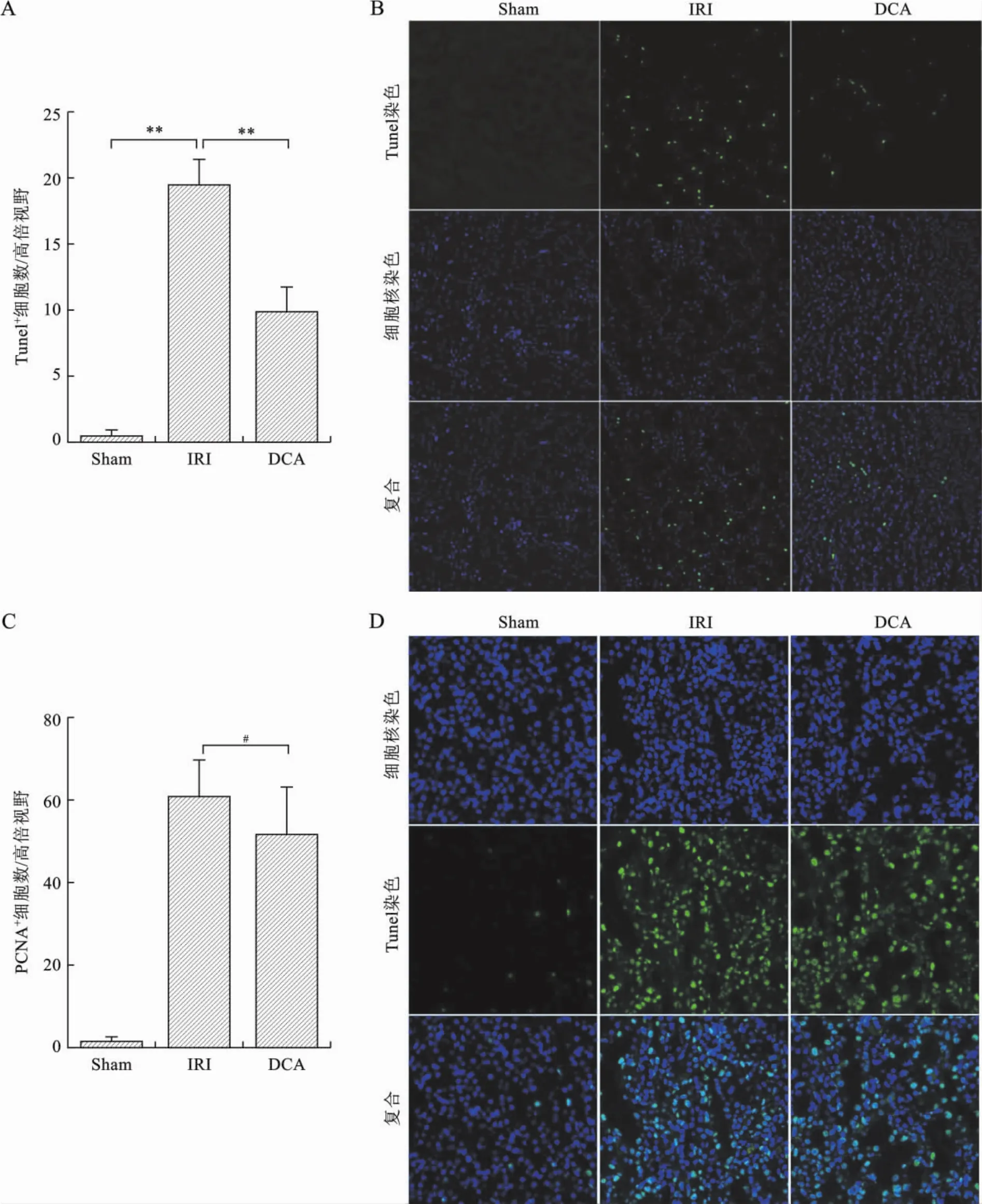
图3 DCA减低肾IRI小鼠肾小管细胞凋亡
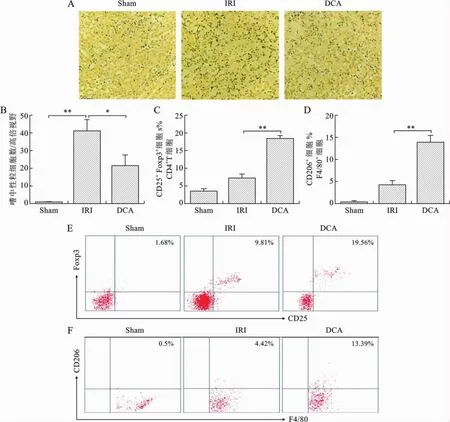
图4 DCA减低肾IRI小鼠肾组织嗜中性粒细胞浸润,增加Treg、M2型巨噬细胞表达
肾脏IRI因为氧化应激、内质网功能障碍、钙超载等导致组织、细胞代谢障碍、结构破坏、细胞凋亡、坏死等,而其恢复过程表现为细胞的增殖,组织损伤修复。因此,我们体内探讨了DCA对肾小管上皮细胞的凋亡与增殖影响。细胞凋亡、坏死,染色体DNA断裂,产生3’-OH末端,应用Tunel标记3’-OH端,标示细胞凋亡、坏死,观察到低剂量DCA干预的IRI模型的肾小管上皮细胞凋亡明显减少(与体外研究一致)。但对细胞增殖未发现统计学差异,可能与IRI后2d的检测评估时间距发病时间较短有关,也可能由于DCA的保护作用,DCA组本来凋亡的细胞少有关。而DCA减低肾小管上皮细胞凋亡的机制是什么呢?既可能与DCA通过调整基因甲基化、调整了小管细胞中某种基因、蛋白表达有关,也可能有其他机制,如控制炎症反应。已有文献报道,小管细胞表达的KLF4与DNA甲基化明显相关[17-18],Klotho的甲基化也与肾IRI明显相关[19-20],DCA可能通过调整上述基因表达,而达到保护肾IRI作用。本研究更关注炎症反应状态。免疫炎症反应既是肾IRI后的重要临床表现,也是导致肾组织损伤的重要原因。天然免疫反应与适应性免疫反应相互影响,促进免疫炎症反应不断增强,最终导致组织损伤进一步加重,因此抑制炎细胞聚集及细胞因子释放可以减轻肾IRI损伤。本研究除观察到小管细胞的变化外,也发现DCA组整体炎细胞浸润较IRI组明显减少,接下来的嗜中性粒细胞染色同样观察到DCA减低了肾组织嗜中性粒细胞浸润。表明DCA可以减低肾组织炎性反应。
多篇文献报道DCA可以促进Treg表达而抑制炎症反应[5,16,21]。我们研究证明了在IRI条件 下,DCA确实抑制了肾组织炎症细胞表达,同时也促进了肾组织Treg表达。所以我们推测DCA可能通过促进Treg表达而抑制炎症反应,减低小管细胞凋亡,保护肾功能。巨噬细胞在IRI发病及组织修复过程中也发挥重要作用[22-23]。如M1型巨噬细胞加重肾脏损伤,清除M1型巨噬细胞或抑制M1型巨噬细胞可以保护肾IRI[24];而M2型巨噬细胞可通过抑制细胞凋亡、促进细胞增殖发挥保护肾IRI作用[25],也可通过调整免疫炎症反应保护肾脏IRI。有文献报道DCA也可能促进巨噬细胞向M2型转移,因此,我们实验中同样检测了肾IRI后2d肾组织M2型巨噬细胞表达情况,发现DCA同样促进了IRI后肾组织巨噬细胞的表型转移,这也可能与DCA的肾脏保护作用相关。
综上所述,DCA对肾脏IRI确实存在保护作用,其机制可能与抑制肾小管上皮细胞凋亡、抑制炎症反应有关。虽然我们研究没有对DCA对肾IRI的远期疗效做进一步评价,DCA对肾IRI的保护机制探索也只停留在抑制细胞凋亡、抑制综合免疫炎症反应方面,没有做进一步深入研究。但是我们证明了其对肾IRI损伤的保护作用,可能成为干预肾IRI的新方法,接下来我们将对其远期效果、机制及用药剂量、持续时间方面进行深入探索。

