基于Tb3+→Eu3+能量传递的荧光粉多色发光性能的研究
毛旖旎 胡珊珊
(西南大学 化学化工学院,重庆 北碚 400715)
0 引言
众所周知,无机稀土发光材料在材料界占据了十分重要的地位,它们凭借其丰富的发光颜色已经广泛应用于照明、显示以及检测等众多生活领域[1],而其丰富的发光颜色又依赖于稀土元素特殊的电子构型赋予其对应离子的丰富的4f-5d能级跃迁[2],也正因为如此,通过稀土离子掺杂来制备无机发光材料的研究受到众多研究者的密切关注[3],这直接而有力地促进了这个领域的发展.
近年来,研究者们始终致力于寻找可以代替蓝色lnGaN芯片与YAG:Ce3+黄色荧光粉结合来制造白光LED的方法,于是RGB(红绿蓝)荧光粉和紫外(UV)芯片的组合受到了极大的关注[4],单组分多色荧光粉也因此博得了研究者的眼球[5],而单组分多色荧光粉制备方法往往是向单一基质中共掺敏化剂与活化剂[6].Tb3+和Eu3+就是一个完美的敏化剂和活化剂的组合,前者因5D4→7FJ(J=6,5,4,3)跃迁常作为绿光激活剂,后者因5D0→7FJ(J=2,1)跃迁常作为红光激活剂,更巧的是Tb3+恰好又能充当Eu3+的敏化剂[7],且两者共掺时通常能通过能量传递实现光色的调控,所以Tb3+和Eu3+共掺杂的荧光粉引发了研究者的极大兴趣,近年来被广泛研究[8].Ba3Sc2F12作为一种良好的基质材料,向其中共掺Tb3+和Eu3+制备多色荧光粉还未有报道.
本文采用轻便的水热法合成了BSF:Ln3+( Ln=Tb,Eu,Tb/Eu )荧光粉并探究了其下转换发光性质,同时首次探讨了该基质中Tb3+→Eu3+的能量传递行为及其机制,最后研究了能量传递过程中伴随着Eu3+离子掺杂浓度的改变而出现的多色发光现象.
1 实验部分
1.1 实验试剂
纯度为99.99%的稀土氧化物:氧化钪(Sc2O3),氧化铽(Tb4O7)和氧化铕(Eu2O3)购买于赣州广力高新技术材料有限公司(中国);分析纯的氟化铵(NH4F)和氯化钡(BaCl2·2H2O)购买于阿拉丁化学试剂公司;分析纯的硝酸(HNO3)和无水乙醇(C2H5OH)购买于重庆市钛新化工有限公司;去离子水.所有的化学试剂均未经进一步纯化而直接用于实验制备过程.
1.2 制备过程
BSF:Ln3+( Ln=Tb,Eu,Tb/Eu )荧光粉的制备过程分为两个阶段,即制备稀土硝酸盐溶液和合成BSF:Ln3+荧光粉.首先,称取一定量的稀土氧化物白色粉末加入250 mL大烧杯中并置于磁力加热搅拌器上,加入适量的浓硝酸后盖上表面皿,在加热条件下持续搅拌至白色粉末全部溶于浓硝酸中得到无色透明的溶液,接着继续在加热条件下搅拌以驱除过量的硝酸,赶酸过程结束即制得相应的硝酸盐溶液,待用.
以BSF:10%Tb3+荧光粉的合成为例.取35 mL去离子水于100 mL干燥洁净的小烧杯中,依次加入配制好的Sc(NO3)3(1 mol/L,900 ·L),Tb(NO3)3(1 mol/L,100 ·L)溶液,搅拌10 min后将预先称好的BaCl2.2H2O(0.3682 g)固体粉末加入混合溶液中,继续搅拌直到粉末完全溶解(可以加热促使其溶解),接下来加入1500 ·L、4 mol/L的NH4F溶液,再次搅拌30 min使得小烧杯中的混合液充分混匀.将上述混合液转移至套有不锈钢质钢壳的50 mL反应釜(聚四氟乙烯材质,耐高温高压)中,并于200 ℃下反应24 h.反应结束后让其自然冷却至室温,然后通过离心洗涤得到产品,最后将产品烘干(60 ℃,12 h)即制得BSF:10%Tb3+荧光粉.其它荧光粉的合成过程与此相似,只需根据实际需要改变试剂的比例即可.
1.3 性能表征
使用X射线衍射仪(MSALXD3,北京普析通用仪器)对制得的系列荧光粉样品进行物相分析;使用荧光光谱仪(Hitachi,F-7000,日本日立公司)对荧光粉的光学性能进行探究.以上表征于室温下完成.
2 结果与讨论
2.1 物相
图1展示的是分别向Ba3Sc2F12基质中单掺Tb3+,单掺Eu3+以及共掺Tb3+,Eu3+时合成的样品的XRD衍射图谱,每个样品对应的SEM图片以插图的方式呈现在图中,很显然的是,在三种掺杂条件下制备的样品的形貌有较大差异,但其衍射峰都归属于四方相的Ba3Sc2F12(JCPDS 49-1506),其晶胞参数为a=b=9.482 Å,c=5.587 Å,Z=2,属于P4/mbm(#127)空间点群.进一步观察可以发现三个样品的衍射峰都出现了一定程度的偏移(往2减小的方向),图中以(211)晶面对应的衍射峰为代表并用蓝色的竖线标出.该XRD结果可以表明以下两个事实:第一,Tb3+,Eu3+离子已经成功通过掺杂的方式进入到Ba3Sc2F12基质的晶格当中,因为较大半径的离子(Tb3+,Eu3+)成功取代较小半径的离子(Sc3+)后会导致晶格膨胀,从而引发我们所看到的衍射峰往左偏移的现象[9];第二,稀土离子的掺杂虽然不改变物相,但会从晶面层面上带来一定的影响,直观体现在衍射峰的偏移及其相对强度的改变上[10,11],例如,(212)和(410)晶面对应的衍射峰(图中用“#”标记)的相对强度就随着掺杂离子的不同而呈现出明显的变化,单掺Eu3+离子时两衍射峰相对强度差异不大,而单掺Tb3+离子时或者共掺Tb3+,Eu3+离子时,(410)晶面对应的衍射峰的强度就明显比(212)强得多,这些晶面上的差异恰好反映了产品形貌上的差异,说明掺杂离子不同会导致晶体的各向异性生长,最终得到不同形貌的荧光粉产品[11].
2.2 下转换发光性能
图2分别为(a)BSF:0.08%Eu3+(a);(b)BSF:10%Tb3+;(c)BSF:10%Tb3+,0.08%Eu3+三种荧光粉对应的激发光谱和发射光谱图.如图2(a)所示,当用594 nm作为监测波长时,其激发谱图由200-500 nm范围内的一系列特征峰共同组成,如462 nm处 (7F0→5D2), 373 nm处 (7F0→5G2),354 nm处(7F0→5D4)以及318 nm处 (7F0→5H6)等等,其中最强的激发峰位于373 nm处;以373 nm 作为激发波长时,发射谱图主要由一个594 nm处的强峰和一个620 nm处的弱峰组成,这分别归属于Eu3+离子的磁偶极跃迁(5D0→7F1)以及电偶极跃迁(5D0→7F2),这里两个发射峰的强弱关系(磁偶极跃迁强于电偶极跃迁)还揭示了Eu3+在Ba3Sc2F12的晶格中处于对称环境[12].BSF:10%Tb3+荧光粉的光谱图展示在图2(b)中,当以213 nm作为激发波长时,其发射图谱由350-650 nm范围内的多个峰组成,这个范围覆盖了蓝光区及绿光区两个区域,前面一个区域有三个发射峰,即382 nm,418 nm和439 nm处,这分别对应于Tb3+离子的5D3→7F6,5D3→7F5和5D3→7F4能级跃迁;后面一个区域有四个发射峰,其具体位置与相应的能级跃迁如下:492 nm处(5D4→7F6),547 nm处(5D4→7F5),588 nm处(5D4→7F4)以及625 nm处(5D4→7F3)[13,14].分别单掺Tb3+,Eu3+离子条件下制得的荧光粉的发光性能良好,这说明Ba3Sc2F12是很好的下转换发光基质材料.
2.3 能量传递与多色发光
通过对比图2(a)和(b)可以发现,BSF:0.08%Eu3+荧光粉的激发光谱与 BSF:10%Tb3+荧光粉的发射光谱有较大部分的重叠,根据这个现象可以初步推断出Ba3Sc2F12基质中可以发生Tb3+→ Eu3+能量传递[15].在双掺Tb3+,Eu3+离子的条件下制得的荧光粉的光谱图如2(c)所示,当用213 nm的波长(此为Tb3+离子的特征激发波长,详见图2(b))来激发时,发现发射谱图中除了能观察到Tb3+离子的特征发射峰以外,还能看到Eu3+离子的特征发射峰,并且值得注意的是,213 nm波长激发下得到的Eu3+离子的特征发射峰比373 nm波长(此为Eu3+离子的特征激发波长,详见图2 (a))激发下的要强得多,这个结果验证了上述两离子之间可以发生有效的由Tb3+到Eu3+的能量传递的推论,同时也说明了Tb3+离子能有效的激发并敏化Eu3+离子[16].图3展示了Tb3+→Eu3+能量传递机理图.在213 nm激发下,Tb3+由基态变为激发态(5D3),随后被激发电子一部分返回基态,产生系列蓝光发射(5D3→7F4,5,6),另一部则先回到5D4能级,接着一些被激发的电子以辐射弛豫的方式返回基态,并产生绿光发射(5D4→7F3,4,5,6).Tb3+的5D4与Eu3+的5D3能级水平相近,于是Tb3+的5D4能级的激发电子能够转移到Eu3+的5D3能级,而转移过来的这一部分又能通过非辐射弛豫过程跃迁到Eu3+ 5D0能级,最后当其通过辐射驰豫过程返回基态时就可以观察到Eu3+的5D0→7F1,2特征发射.
众所周知,Tb3+离子是良好的绿光激活剂,而Eu3+离子是良好的红光激活剂.基于两种离子的特征发光颜色以及Ba3Sc2F12基质中Tb3+→ Eu3+能量传递现象,试图通过改变Eu3+离子的掺杂浓度来实现荧光粉发光颜色的调控.图4为一系列BSF:10%Tb3+,x%Eu3+(x=0,0.02,0.04,0.06,0.08,0.1,0.2)荧光粉在213 nm波长激发下的发射光谱图,当x=0即没有掺杂Eu3+的情况下只观察到Tb3+的特征发射峰,当x≠0时Eu3+的特征发射峰(594 nm以及620 nm处)开始出现并随着Eu3+离子掺杂浓度的增加而逐渐增强,在x=0.08处达到最佳,当继续增大x的值时会就引起浓度淬灭现象,从而导致Eu3+特征发射峰的强度开始降低[17].相应地,Tb3+在492 nm以及547 nm处的特征发射峰则因为发生了Tb3+→ Eu3+能量传递而单调减弱.这个过程中的能量传递效率可以通过公式来计算[18,19]
其中ηT表示Tb3+→ Eu3+的能量传递效率,Is和Iso分别代表掺杂了Eu3+和没掺杂Eu3+时Tb3+的荧光强度.当Eu3+掺杂浓度从0.02%变到0.2%的过程中,能量传递效率逐渐增大,当掺杂浓度为0.08%时已经达到64%,随后能量传递效率的增长率开始降低,最后大致稳定在72%.Eu3+(5D0→7F1),Tb3+(5D4→7F5)的相对发射强度以及能量传递效率ηT随Eu3+掺杂浓度变化的趋势如图5所示,这里更加直观的体现了Ba3Sc2F12基质中发生Tb3+→ Eu3+能量传递的事实以及能量传递过程中Eu3+,Tb3+离子特征衍射峰强度的相对变化.
接下来,探究Tb3+,Eu3+离子之间发生能量传递的机制.稀土离子间的共振能量传递一般通过电多极相互作用或者交换相互作用来实现,这又取决于两离子之间的临界距离(通常用Rc来表示),当Rc≥4 Å时,以电多极相互作用为主;当Rc<4Å时则以交换相互作用为主,临界距离Rc可用公式计算[20]
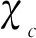
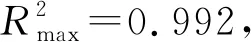
最后,探究了因Tb3+→Eu3+能量传递而引起的光色变化.图7展示了BSF:10%Tb3+,x%Eu3+(x=0,0.02,0.04,0.06,0.08,0.1,0.2)荧光粉对应的CIE色度坐标,显然,随着Eu3+离子掺杂浓度的改变,荧光粉呈现出丰富的发光颜色(色度图中点a-g),由绿光(0.2365,0.4268)变为黄绿光(0.3147,0.4091),再经黄光(0.3559,0.3933)变为近白光(0.3858,0.3567),最后变为红光(0.4074,0.2159).这说明通过改变Eu3+离子的掺杂浓度可以实现BSF:Tb3+,Eu3+荧光粉发光颜色的调控,并且这种具有丰富发光颜色的荧光粉有望应用于彩色显示屏,生物成像以及装饰美化等多个领域.
3 结论
总的来说,我们利用一步水热法制备了BSF:Ln3+( Ln=Tb,Eu,Tb/Eu )荧光粉,探究了荧光粉的下转换发光性能性质,紧接着探讨了Tb3+→Eu3+能量传递行为及其机制,研究结果表明该基质中Tb3+→Eu3+能量传递是通过偶极-偶极机制发生的.最后还基于Tb3+→Eu3+能量传递现象讨论了BSF:10%Tb3+,x%Eu3+(x=0,0.02,0.04,0.06,0.08,0.1,0.2)荧光粉的多色发光性能.随着Eu3+离子掺杂浓度的改变,荧光粉呈现出丰富的发光颜色,由最初的绿光变为黄绿光,在Eu3+离子掺杂浓度为0.06%时得到了近白光(0.3858,0.3567),最后变为红光.这项研究成功实现了单组分荧光粉多色发光调控,这有望应用于彩色显示屏,生物成像以及装饰美化等多个领域.

