连续血液滤过联合大黄通便颗粒治疗重症胰腺炎的效果及其对肠黏膜屏障功能的影响▲
郭利洁 黄武军 符兆胤 张 河 黄乙江 黄志卫
(广西钦州市第一人民医院1 肾内科,2 重症医学科,钦州市 535000,电子邮箱:xumiaoyou88@163.com)
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床上常见的危重症,由胰酶自身消化所致,以发病急、病情严重、并发症多、预后差、病死率高等为主要特点[1]。连续血液滤过是指通过体外循环血液净化系统有效清除大量有毒代谢产物和炎性介质的一种疗法,是目前临床治疗SAP的重要手段[2]。大黄通便颗粒的有效成分提取自天然植物大黄,具有镇痛、抑菌、促进胃肠道蠕动的效果[3]。本研究探讨连续血液滤过联合大黄通便颗粒治疗SAP的效果及其对肠黏膜屏障功能的影响。
1 资料与方法
1.1 临床资料 选取2015年4月至2018年10月我院门诊收治的124例SAP患者作为研究对象,均经过血尿淀粉酶、血钙及胰腺CT检查确诊。纳入标准:(1)均符合《中国急性胰腺炎诊治指南》[4]中SAP的诊断标准;(2)有明显腹部症状,如压痛、胀痛、恶心、呕吐等;(3)并发器官功能障碍;(4)急性生理学与慢性健康状况评分Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHEⅡ)≥8分;(5)年龄>18岁;(6)发病时间<24 h。排除标准:(1)合并其他胃肠道疾病、严重心肝肾等脏器疾病;(2)糖尿病患者;(3)近1个月内有大黄类药物使用史;(4)恶性肿瘤患者;(5)妊娠或哺乳期妇女;(6)对本研究药物过敏。按随机数字表法将患者分为观察组和对照组,各62例。其中观察组男性32例,女性30例,年龄65~77(66.81±5.23)岁,发病到入院时间(6.23±2.31)h,病因:胆源性21例,酒精性19例,高脂饮食22例;对照组男性33例,女性29例,年龄64~78(66.14±5.06)岁,发病到入院时间 (6.78±2.19)h,病因:胆源性22例,酒精性20例,高脂饮食20例。两组患者的性别、年龄、发病到入院时间、病因等一般资料比较,差异均无统计学意义(均P>0.05),具有可比性。本研究经过医院伦理委员会批准,所有患者均签署知情同意书。
1.2 治疗方法 两组患者均给予基础治疗,包括禁食、胃肠减压、抑制胃酸分泌、抗感染、纠正水电解质紊乱、抑制胰酶分泌、镇静镇痛、肠外营养、芒硝外敷等。在此基础上对照组采用连续血液滤过治疗:经皮穿刺,股静脉留置Arrow单针双腔导管作为血管通路,滤过设备为瑞典金宝公司的PrismaFLEX连续血液净化系统(PrismaFLEX M15型滤器);血流量150~200 mL/min,置换液流量2~4 L/h,每次置换液总量50~60 L,1次/d,每次治疗8~14 h。同时采用低分子肝素(意大利阿尔法韦士曼制药公司,批号:20140612、20160417、20171008)抗凝,肝素首剂为60~80 IU/kg,连续血液滤过治疗前30 min静脉注射,维持剂量为200~300 IU/h,监测抗Xa因子水平维持在0.25~0.35 U/mL;出血倾向严重者不使用肝素,定时用生理盐水冲洗滤品及管路。观察组在对照组治疗方案基础上加用大黄通便颗粒(甘肃扶正药业科技股份有限公司,国药准字:Z10910027,规格:12 g/包)治疗,经鼻-空肠管灌入,2包/次,2次/d。两组疗程均为14 d。
1.3 观察指标 (1) 临床指标:记录两组患者腹痛缓解时间、首次排便时间、住院时间。(2) 血、尿淀粉酶及炎症因子:分别于治疗前及疗程结束后第2天抽取患者空腹肘静脉血4 mL,以4 ℃、3 000 r/min离心15 min获得血清,采用碘-淀粉比色法[5]检测血清淀粉酶,试剂盒购自四川迈克生物科技股份有限公司(批号:20150118、20160911、20171103);采用酶联免疫吸附法检测肿瘤坏死因子α (tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6,IL-6),试剂盒均购自上海恒远生物科技有限公司(批号:20141204、20160723、20171009;20150126、2010625、20171023)。分别于治疗前及疗程结束后第2天采集新鲜中段尿4 mL,采用速率法[6]检测尿淀粉酶,试剂盒购自北京强申医学科技有限公司(批号:20150126、20160614、20171017)。检测设备为日立CL700型全自动生化分析仪。(3) 肠道黏膜屏障功能:取(2)中获得的血清,采用动态浊度法[7]检测血清内毒素,试剂盒购自厦门鲎试剂生物科技有限公司(批号:20141205、20160118);采用改良酶学分光光度法[8]检测D-乳酸,试剂盒购自艾美捷科技有限公司(批号:20141129、20170127);采用紫外比色法检测二胺氧化酶(diamine oxidase,DAO),试剂盒购自南京建衡生物工程研究所(批号:20141015、20160513、20170607)。检测设备为瑞士Tecan Infinite 200 PRO多功能酶标仪。(4) Ranson评分[9]:分别于治疗前及疗程结束后第2天进行Ranson评分,该评分包括11项指标,其中入院时5项,包括年龄>55岁、清晨空腹血糖>11.1 mmol/L、天冬氨酸氨基转移酶>250 U/L、乳酸脱氢酶>350 U/L、白细胞计数>16×109/L;入院48 h内6项,包括血钙<2 mmol/L、血氧分压<60 mmHg、碱缺失>4 mmol/L、血尿素氮上升>1 mmol/L、血细胞容积下降率减少>10%、体液丢失量>6 L。出现上述1项计1分,反之则为0分,合计0~11分,得分越高表示病情越严重。(5)急性胰腺炎床旁严重指数(bedside index for severity in acute pancreatitis,BISAP)评分[10]:于治疗前及疗程结束后第2天进行BISAP评分,包括血尿素氮>25 mg/dL、精神状态受损评分>15分、有全身炎症反应综合征、年龄>60岁、有胸腔积液,出现以上1项计1分,反之则0分,合计0~5分,得分越高表示病情越严重。(6)APACHEⅡ评分:分别于治疗前及疗程结束后第2天进行APACHEⅡ评分,包括急性生理评分、年龄评分及慢性健康评分,总分为71分,得分越高表示病情越严重。(7) 不良反应发生情况:记录两组患者治疗期间的不良反应发生情况,包括手足抽搐、寒战、插管处血性液体等。
1.4 疗效评价[4]治疗结束后进行疗效评估。治愈:临床症状消失,生命体征稳定,生化指标、CT检查显示胰腺正常,且并发症不明显。有效:临床症状基本消失,生命体征稳定,生化指标、CT检查显示胰腺基本正常,并发症未完全消失。无效:病情持续恶化,甚至死亡。总有效率=(治愈+有效)例数/总例数×100%。
1.5 统计学分析 采用SPSS 18.0软件进行统计分析。符合正态分布的计量资料以(x±s)表示,组内比较采用配对t检验,组间比较采用t检验或t′检验;计数资料以例数或百分比表示,比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床疗效比较 观察组的总有效率为96.8%(60/62),对照组的总有效率为83.9%(52/62),观察组的总有效率高于对照组 (χ2=5.905,P=0.015)。见表1。
2.2 两组临床指标比较 观察组的腹痛缓解时间、首次排便时间、住院时间均短于对照组(均P<0.05)。见表2。
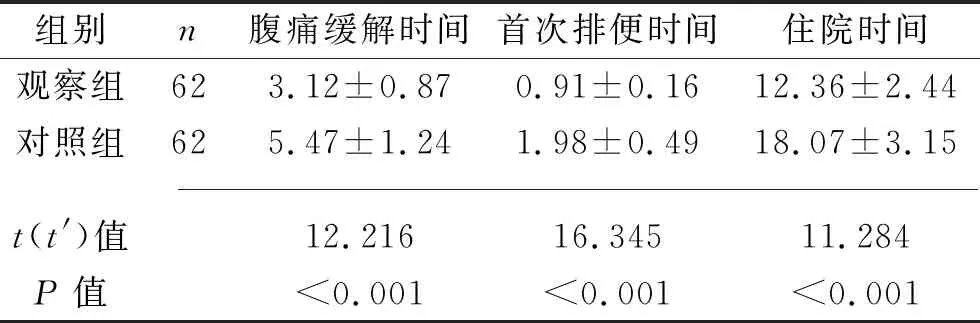
表2 两组临床指标的比较(x±s,d)
2.3 两组血、尿淀粉酶及炎症因子水平比较 治疗前两组患者血淀粉酶、尿淀粉酶、TNF-α、IL-6水平差异均无统计学意义 (均P>0.05)。治疗后,两组血淀粉酶、尿淀粉酶、TNF-α、IL-6水平均较治疗前下降,且观察组低于对照组(均P<0.05)。见表3。

表3 两组血、尿淀粉酶及炎症因子水平的比较(x±s)

组别nTNF-α(ng/L)治疗前治疗后t值P值IL-6(ng/L)治疗前治疗后t值P值观察组6245.17±10.8713.57±3.5821.742<0.00191.25±21.4740.16±13.2815.935<0.001对照组6245.98±11.2617.02±4.4718.823<0.00190.76±19.8654.28±15.3711.438<0.001 t(t')值-0.408-4.7430.132-5.474P值0.684<0.0010.895<0.001
2.4 两组肠道黏膜屏障功能比较 治疗前两组血清内毒素、D-乳酸、DAO水平差异均无统计学意义 (均P>0.05)。治疗后两组血清内毒素、D-乳酸、DAO水平均较治疗前下降,且观察组低于对照组(均P<0.05)。见表4。

表4 两组肠道黏膜屏障功能的比较(x±s)
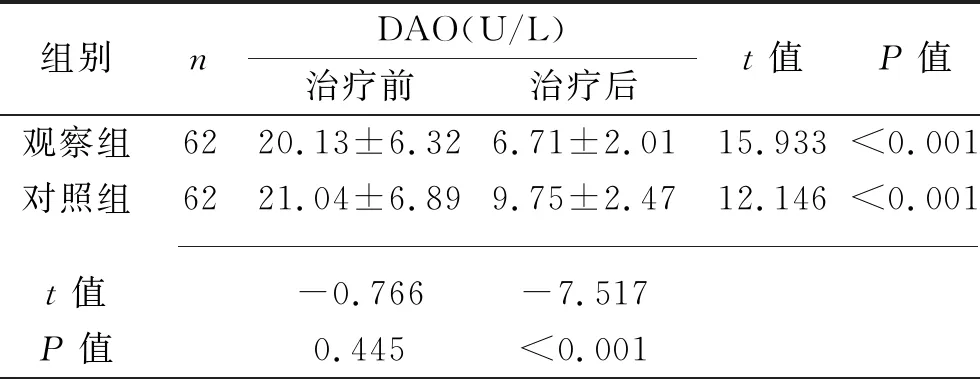
续表4
2.5 两组各项量表评分比较 治疗前两组Ranson评分、BISAP评分、APACHEⅡ评分差异均无统计学意义 (均P>0.05)。治疗后两组Ranson评分、BISAP评分、APACHEⅡ评分均较治疗前下降,且观察组的Ranson评分和APACHEⅡ评分均低于对照组(均P<0.05)。见表5。

表5 两组各项量表评分的比较(x±s,分)
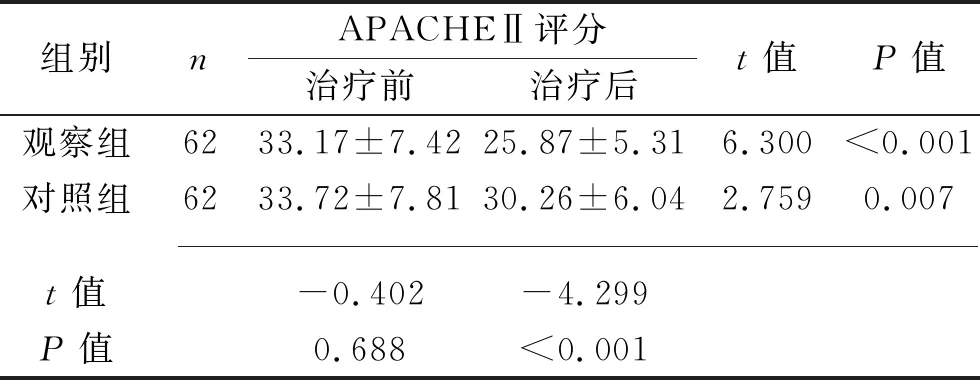
组别nAPACHEⅡ评分治疗前治疗后t值P值观察组6233.17±7.4225.87±5.316.300<0.001对照组6233.72±7.8130.26±6.042.7590.007 t值-0.402-4.299P值0.688<0.001
2.6 两组不良反应发生情况比较 对照组出现手足抽搐4例,寒战3例,插管处血性液体2例,不良反应发生率为14.5%(9/62);观察组出现手足抽搐1例,寒战1例,插管处血性液体0例,不良反应发生率为3.2%(2/62)。观察组不良反应发生率低于对照组(χ2=4.888,P=0.027)。
3 讨 论
胰腺炎是一种全身炎症反应性疾病,由胰蛋白酶活化引起胰腺损伤所致,同时伴有机体各种炎性细胞因子平衡紊乱,导致全身多种并发症的发生及恶化。胰腺炎的临床治疗主要以综合治疗为主,如液体复苏、抑制胰腺外分泌、保护器官功能、纠正稳态失调、营养支持、防止感染等[11]。
连续血液滤过是一种新型的体外循环血液透析方案,其通过对流及弥散机制,能很好地清除血液中的淀粉酶、尿素氮,还能有效地吸附血液中的炎性介质,从而阻断体内炎性介质级联作用,同时还具有滤器面积大、通透性好、清除效率高等优点[12-13]。李劲松等[14]的研究表明,连续血液滤过能够清除机体在炎症状态下释放出的细胞炎症因子,降低内毒素水平,从而减少多脏器功能障碍的发生,改善患者全身状况,提高生存率。
大黄性味苦寒,具有泻下攻积、清热泻火、凉血解毒、活血祛瘀之功效[15]。大黄通便颗粒的主要成分包括荟大黄素、大黄素、大黄酸、大黄酚、大黄素甲醚等黄酮类化合物。大黄通便颗粒口感较好,具有镇痛、抑菌、促进胃肠道蠕动等效果,对SAP效果更好[16],且患者服药依从性良好。动物实验表明,大黄具有清除氧自由基、抗炎抑菌、保护肠道黏膜屏障、促进胃肠动力等作用[17]。
本研究结果显示,观察组的总有效率高于对照组,且观察组的腹痛缓解时间、首次排便时间、住院时间均短于对照组(均P<0.05),说明连续血液滤过联合大黄通便颗粒对SAP的治疗效果显著,这可能是因为连续血液滤过可有效地清除血液中的毒性物质,改善微循环,增强组织细胞对氧的利用率,同时调节水、电解质及酸碱平衡,改善炎症反应,从而有效地阻断全身炎症反应综合征,并改善多脏器功能障碍。而大黄通便颗粒可以有效清除肠内毒素,促进胃肠道新陈代谢和蠕动,有利于通便排气,因此两者联用可产生协同作用,对SAP的治疗效果更佳。
淀粉酶是临床诊断SAP的最常用指标,其活性越高,诊断SAP的可能性越大[18]。TNF-α主要由单核-巨噬细胞分泌,是一种重要的炎性介质,可诱导多种炎症因子释放,促进炎症反应[19]。IL-6也是一种重要的炎性介质,会对机体产生炎性损伤,TNF-α与IL-6互相作用,形成恶性循环,放大炎症反应[20]。本研究结果显示,治疗后,两组患者血淀粉酶、尿淀粉酶、TNF-α、IL-6均治疗前,且观察组低于对照组(均P<0.05),提示观察组患者的病情和炎症状态得到有效的控制,这是因为连续血液滤过能够不断地清除炎症因子、内毒素等对机体有害的物质,同时大黄通便颗粒还能抑制胰酶的分泌,有效地保护胰腺细胞功能,并降低淀粉酶水平。
临床常采用内毒素、D-乳酸、DAO评价肠黏膜屏障功能。内毒素是G-细菌菌体裂解后释出的毒素,D-乳酸由肠道细菌代谢产生[21]。DAO是具有高度活性的细胞内酶,可以有效地反映小肠黏膜屏障的损伤情况。当肠黏膜屏障功能受损,肠道黏膜通透性上升时,内毒素、D-乳酸等大量释放入血液循环,导致血清内毒素、D-乳酸、DAO异常升高[22]。本研究结果显示,治疗后,两组患者血清内毒素、D-乳酸、DAO均低于治疗前,且观察组低于对照组(均P<0.05),提示连续血液滤过联合大黄通便颗粒能有效地改善SAP患者的肠道黏膜功能,两者联合使用可通过清除肠道的细菌及其毒素,以及各种有害物质和代谢产物,有效地改善患者的肠道黏膜功能,促进新陈代谢,改善微循环,并保护机体重要脏器。此外,本研究结果还显示,治疗后,两组患者Ranson评分、APACHEⅡ评分均低于治疗前,且观察组低于对照组(均P<0.05),提示观察组患者的病情好转程度优于对照组,且预后更好。此外,观察组不良反应发生率低于对照组(P<0.05),提示连续血液滤过联合大黄通便颗粒能有效地减少不良反应的发生。
综上所述,连续血液滤过联合大黄通便颗粒治疗SAP疗效显著,能有效地抑制炎症,促进肠道黏膜屏障功能的恢复,并减少不良反应。

