轮状病毒肠炎患儿外周血调节性和辅助性T淋巴细胞以及相关炎症因子的表达水平▲
薛露曦 王甜甜 聂 玲 陈光虎 梅 毅
(湖北省荆州市妇幼保健院儿科,荆州市 434020,电子邮箱:xueluxi1981@163.com)
轮状病毒肠炎又称为小儿秋季腹泻,是儿科的常见病、多发病,多发生于6~24个月的儿童[1]。其主要临床表现为严重的腹泻,病程多为3~5 d,多具有自限性,但是在临床上仍有一部分患儿伴有发热、呼吸急促,甚至出现严重脱水,从而引发心脏、肾脏等多种器官损害,给患儿的生命造成严重威胁[2-3]。T淋巴细胞介导的自身免疫反应在轮状病毒肠炎中有着重要的作用,在不同环境中CD4+T淋巴细胞可分化为不同的T淋巴细胞亚群,其中调节性T淋巴细胞(regulatory T lymphocyte,Treg)和辅助性T淋巴细胞(T helper lymphocyte,Th)17在轮状病毒肠炎的发病中尤其重要[4]。近年来研究显示,轮状病毒肠炎患儿血清及粪便中的白细胞介素(interleukin,IL)8、IL-6等炎性因子的表达水平明显升高,且与病情严重程度相关[5]。目前,有关轮状病毒肠炎患儿外周血Treg、Th17与炎症因子IL-4、IL-6、IL-17、γ干扰素、转化生长因子β(transforming growth factor β,TGF-β)关系的研究报道较少。本研究分析轮状病毒肠炎患儿外周血Treg、Th17及相关炎性因子水平及临床意义,为今后临床上治疗轮状病毒肠炎提供参考依据。
1 资料与方法
1.1 临床资料 选取2018年3月至2019年3月我院收治的64例轮状病毒肠炎患儿作为研究组,其中男性36例、女性28例,年龄6~24(14.57±3.68)个月,病程0.5~3.0(2.2±1.5)d。纳入标准:符合《实用儿科诊疗规范》[6]中关于小儿轮状病毒肠炎的诊断标准,即年龄6~24个月,病程小于2周,大便次数明显增多(大于10次/d),大便呈蛋花汤或水样,伴发热、恶心、呕吐等全身症状,粪便经胶体金检测轮状病毒抗原(+)。排除标准:(1)合并严重肝肾功能不全者;(2)重度营养不良者;(3)重度脱水者;(4)药物过敏或依从性差者;(5)其他原因导致腹泻者;(6)临床资料不完善者。另选取60例同期于我院门诊体检的健康儿童作为对照组,其中男性34例、女性26例,年龄6~30(14.3±4.5)个月。两组研究对象一般资料差异无统计学意义(P>0.05),具有可比性。两组受试儿童家长均对本次研究知情并签署知情同意书。本研究经荆州市妇幼保健院伦理委员会批准。
1.2 指标检测 所有受试儿童(研究组在治疗前采集标本)均在清晨空腹状态下抽取静脉血4 mL,置入抗凝管内,轻轻摇匀抗凝剂与血液,1 500 r/min离心10 min,取上清液,置于-80℃环境中储存待检。(1)Treg和Th17的检测:取外周血清加入CD4、CD25的抗体(美国BD公司,批号:180127、180205),用于Treg的标记,将标记后的样本经磷酸缓冲盐溶液洗涤后进行固定破膜;最后加入酶标FoxP3抗体(上海裕平生物科技公司,批号:17123034)进行细胞的标记,避光孵育30 min。采用流式细胞术法分离出外周血清单核细胞,在分离好的单核细胞中加入CD3、CD4的酶标抗体(美国BD公司,批号:180211、180130),用于Th17的标记;将标记后的外周血单核细胞标本用RPMI-1640培养液洗涤,并加入含胎牛血清的DMEM培养液中,然后放入37℃恒温箱中孵育18~20 h,培养后细胞及对照组避光孵育30 min,然后经磷酸缓冲盐溶液洗涤。最后采用FACSAriaⅡ型流式细胞仪(美国BD公司)测定细胞的荧光强度。(2)炎性因子的检测:采用酶联免疫吸附法检测血清IL-4、IL-6、IL-17、γ干扰素及TGF-β水平,试剂盒购于美国Biotechnology Systems公司(IL-4、IL-6、IL-17,批号:180105、180226)和美国R&D公司(γ干扰素、TGF-β,批号:17120925、17121819),严格按说明书操作。
1.3 统计学分析 采用SPSS 20.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用t检验;相关性分析采用Pearson检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组血清Treg和Th17水平比较 研究组血清Treg水平低于对照组,而血清Th17水平高于对照组(均P<0.05),见表1。
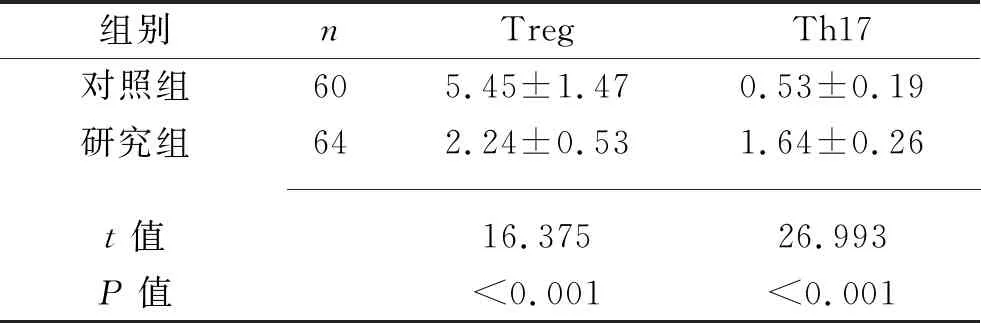
表1 两组血清Treg和Th17水平比较(x±s,%)
2.2 两组血清炎性因子水平比较 研究组血清IL-4、IL-6、IL-17、γ干扰素、TGF-β水平均高于对照组(均P<0.05),见表2。

表2 两组血清炎性因子水平比较(x±s,pg/mL)
2.3 轮状病毒肠炎患儿外周血Treg和Th17与相关炎性因子的相关性 轮状病毒肠炎患儿外周血Treg与IL-4、IL-6、IL-17、γ干扰素、TGF-β呈负相关(均P<0.05);Th17与IL-4、IL-6、IL-17、γ干扰素、TGF-β呈正相关(均P<0.05)。见表3。
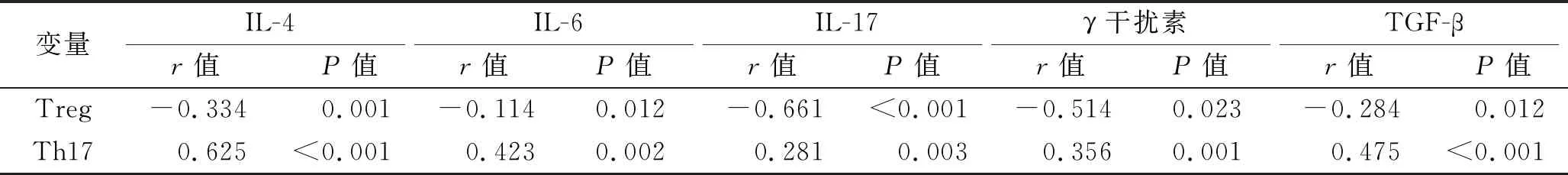
表3 轮状病毒肠炎患儿外周血Treg和Th17与相关炎性因子的相关性
3 讨 论
轮状病毒是一种RNA病毒,是婴幼儿腹泻的主要致病菌之一,引起小儿腹泻的类型主要是A组轮状病毒。轮状病毒肠炎是儿科常见的传染性肠道疾病,多发生在秋冬季节,主要以粪便途径传播,轮状病毒通过感染小肠上皮细胞导致细胞受损,从而引起腹泻[7]。轮状病毒肠炎患儿在发病早期多伴有前驱症状,如发热、恶心等全身症状,在急性期腹泻较严重时可伴有呕吐、腹痛、腹胀等症状。然而该病的发病机制及免疫机制尚不清楚。目前,临床上对该病毒引起的腹泻尚无特异性治疗方法,仍以对症治疗为主。已有的发病机制认为,轮状病毒首先侵犯肠道黏膜上皮,诱导机体发生免疫应答(以肠道黏膜免疫为主)[8]。近年来,国内外针对轮状病毒感染机体细胞免疫应答异常的研究已证实,有许多细胞免疫应答相关因子参与炎症的发生,且与病情有密切的关系[9-11]。
CD4+T淋巴细胞在接受抗原刺激后,可在不同条件下分化为不同的T淋巴细胞亚群,执行不同的生物学功能[12]。CD4+T淋巴细胞在γ干扰素诱导下分化为Th1,分泌γ干扰素以促进炎症反应的发生;在IL-4的诱导下分化为Th2,分泌IL-4以抑制炎症反应应答;在IL-6和TGF-β的诱导下分化为Th17,分泌IL-6、IL-17,参与介导自身免疫性疾病和炎症反应的发生[13-14]。TGF-β是人体内重要的人免疫抑制因子,具有调节免疫、促进黏膜上皮细胞增殖等功能。在本研究中,研究组血清中IL-4、IL-6、IL-17、γ干扰素、TGF-β水平均高于对照组(P<0.05),说明上述炎性因子是轮状病毒肠炎重要的促进因子,在其发病中发挥一定的作用。
Treg和Th17在健康组织中是并存的,在分化过程中有相互调节的作用,在稳定状态下,TGF-β促进Treg细胞的产生,Treg细胞以主动方式调控机体的免疫应答[15-16]。当机体受到病原体侵犯时,内源性IL-6、TGF-β促进Th17的分化。在本研究中,研究组血清Treg水平低于对照组,而Th17水平高于对照组(P<0.05),这提示Th17/Treg比例失衡时或可导致轮状病毒肠炎的发生。机体免疫系统平衡的维持,常通过CD4+T淋巴细胞亚群相互抑制细胞分化和功能而完成[17-18]。在大多数自身免疫疾病中,过度分化、活化的致病T细胞和调节功能受损,都会打破正常的免疫平衡状态,致使免疫系统向炎症状态发展,最终导致疾病的发生、发展[19-20]。相关分析结果显示,轮状病毒肠炎患儿外周血Treg与IL-4、IL-6、IL-17、γ干扰素、TGF-β呈负相关,Th17与IL-4、IL-6、IL-17、γ干扰素、TGF-β呈正相关(P<0.05),说明轮状病毒肠炎患儿外周血的Treg/Th17失衡比例可能与相关炎性因子水平上调有关,Treg和Th17的分化、活化相互制约,这依赖于各种相关炎性因子的相互作用。
综上所述,轮状病毒肠炎患儿外周血Treg降低而Th17升高,可能与相关炎性因子水平上调有关。Th17/Treg比例失衡时或可导致轮状病毒肠炎的发病,因此,可通过增加Treg细胞数量及加强其功能,同时抑制Th17细胞分化及其功能,以调节两者的比例可能对疾病的恢复有益。

