植物内切β-木聚糖酶的研究进展
王庆东 候志斌 许文杰
摘要 β-木聚糖酶是与细胞壁半纤维素降解密切相关的一类酶。本文总结了植物木聚糖酶的特征和分类,介绍了其在植物生长发育中的功能,概述了其在啤酒酿造等行业中的应用现状,以期为深入开展植物源β-木聚糖酶的研发提供理论依据。
关键词 植物;木聚糖酶;研究;开发
中图分类号 TS201.2 文献标识码 A
文章编号 1007-5739(2020)04-0211-03 开放科学(资源服务)标识码(OSID)
Abstract β-xylanase is a type of enzymes closely related to cell wall hemicellulose degradation.This article summarized the characteristics and classification of plant xylanase,introduced its function in plant growth and development,and summarized its current application in beer brewing and other industries,in order to provide the theoretical basis for further developing plant-derived β-xylanase.
Key words plant;xylanase;research;development
半纤维素是自然界中第二大丰富的多聚糖,而木聚糖是植物半纤维素的主要化学成分,它常与少量的葡萄糖、甘露聚糖、阿拉伯木聚糖、木葡聚糖和半乳葡萄甘露聚糖等聚合成具有支链的高分子化合物[1]。舒尔茨于1891年从植物组织中分离出一类多糖,认为是纤维素的半成品或纤维素的前体分子,将其命名为半纤维素[2]。自然界中木聚糖的存在形式多样,结构变化较大,且多为异型糖。研究发现,阔叶材与禾本科草类的半纤维素主要是聚木糖类;针叶材的半纤维素以聚半乳糖葡萄甘露糖类为主,而主链上的葡萄糖基与甘露糖基的分子比也因木材种类不同而在1∶1~1∶2之间变动。
木聚糖酶是一类可以将木聚糖水解为低聚木糖和木糖的复合酶系[3-4]。研究表明,木聚糖酶的来源不同,结构和酶学性质差异较大[5],木聚糖酶除了含有催化区外,尚含有一些重要的非催化区,如纤维素结合区、木聚糖结合区、热稳定区、链接序列以及其他未知功能的非催化区[6]。木聚糖酶已在细菌、真菌、蜗牛、甲壳动物、反刍动物、海洋藻类、陆地植物等生物中被发现。研究较多的是木霉、曲霉和细菌等来源的木聚糖酶[7],近年来,植物中木聚糖酶的研究日渐增多。
1 植物木聚糖酶的分类
木聚糖酶主要有内切酶和外切酶。其中,外切-β-1,4-木聚糖酶作用于木聚糖的非还原末端,以单个木糖为降解单位,不断增加整個反应体系的还原性[8]。内切-β-1,4-木聚糖酶优先从不同位点上作用于长链寡聚糖和木聚糖,切割β-1,4-木聚糖主链内部的木糖苷键[9],把木聚糖降解为木二糖及木二糖以上的寡聚木糖,也有少量的木糖和阿拉伯糖。依水解酶分类系统,木聚糖酶主要属于G11和F10家族水解酶类,其中,水解主链发挥主要作用的内切-β-1,4-木聚糖酶和内切-β-1,3-木聚糖酶等都属于分子量相对较大而pI值较小的F10家族;而G11家族木聚糖酶结构单一,pI较大,分子量较小,对木聚糖酶的特异性很高,酶解产物主要为木糖[10]。因不同来源木聚糖主链的聚合度各异,主链取代基的种类、数量、长度和取代位点也不一样。因此,常需要多种酶的协同作用,才能彻底降解木聚糖[10]。主要包含以下几种类型的酶。
1.1 内切β-1,4-D-木聚糖酶[EC 3.2.1.8]
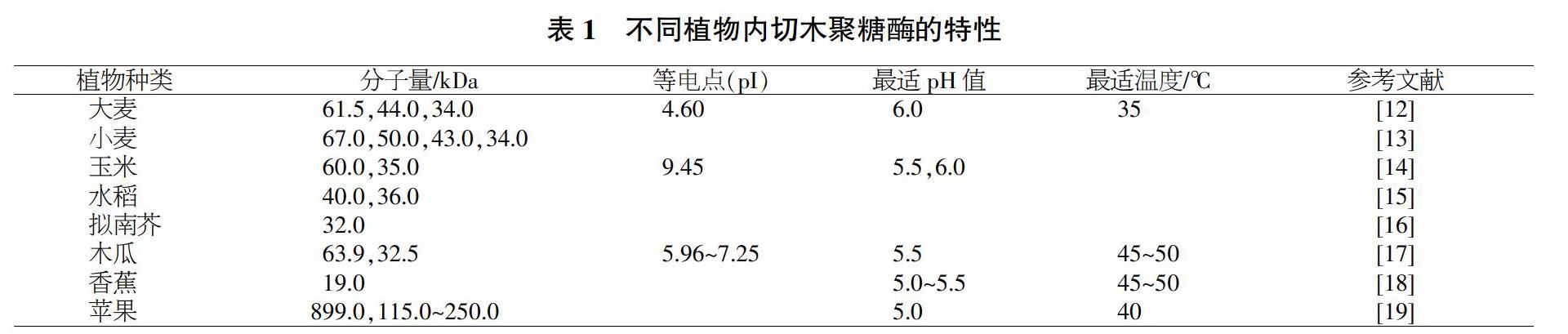
内切β-1,4-D-木聚糖酶简称木聚糖酶,作用于木聚糖主链的糖苷键,主要生成木二糖和木三糖等,很少生成木糖[11]。内切β-1,4-D-木聚糖酶是木聚糖酶解反应中的关键酶,也是当前的研究热点。目前,已从拟南芥、大麦和玉米等多种植物中分离纯化出等电点和分子量不同的内切木聚糖酶具体信息,如表1所示。
1.2 β-D-木糖苷酶[EC 3.2.1.37]
β-D-木糖苷酶的作用位点是低聚木糖的非还原端,可并释放出单个木糖。纯化后的β-木糖苷酶可能具有双功能的酶活性,例如,从 T.reesei、Butyrivibrio fibrisolven、Clostridium stercorarium 和H.vulgare等物种中获得的β-木糖苷酶同时具有阿拉伯糖苷酶的活性,这些双功能酶常具有不同糖苷水解酶家族的催化结构域。此外,细菌和真菌通常只产生一种β-木糖苷酶,而许多高等植物则产生不止一种β-木糖苷酶[11]。
1.3 α-L-呋喃阿拉伯糖苷酶
已发现2种类型,即对β-硝基酚-呋喃型阿拉伯糖苷或者阿拉伯聚糖分枝具有特异性的外切型酶;对阿拉伯聚糖侧链有特异性[11]的内切-1,5-α-L-阿拉伯聚糖酶[EC 3.2.1.99],
1.4 α-D-葡萄糖醛酸苷酶[EC3.2.239]
它的主要作用位点是4-O-甲基葡萄糖醛酸与木糖之间的α-1,2-糖苷键,可与内切木聚糖酶相互作用,促进低聚木糖的产生。此外,木聚糖酶还包括:作用于木糖残基的C-2和C-3位上乙酰基的乙酰木聚糖酯酶[EC 3.2.72]和一些酚酸酯酶,例如,可切除阿魏酸与阿拉伯糖残基所形成酯键的阿魏酸酯酶[EC 3.2.73]和作用于香豆酸和阿拉伯糖残基所形成酯键的香豆酸酯酶[EC 3.2.][11]。
具有不同结构的木聚糖,常因为其侧链上的取代基种类不同,需要由不同的酶分工协作才能被彻底降解。木聚糖作为半纤维素的主要成分,其主链主要由木糖聚合而成,侧链取代基较多,主要是α-L-呋喃阿拉伯糖。因此,目前对木聚糖降解酶研究较多的是内切β-1,4-D-木聚糖酶、 β-D-木糖苷酶和α-L-呋喃阿拉伯糖苷酶等,而酚酸、乙酰基、α-D-葡萄糖醛酸作为取代基在木聚糖侧链出现得少,相关的研究报道较少。
2 木聚糖酶在植物生长发育中的功能
2.1 在种子萌发中的作用
植物木聚糖酶可能参与谷粒萌发过程中糊粉层细胞壁的解聚。在发芽的谷粒中,糊粉组织会分泌水解酶进入胚乳组织,用于水解储存的淀粉、蛋白质和核酸等,为胚胎发育提供所需营养。其中,胚乳等组织细胞壁的解聚是胚乳动员所必需的,细胞壁的解聚可以促进水解酶扩散进入胚乳组织。同时,这些水解酶的释放伴随着糊粉层细胞壁的降解[12]。
研究发现,大麦籽粒发芽一段时间后,ɑ-淀粉酶分泌量下降,内切木聚糖酶被合成并从谷粒的糊粉层组织中释放。糊粉层细胞壁的降解发生在富含β-葡聚糖的胚乳细胞壁解聚之后,这与大麦内切聚糖酶的产生比β-葡聚糖酶、木糖苷酶和阿拉伯呋喃糖酶的合成分泌更迟的结果一致[20]。糊粉组织内外细胞壁的组成可能不同,发芽前期,糊粉层的外壁被降解,糊粉层的内壁则保留在具活性分泌的糊粉细胞的周围[21]。发芽后期,糊粉层细胞壁的水解伴随着内切木聚糖酶的释放,可为胚胎发育提供额外的碳水化合物,这可能有利于大麦籽粒在逆境中的发芽[20]。
此外,Backer[22]在小麦籽粒发芽过程中分离获得一种内切木聚糖酶,与大麦中分离得到的内切木聚糖酶具有高度相似性,推测小麦内切木聚糖酶可能在其籽粒发芽过程中也发挥着类似的功能。
2.2 在植物授粉中的作用
植物在有性生殖过程中花粉雄配子体会与雌性生殖器官相互作用[23],此过程发生在花药中。二倍体花粉母细胞经历减数分裂产生单倍体细胞—小孢子。小孢子在花药子囊腔中成熟,花药子囊腔是封闭的、细胞外液空间。在小孢子成熟过程中,小孢子作用于绒毡层[24],绒毡层给小腔转运营养物质并调控其组分。小孢子成熟的早期阶段,绒毡层分泌β-葡聚糖酶,它水解由β-葡聚糖组成的小孢子四分体细胞壁[25],释放的单个小孢子体继续在子囊中成熟。期间,绒毡层分泌花粉外壁前体物质,前体物质凝聚在花粉的内壁上形成花粉的外壁,外壁由许多基粒棒排列而成,最终在表层形成腔体成为花粉特有的物种结构。在小孢子发生的后期,绒毡层产生其他微粒并储存在花粉表层的外壁腔体中,花粉表层的微粒被称为花粉外被、含油层或者花粉鞘。授粉后,花粉落在心皮的柱头上形成花粉管,它通过分泌木聚糖酶穿透柱头,最终传递雄配子到胚珠。玉米花粉外被包含少量的油脂和单基因编码的内切木聚糖酶,该酶在绒毡层中表达,并在有性生殖过程中水解初生细胞壁,可促进花粉管渗透进入柱头内部[26]。
2.3 在果实成熟软化中的作用
果实的成熟是一个复杂和不可逆的过程,随着果实生理和生化过程的发生,将导致果实在颜色、风味、香气、质地和硬度等方面发生变化[27]。果实细胞壁的半纤维素多糖是由葡甘露聚糖、半乳葡甘露聚糖、半乳甘露聚糖、木聚糖和阿拉伯糖基木聚糖等组成,这些多糖与纤维素网络关联对细胞壁提供强的拉力,在水果成熟软化过程中这个网络结构会被酶解[28]。目前,在梨、西红柿、鳄梨、杨桃、芒果、香蕉等水果成熟过程中发现了内切木聚糖酶的活性,该酶的活性多在水果采后软化阶段增加,并与不同品种的水果的软化速率相关[29]。
2.4 在植物茎杆发育过程中的作用
木聚糖酶在豌豆等植物茎杆生长发育过程中也发挥着重要作用。在豌豆茎的伸长过程中,该酶可促使细胞壁膨胀疏松,促进细胞生长[30];在桉树次生木质部细胞壁的形成过程中该酶也能发挥重要作用;该酶参与拟南芥木质部木葡聚糖链的移位,使细胞膨胀[31];在白桦的形成层发育过程中,木聚糖酶基因表达具有时序性,推测可能与维管组织次生细胞壁的形成有关[32]。
3 植物木聚糖酶的应用
目前,微生物来源的木聚糖酶在食品、造纸、纺织、废纸脱墨等行业广泛应用,但植物来源的木聚糖酶的研究和开发较少,仅在啤酒酿造中有应用。
麦芽制备是啤酒酿造中的首要工序,它主要通过合成并释放内源性的多种水解酶类,如淀粉酶、蛋白酶、糖化酶、β-葡聚糖酶和木聚糖酶等,将麦芽中的蛋白质、淀粉、葡聚糖等大分子物质分解成小分子物质。阿拉伯糖基木聚糖是糊粉层细胞壁和胚乳细胞壁的主要成分,在啤酒酿造制麦过程中,阿拉伯糖基木聚糖的不充分降解不仅会阻碍糊粉层中的水解酶和胚乳中的营养物质的释放,而且大量没有降解的阿拉伯糖基木聚糖会进入到麦汁中,使麦汁黏度增加,影响后续的过滤和加工,使啤酒成品浑浊,影响啤酒的泡沫和口感等品质[33]。在大麦发芽过程中,阿拉伯糖基木聚糖和β-内切葡聚糖酶共同作用于胚乳层的细胞壁,使胚乳细胞壁降解并使与蛋白质和淀粉等水解相关的酶类顺利进入。这些内源性酶的分泌,改变了阿拉伯糖基木聚糖的结构和功能,影响了麦汁的黏度、浊度以及过滤速度,改善了麥汁的口感和泡沫等品质[34]。但目前为止,对小麦芽内源性的木聚糖内切酶的酶学特性以及具体组成、降解小麦芽水溶性阿拉伯糖基木聚糖、水不溶性阿拉伯糖基木聚糖的程度,还有降解物的分子量大小都不明确,系统研究这方面的内容可为啤酒酿造工艺优化、啤酒质量的提高提供理论支持。
木聚糖是作物秸秆半纤维素的主要成分,也是秸秆饲料的主要抗营养因子之一,它可以使动物消化道中的食糜黏度增加,使细胞中养分的释放被阻断,使饲料利用率下降,最终使动物生产性能下降[35]。因此,外源性的木聚糖酶作为饲料添加剂应用广泛。
但是研究发现,在小麦、玉米和水稻等多种植物体内同时存在木聚糖酶抑制蛋白,其中籽粒中的含量最高[36]。2010年,Dornez等[37]研究发现,植物内源性木聚糖酶的活性不能被水稻木聚糖酶抑制蛋白抑制,而真菌来源木聚糖酶的活性却能够被抑制,但是,植物来源的内切木聚糖酶能否作为饲料添加剂,以避开植物自身木聚糖酶抑制蛋白的作用,高效促進秸秆等粗饲料半纤维素的降解等相关的研究尚鲜有报道。
根据Gebruers等[38]的估算,小麦中抑制蛋白的含量远大于作为饲料添加剂的外源木聚糖酶的含量。理论上,这些抑制蛋白会对外源添加酶造成负面影响。英国ADAS咨询公司和Danisco动物营养分公司[39]联合发布的相关调查报告显示,欧洲小麦品种中木聚糖酶抑制蛋白的含量较高,建议添加更高剂量的木聚糖酶。
当前,工业上较广泛使用的木聚糖酶几乎都是微生物来源,而微生物源的木聚糖酶有酶稳定性差、底物特异性低和寿命短等弊端。因此,对植物等其他来源木聚糖酶的结构和功能的研发,将促使木聚糖酶在酿酒和饲料等领域的工业化应用。此外,研究发现,部分作物本身的木聚糖抑制蛋白会抑制微生物来源木聚糖酶的活性,而对植物内源性木聚糖酶没有抑制作用。因此,对植物来源的木聚糖酶的研究将会进一步促进饲料行业的快速发展。
4 参考文献
[1] 叶世超,薛婷,何文锦,等.木聚糖酶的应用及其研究进展[J].中国酿造,2013,32(7):8-10.
[2] 刘士清,李文鹏,孙传伯,等.产生木聚糖酶的兼性厌氧菌的生物学特性与酶的酶学特征[J].现代农业科技,2007(24):188-192.
[3] 陈阳雷,吉兴香,许凤.纸浆木聚糖酶生物助漂技术进展[J].中国造纸,2017,36(12):74-78.
[4] 高雅君,丁长河.木聚糖酶在食品工业中的应用研究进展[J].粮食与食品工业,2017,24(2):32-36.
[5] GHADIKOLAEI K K,NOGHABI K A,ZAHIRI H S.Development of a bifunctional xylanase-cellulase chimera with enhanced activity on rice and barley straws using a modular xylanase and an endoglucanase procured from camel rumen metagenome[J].Applied Microbiology & Biotechnology,2017:1-11.
[6] 张燕青,张超群,王浩猛.木聚糖酶的分子改造方法及其工业应用研究现状[J].中国酿造,2018,37(1):25-29.
[7] 周晨妍,王武,邬敏辰.Arg引入“Ser/Thr”平面对木聚糖酶XynⅡ热稳定性的影响[J].西北农林科技大学学报(自然科学版),2010,38(1):46-52.
[8] 温博婷,孙丽超,王凤忠,等.微生物木聚糖酶的研究进展及其在食品领域的应用[J].生物产业技术,2017(5):81-86.
[9] 冯定远.饲料酶中的主效酶与辅效酶[J].饲料工业,2019(17):1-11.
[10] SABINI E,WILSON K S,DANIELSEN S,et al.Oligosaccharide binding to family 11 xylanases:both covalent intermediate and mutant product complexes display(2,5)B conformations at the active centre[J].Acta Crystallographica,2001,57(9):1344-1347.
[11] 阮同琦,赵祥颖,刘建军.木聚糖酶及其应用研究进展[J].山东食品发酵,2008(1):42-45.
[12] CASPERS M P,LOK F,SINJORGO K M,et al.Synthesis,processing and export of cytoplasmic endo-beta-1,4-xylanase from barley aleurone during germination[J].Plant Journal for Cell & Molecular Biology,2001,26(2):191-204.
[13] D J.SIMPSON,G B.FINCHER,AHC.HUANG,et al.Structure andfunction of cereal and related higher plant(1->4)-beta-xylan endohydrolases.J.Cereal Sci,2003,37(2):111-127.
[14] WU S S,SUEN D F,CHANG H C,et al.Maize tapetum xylanase is synthesized as a precursor,processed and activated by a serine protease,and deposited on the pollen[J].Journal of Biological Chemistry,2002, 277(50):49055-49064.
[15] 黃莹莹,马明章,孙仁杰,等.水稻内源木聚糖酶osx基因的克隆及表达分析[J].实验室研究与探索,2013,(11):9-14.
[16] SUZUKI M,KATO A,NAGATA N,et al.A xylanase,AtXyn1,is predo-minantly expressed in vascular bundles,and four putative xylanase genes were identified in the Arabidopsis thaliana genome[J].Plant & Cell Physiology,2002,43(7):759-67.
[17] INIESTRA-GONZ?魣LEZ J J,LINO-L?譫PEZ G J,PAULL R E,et al.Papaya endoxylanase biochemical characterization and isoforms expressed during fruit ripening[J].Postharvest Biology & Technology,2013,81(2):13-22.
[18] PHANAYINGPHAISAL W,SUTTIMOOL W,PINPHANICHAKARN P.Purification and Properties of Cellulase-Fre e Xylanase from Namwa Banana Fruit Musa sapientum[EB/OL].[2019-08-08].https://www.researchgate.net/publication/255639752_Purification_and_Properties_ of_Cellulase-Fre_e_Xylanase_from_Namwa_Banana_Fruit_Musa_sapie ntum.
[19] WIKIERA A,MIKA M,STARZYNSKAJANISZEWSKA A,et al.Endo-xylanase and endo-cellulase-assisted extraction of pectin from apple pomace[J].Carbohydrate Polymers,2016,142:199.
[20] SCHUURINK R C,BAKHUIZEN R,LIBBENGA K R,et al.Dormant barley aleurone shows heterogeneity and a specific cytodifferentiation[J].Journal of Cereal Science,1997,25(1):27-36.
[21] SLADE A M,H?覫J P B,MORRICE N A,et al.Purification and characte-rization of three(1-4)-beta-D- xylan endohydrolases from germinated barley[J].European Journal of Biochemistry,1989,185185(3):533.
[22] EVELIEN DE BACKER,KURT GEBRUERS,WIM VAN DEN ENDE,et al.Post-translational processing of β-d-xylanases and changes in extractability of arabinoxylans during wheat germination[J].Plant Physiology & Biochemistry Ppb,2010,48(2/3):90.
[23] LEE R C,HRMOVA M,BURTON R A,et al.An α-L-arabinofuranosi-dase and a β-D-xylosidase from barley:purification,characterization and primary structures[J].Biology Chemistry,2003,278:5377-5387.
[24] GUBLER F,ASHFORD A E,JACOBSEN J V.The release of a-amylase through gibberellin-treated barley aleurone cellwalls.Planta,1987,172:155-161.
[25] FINCHER G B.Cell wall metabolism in barley[J]//In Barley:Genetics,Biochemistry,Molecular Biology and Biotechnology(Shewry,P.R.,ed.).Wallingford UK:CAB International,1992:413-437.
[26] BURTON R A,ZHANG X Q,HRMOVA M,et al.Asingle limit dextrinase gene is expressed both in the developingendosperm and in germinating grains of barley.Plant Physiol,1999,119:859-871.
[27] SA?譙UDOBARAJAS J A,LABAVITCH J,GREVE C,et al.Cell wall disassembly during papaya softening:role of ethylene in changes in composition,pectin-derived oligomers(PDOs)production and wall hydrolases[J].Postharvest Biology & Technology,2009,51(2):158-167.
[28] BRUMMELL D A,HARPSTER M H.Cell wall metabolism in fruit softening and quality and its manipulation in transgenic plants[J].Plant Molecular Biology,2001,47(1/2):311-339.
[29] MANENOI A,BAYOGAN ERV,THUMDEE S,et al.Utility of 1-meth-ylcyclopropene as a papaya postharvest treatment[J].Postharvest Biology & Technology,2007,44(1):55-62.
[30] NISHITANI K,TOMINAGA R.Endo-xyloglucan transferase,a novel class of glycosyltransferase that catalyzes transfer of a segment of xyloglucan molecule to another xyloglucan molecule[J].Journal of Biolo-gical Chemistry,1992,267(29):21058-21064.
[31] OH S,PARK S,HAN K H.Transcriptional regulation of secondarygrowth in arabidopsis thaliana[J].Journal of Experimental Botan,2003,393(54):2709-2722.
[32] 張岩,王玉成,吴英杰,等.白桦木聚糖内糖基转移酶XET基因序列及表达[J].东北林业大学学报,2011(10):101-104.
[33] GAMLATH J,ALDRED G P,PANOZZO J F.Barley(1-3;1-4)-glucan and arabinoxylan content are related to kernel hardness and water uptake[J].Journal of Cereal Science,2008,47(2):365-371.
[34] LI Y,LU J,GU GX,et al.Studies on water-extractable arabinoxylans during malting and brewing[J].Food Chemistry,2005,93(1):33-38.
[35] 吴建军,周樱,詹志春.木聚糖酶在动物肠道健康中的作用[J].饲料工业,2012,33(12):41-43.
[36] 王明道,魏照辉,张俊丽,等.小麦不同生育时期木聚糖酶活性及木聚糖酶抑制蛋白活性的变化[J].麦类作物学报,2010,30(3):544-547.
[37] EMMIE DORNEZ,EVI CROES,KURT GEBRUERS,et al.Accumulated Evidence Substantiates a Role for Three Classes of Wheat Xylanase Inhibitors in Plant Defense[J].Critical Reviews in Plant Sciences,2010,29(4):244-264.
[38] GEBRUERS K,COURTIN C M,MOERS K,et al.The bread-making functionalities of two Aspergillus niger,endoxylanases are strongly dictated by their inhibitor sensitivities[J].Enzyme & Microbial Technol-ogy,2005,36(4):417-425.
[39] VERHOEVEN T,SHORT F,WEIGHTMAN R,et al.Xylanase inhibitors in UK wheat varieties:Survey of incidence and significance to pig and poultry feed[J].[2019-08-08].https://www.researchgate.net/publication/238094938_Xylanase_inhibitors_in_UK_wheat_varieties_Survey_of_in cidence_and_significance_to_pig_and_poultry_feed.

