大气PM2.5全身暴露对大鼠多脏器病理、氧化应激指标和炎症因子的影响
白丽荣,谭子康,龚航远,耿红,董川,李瑞金
山西大学环境科学研究所,太原 030006
细颗粒物(PM2.5)是我国主要的大气污染物及雾霾的主要成因。太原市大气全年PM2.5质量浓度在冬季最高,超标严重,太原市10月超标污染物主要是PM2.5和PM10,超标时间均为14 d,超标率为64%,而11月除了颗粒物外,SO2也超标,PM2.5、PM10和SO2超标时间分别为10、9和4 d,超标率分别为56%、50%和22%。采暖开始后的约2周内(11月1—16日),大气PM2.5和PM10平均质量浓度分别为(57.7+31.3) μg·m-3和(108.2±48.8) μg·m-3,较采暖前有所下降,均未超标;11月17—23日其平均质量浓度分别为(133.0±44.5) μg·m-3和(213.5+55.5) μg·m-3,大气PM2.5和PM10浓度大幅上升,超标倍数增加。太原市大气中PM2.5的主要成分是有机碳(OC)、元素碳(EC)、硫酸盐、硝酸盐和铵盐,金属元素成分包括Na、K、Zn、Pb、As、Cd和Cu[1]。化石燃料燃烧、工业生产排放、汽车尾气、生物质燃烧和道路扬尘是我国PM2.5的主要来源。国际癌症研究机构确定空气颗粒物为人类一类致癌物[2]。许多流行病学研究显示,PM2.5暴露导致呼吸系统疾病、心血管系统疾病、神经系统疾病及肺癌的发病率和死亡率上升[3-4],其毒理机制主要涉及氧化应激损伤机制和炎症介质机制[5]。PM2.5对肺、心脏和脑的健康效应和毒性研究是人们关注的主要课题。
胃肠道和肝脏属于机体的消化系统,脾脏属于免疫系统,肾脏属于泌尿系统。研究发现,PM2.5暴露与胃癌、慢性肾病和肝癌的发生有关[6-8]。毒理学研究也表明,PM2.5可引起肝脏、肾脏、肠道和脾脏损伤效应[9-14]。这说明,人们不仅非常关注PM2.5对心肺和神经系统损伤的研究,同时也注意到PM2.5对全身其他器官的影响,PM2.5的全身毒性效应研究正被逐渐重视。
在PM2.5毒理学相关研究中,实验动物暴露方式有滴注(气道滴注和鼻滴注)[10,12,15-16]和全身暴露[9,11,17]。动物全身PM2.5吸入系统主要有浓缩式和实时暴露2种,目前已成为科学的PM2.5暴露研究手段。采用PM2.5混悬液人工气道滴注的方法与动物吸入暴露的方式有差别,全身吸入暴露系统更能模拟动物在现实大气实际暴露的情境,已成为人们更认可的暴露模式。
太原市工业以煤炭、焦化和冶金为主,大气污染以煤烟型为主,特别是其盆地结构和严重的冬季辐射逆温,加剧了大气污染。本研究于2018年11月中旬开始采用全身PM2.5真实暴露模型(通气笼暴露系统)进行SD大鼠暴露实验,分别暴露1个月和2个月,研究了太原市冬季PM2.5亚慢性暴露对大鼠肝、肾、胃、脾和小肠的病理损伤、脂质过氧化效应和炎症因子变化,揭示PM2.5对消化系统、免疫系统和泌尿系统的损伤效应,为研究PM2.5全身性毒性机制提供实验数据。这种PM2.5真实暴露模型模拟现实生活中PM2.5亚慢性暴露情境,笼内动物吸入PM2.5,符合实际情况,更有助于揭示PM2.5真实致病机制。
1 材料与方法(Materials and methods)
1.1 暴露系统
本研究采用了一个独特新颖的PM2.5暴露系统(IVC通气笼),购自苏州市君圣实验动物设备有限公司。该系统的特点是实验动物可在通气笼内全身暴露、真实吸入大气环境PM2.5。对照笼使用3层HEAP过滤膜,有效阻挡了颗粒物,使得笼内PM2.5浓度低于TSI颗粒物测定仪的检出限(1 μg·m-3);暴露笼使用特殊的过滤膜,只允许PM2.5颗粒进入笼内。经测定,笼内PM2.5浓度约为室外大气浓度的70%,即61 μg·m-3。实验过程中严密监测笼内气象条件,保持相对恒定的温度(22~27 ℃)、湿度(30%~40%),温/湿度通过仪器显示屏控制,在显示屏上设定适宜的温湿度后仪器自动调整,并保证PM2.5暴露笼内的物理条件与对照笼一致。
1.2 动物分组
健康清洁级雄性SD大鼠20只,购自北京中国人民解放军医学科学院实验动物中心,体质量(157.5±7.93) g,购入后在本研究室动物房饲养。20只大鼠随机分为对照组(1个月和2个月)和PM2.5暴露组(1个月和2个月),共4组,每组5只。在实验过程中,大鼠被安置在对照笼和暴露笼中,分别连续暴露1个月和2个月(每天24 h,每周7 d)。PM2.5组大鼠全身暴露吸入真实环境大气PM2.5;对照组大鼠吸入无颗粒物的空气。光照和暗周期均为12 h。动物可随意获得食物和水。每3天更换一次笼内垫料。
1.3 大鼠组织的脏体比与组织病理学分析
暴露结束后,大鼠引颈脱臼处死,解剖、分离小肠、肝脏、脾脏、胃和肾脏组织。分别称量大鼠体质量及肝、脾、胃和肾的质量,计算其脏器系数(%)(脏器质量/动物体质量×100%)。后分别取不同组大鼠5个组织(每个组织约5 mm3)固定于福尔马林溶液中,石蜡包埋,制成5 μm的切片,脱蜡,苏木精-伊红染色(HE染色),脱水透明,中性树胶固定,封片,显微镜下观察。
1.4 促炎因子和脂质过氧化指标测定
取组织样品,剪取0.1 g组织、加入1 mL生理盐水于冰浴上进行组织匀浆,组织匀浆液离心后(3 000 r·min-1,10 min,4 ℃),收集上清液。采用ELISA试剂盒(上海西唐生物科技有限公司)测定大鼠肝、肠、脾、胃和肾组织匀浆液中白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平;采用特定生化试剂盒(南京建成生物工程研究所)测定超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。具体操作步骤按照试剂盒说明书严格进行。
1.5 统计分析
实验数据以平均值±标准差(Mean±SD)表示,应用SPSS19.0软件对数据进行单因素方差分析,用最小显著性差异法(LSD)检验,以P<0.05为差异有统计学意义。
2 结果(Results)
2.1 PM2.5暴露组和对照组大鼠脏器系数变化
与对照相比较,1个月暴露组大鼠肝、脾和肾脏器系数增加有显著统计学意义(P<0.01)。2个月暴露组和1个月暴露组相比,各组织脏器系数变化的差异均具有统计学意义(P<0.01)。如表1所示,PM2.5暴露后动物体质量较相应对照组增加较大;而脏器质量变化较小。

表1 PM2.5暴露对大鼠主要脏器系数的影响Table 1 Influence of PM2.5 exposure on main organ coefficients in rats
2.2 PM2.5暴露引起各组大鼠组织病理学变化
肠HE染色结果表明,对照组大鼠结肠黏膜上皮细胞完好,主要为单层柱状上皮,肠腺有序排列规则整齐,未见损伤及炎性改变(图1(a)和图1(c))。与对照组相比,1个月暴露组大鼠结肠黏膜上皮细胞结构紊乱,肠腺排列不整齐(图1(b))。2个月暴露组大鼠结肠损伤严重,表现为腺体坏死、萎缩,黏液分泌减少,固有层与黏膜下层有部分炎性细胞如中性粒细胞、淋巴细胞和单核细胞等浸润(图1(d))。

图1 4组大鼠肠组织病理学改变情况(HE染色,200×)Fig. 1 Pathological changes of intestine in four groups of rats (HE staining, 200×)
肝脏对照组的肝细胞以中央静脉为中心向周围放射状排列,无明显异常(图2(a)和图2(c))。与对照组相比,1个月暴露组大鼠肝组织结构紊乱,有少量出血现象(图2(b))。2个月暴露组出现明显脂肪变性,肝细胞水肿,肝细胞浑浊,可见个别细胞坏死和炎细胞浸润(图2(d))。
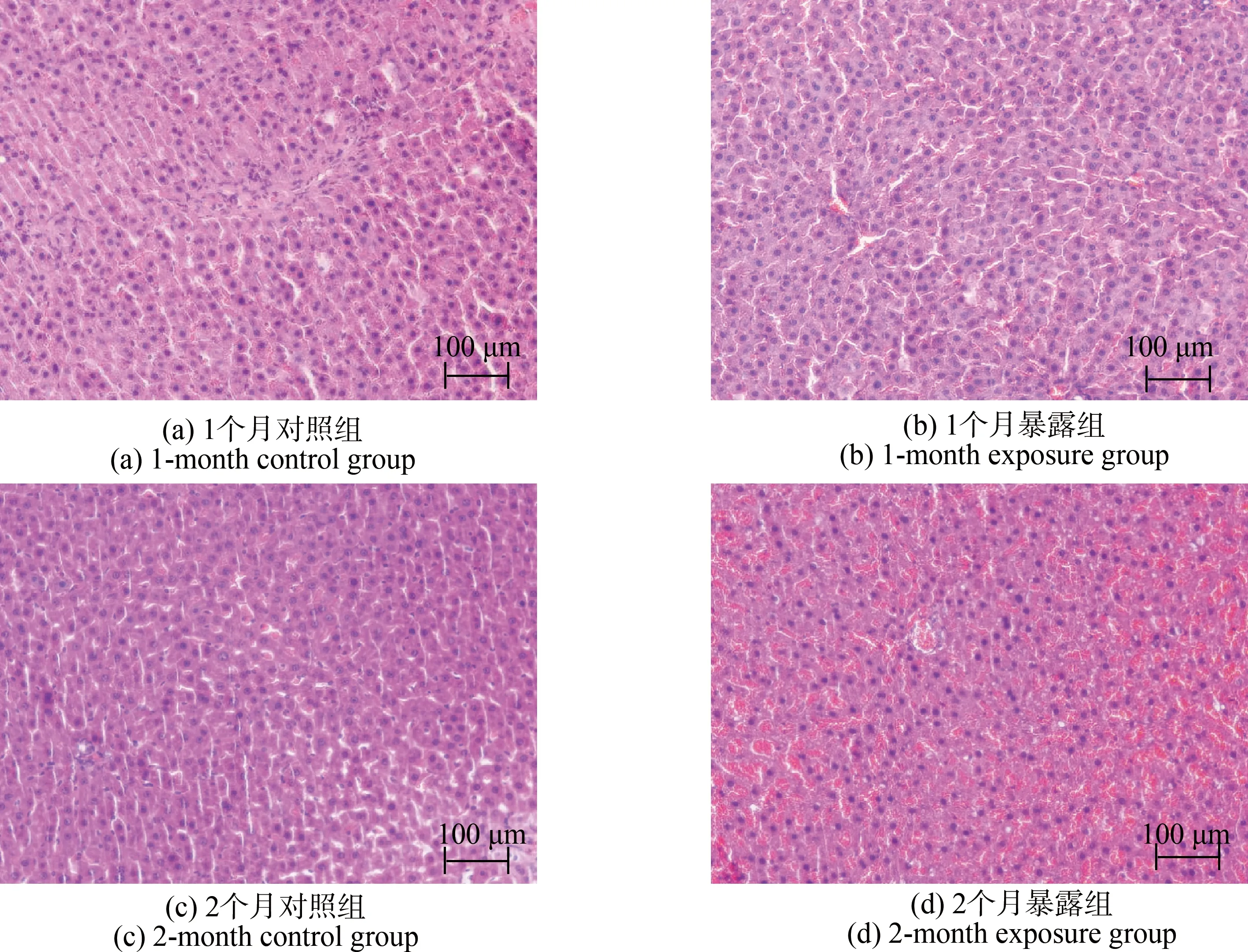
图2 4组大鼠肝组织病理学改变情况(HE染色,200×)Fig. 2 Pathological changes of liver tissue in four groups of rats (HE staining, 200×)
脾脏HE染色结果表明,对照组大鼠脾白髓边缘区的界线清晰,均匀致密蓝染且组织排列有序(图3(a)和图3(c));与对照组比较,PM2.5染毒组脾脏有明显的结构异常现象,红髓和白髓的界线不清楚,团块状结构消失且有炎性细胞浸润。2个月PM2.5暴露大鼠脾脏损伤比1个月暴露更严重,伴有大量充血现象(图3(b)和图3(d))。

图3 4组大鼠脾组织病理学改变情况(HE染色,200×)Fig. 3 Pathological changes of spleen in four groups of rats (HE staining, 200×)
肾脏对照组无明显异常,各曲管上皮排列有序(图4(a)和图4(c))。PM2.5的1个月暴露组有不同程度肾间质水肿和肾介质炎性细胞浸润,肾小管再生,再生细胞呈现多形,有明显出血现象(图4(b))。PM2.5的2个月暴露组有肾小球固缩,肾小管上皮细胞水肿,有明显出血现象(图4(d))。

图4 4组大鼠肾组织病理学改变情况(HE染色,200×)Fig. 4 Pathological changes of kidney in four groups of rats (HE staining, 200×)
HE染色结果表明,对照组大鼠无明显异常(图5(a)和图5(c))。1个月暴露组大鼠胃体部浅层黏膜上皮细胞充血(图5(b))。2个月暴露组大鼠胃体部浅层黏膜上皮细胞变性坏死,深部细胞排列疏松,间质水肿,有少量上皮细胞核溶解消失,残存少数核碎片(图5(d))。

图5 4组大鼠胃组织病理学改变情况(HE染色,200×)Fig. 5 Pathological changes of stomach in four groups of rats (HE staining, 200×)
2.3 PM2.5对大鼠各组织IL-6和TNF-α水平的影响
由图6可知,PM2.5暴露组大鼠各组织中的IL-6(图6(a))和TNF-α(图6(b))表达均上升,与对照组相比有显著性差异(P<0.05,P<0.01)。2个月PM2.5暴露组大鼠5个组织中IL-6和TNF-α水平与1个月PM2.5暴露组相比没有显著差异。

图6 PM2.5暴露对大鼠各组织白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的影响注:与对照组相比,a P<0.05,b P<0.01。Fig. 6 Effects of PM2.5 exposure on interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) in rat tissuesNote: Compared with the control, a P<0.05, b P<0.01.
2.4 PM2.5对大鼠各组织SOD活性和MDA含量影响
由图7(a)可知,大鼠肠、脾、肾和胃组织中SOD活性均有不同程度的增加,其中,1个月PM2.5暴露组大鼠肠、脾和肾组织以及2个月暴露组大鼠胃组织中SOD活性较对照组有显著性差异(P<0.05),2个月PM2.5暴露组大鼠肠、脾和肾组织SOD活性与对照组相比具有显著差异(P<0.01)。而2个月PM2.5组大鼠肝组织和1个月PM2.5组胃组织中SOD活性较对照组虽有增加但并无显著性差异。

图7 PM2.5暴露对大鼠各组织超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量的影响注:与对照组相比,a P<0.05,b P<0.01;与1个月暴露组相比,*P<0.05。Fig. 7 Effects of PM2.5 exposure on superoxide dismutase (SOD) activity and malondialdehyde (MDA) content in different tissues of ratsNote: Compared with the control, a P<0.05, b P<0.01; compared to 1-month of exposure, *P<0.05.
不同组大鼠5种组织中MDA含量如图7(b)所示。与对照组相比,PM2.5暴露后大鼠各组织中MDA含量都显著上升,有显著差异(P<0.05或P<0.01)。1个月PM2.5暴露组大鼠肠、肝、肾和胃组织和2个月PM2.5暴露组大鼠肠、脾组织分别较对照组中MDA含量有显著性差异(P<0.05)。1个月PM2.5暴露组大鼠脾组织和2个月PM2.5暴露组大鼠肝、肾、胃组织中MDA含量与对照组相比有显著差异(P<0.01)。2个月PM2.5暴露组大鼠肝、肾和胃组织中MDA含量与1个月PM2.5暴露组相比,具有显著性差异(P<0.05)。
3 讨论(Discussion)
当前我国大气PM2.5污染还未全面解决,许多地区PM2.5污染加重,灰霾现象频繁发生,严重影响空气环境质量和人们的身体健康。PM2.5粒径小,比表面积大,含有无机、有机和微生物等多种有害物质,进入人体后对健康造成极大危害,PM2.5全身性损伤效应和毒性机制研究是我国大气污染研究关注的焦点。
早期PM2.5毒理学研究的动物暴露模式多采用气道滴注和口鼻式滴注方式进行颗粒物染毒[11,13,15-16],这种方式的局限性在于动物不是通过自然呼吸空气染毒、且滴注过程中对动物有机械损伤,不适宜开展较为长期的滴注暴露。近年来,全身暴露染毒系统逐渐兴起,通过模拟颗粒物或PM2.5暴露探讨其对机体的毒性效应及机制,这种方式更为科学,也符合实际颗粒物暴露情境。由于城市大气PM2.5污染受到污染源、地形和气象因素影响,PM2.5污染特征及化学组分存在较大差异,PM2.5暴露引起的健康危害及毒理学机制较为复杂。太原市具有特殊的工业污染、盆地地形和冬季辐射逆温特点,污染物不易扩散,大气污染较为严重。鉴于此,本研究在太原市这一典型地区,利用全身暴露染毒系统(IVC通气笼),控制温度、湿度、气压、空气流速和噪音等条件,对大鼠进行PM2.5实时暴露(暴露期间笼内PM2.5平均浓度约为61 μg·m-3)和亚慢性吸入染毒,研究PM2.5对不同组织的损伤效应,为PM2.5与全身性毒性研究提供动物实验基础。
HE染色结果是评价动物病理效应的常用方法。本研究结果表明,PM2.5暴露1个月和2个月对大鼠肝、肾、脾、胃和小肠均造成了不同程度的病理损伤,且PM2.5暴露2个月大鼠5种脏器的病理损伤效应和比暴露1个月严重,提示PM2.5对多种器官存在病理损伤效应,PM2.5暴露时间越长,组织损伤越严重,暴露2个月的时间该病理损伤效应未得到修复或缓解。
脏器系数是毒理学研究的常用指标。由表1所示,1个月暴露组SD大鼠肝和肾的脏器系数比对照组显著增加,且超出了文献推荐的8~12周SD大鼠正常参考值范围[18],提示肝和肾可能是PM2.5毒作用的靶器官。2个月暴露组各组织的脏器系数比1个月暴露组显著下降,这可能与年龄增长、动物体质量增加有关。
MDA是膜脂质过氧化效应和氧化应激的重要标志物[19]。PM2.5暴露1个月和2个月后大鼠各组织中MDA含量与对照组相比显著升高,表明PM2.5引起细胞膜脂质过氧化效应,这可能是PM2.5造成组织损伤的原因之一。PM2.5暴露2个月后大鼠肝、肾和胃组织中MDA含量的增加与1个月暴露组相比有显著统计学意义,提示肝、肾和胃组织发生了显著的脂质过氧化效应。活性氧(ROS)介导的氧化应激与疾病的发生有关,SOD具有清除超氧阴离子自由基的作用[20]。本研究发现,PM2.5暴露引起大鼠5个组织的SOD活性水平增加,在肾、脾、胃和小肠中的变化与对照组相比有显著性差异。我们推测PM2.5暴露导致机体内产生了较多ROS,在太原冬季PM2.5污染的条件下,SOD活性被激发以清除活性氧自由基。组织中MDA含量增加,反映出SOD活性增加没有有效减少ROS堆积,氧化应激效应依然存在。文献报道显示,在不同的PM2.5暴露浓度、暴露时间和暴露模式下,PM2.5引起了实验动物肝、脾、肾和肠道的病理损伤和氧化应激效应[10-13],这与本研究结果一致。
除氧化应激外,炎症反应是决定多器官损伤严重程度和疾病发生的关键因素[6,12,21]。由炎症因子测定结果可知,PM2.5引起大鼠5个组织IL-6和TNF-α水平增加,其中,肝和小肠中的水平与对照组相比有显著性差异,这说明PM2.5可使多种组织出现炎症反应,而这种反应有组织差异性,肝和小肠对PM2.5的刺激较为敏感。文献报道,PM2.5通过ROS介导线粒体自噬引起肝细胞纤维化,通过内质网应激引起肝细胞凋亡和炎症,通过肝细胞氧化应激和炎症引起的脂质代谢异常[13-15],这些机制可能和肝癌和非酒精性肝病的发病有关。PM2.5不仅引起小鼠小肠病理损伤,且PM2.5慢性暴露引起小鼠肠道功能紊乱,并影响了糖代谢异常[22]。这说明PM2.5致肝和小肠的损伤机制与代谢和疾病的发生有关,其毒性效应研究应引起重视。
综上,结合脏器系数、HE染色、炎症因子和MDA结果,我们发现PM2.5亚慢性暴露造成大鼠多种组织出现不同程度病理损伤、脏器系数异常改变、脂质过氧化效应和炎症因子水平升高,且PM2.5暴露2个月的损伤效应大于1个月。相对而言,肝脏、小肠和肾脏受到PM2.5的负面影响较大。有研究报道,上海市大气PM2.5暴露对心肌和肺功能有损伤[23]。广州、深圳、东莞和肇庆4个城市的大气PM2.5均可使大鼠肺组织发生氧化应激和炎性反应。其中,广州、东莞和深圳的PM2.5对指标的影响较肇庆强[24]。已有对太原市的研究表明,PM2.5暴露可以通过诱导炎症反应以及炎症因子的表达从而导致心血管疾病发生[25]。不同采样点的PM2.5由于成分组成不同而毒性毒理有很大差异,本文结论仅针对所采集具体样本。由于目前在全身暴露染毒系统实验条件下,无法分离PM2.5和气态污染物,因此推测雄性SD大鼠暴露器官异常可能是PM2.5和气态污染物共同影响的结果。PM2.5对消化系统、免疫系统和泌尿系统的健康效应和毒性作用机制还需进一步的实验研究。

