低盐青方腐乳关键风味物质及部分功能性研究
马艳莉,梁静静,李素萍,丁玉峰,席晓丽,王颉,郭书贤
(1.河北农业大学食品科技学院,河北保定071000;2.南阳理工学院河南省工业微生物资源与发酵技术重点实验室,河南南阳473004)
腐乳作为传统发酵豆制品,在中国已有一千多年的食用历史,它营养丰富、滋味鲜美,被人民群众广泛喜爱。但是,腐乳是含盐量较高的食品,流行病学证据表明,高血压等疾病的发病率与食盐摄入量呈显著负相关性,因此,目前食品工业向低盐化方向发展,腐乳的高盐含量严重限制产品消费,影响其功能性发挥,妨碍其向国际化市场推进。相关研究表明,当腐乳的食盐含量从10%下降到6%后,其抗氧化性、血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制活性、α-葡萄糖苷酶抑制活性会增强,并且活性的保持能力也更强[1]。因此,降低腐乳食盐含量势在必行,也是目前腐乳行业迫切需要解决的问题。
腐乳生产中使用较多食盐主要目的是抑制有害菌生长、控制酶活,而乳酸菌和丁酸梭菌有抑制有害菌生长的作用,因此可以考虑部分代替食盐应用于腐乳生产。益生菌应用于腐乳生产,改善其生产工艺有少量报道。后酵期间各种微生物的生长代谢活动也会对腐乳品质产生重要的影响。刘会勇等[2]通过调整发酵温度、添加酶类物质、酵母菌等来缩短腐乳生产周期,腐乳在发酵60 d时,香气浓郁,口感细腻,各项指标均达到了国家标准要求。现代研究表明,发酵豆制品富含的多种生物活性物质独自或协同作用,形成了发酵豆制品独特的生理功能,如抗氧化、降血压、抑制乙酰胆碱酯酶、降血糖、抗菌等[3]。腐乳中含有多种抗氧化成分,如大豆异黄酮、酚酸类化合物、多肽等[4],赋予腐乳产品良好的抗氧化活性。
本文在前期研究基础上,使用乳酸菌豆坯代替传统卤水豆坯接种雅致放射毛霉进行前期发酵,不经过盐腌过程,并在后发酵汤料中添加乳酸菌LB01和丁酸梭菌BP01,直接进入后发酵过程,尝试制作低盐腐乳,并研究其品质特征和部分功能性变化。
1 材料与方法
1.1 材料与试剂
γ-氨基丁酸(γ-aminobutyric acid,GABA)标准品、乙酰胆碱酯酶(acetylcholine esterase,AchE)(220 U/mg)、血管紧张素转换酶(angiotensin converting enzyme,ACE)(2 U/mg~6 U/mg)、邻苯二甲醛(ortho-phthalaldehyde,OPA)、5,5’-二硫代-2,2’-二硝基苯甲酸 [5,5-dithiobis(2-nitrobenzoic acid),DTNB]、甲醇、邻苯二甲酸二乙酯、甲硫醇、丁酸乙酯、乙酸乙酯、正丁醇、丙酸丁酯、丁酸、丙酸等:西格玛奥德里奇公司;高纯氦气(纯度≥99.999%):北京千禧京城气体有限公司;β-巯基乙醇:北京鼎国生物技术有限公司。
1.2 仪器与设备
气相色谱-质谱联用仪(Agilent7890A-5975C):美国安捷伦公司;96孔酶标板(MS-8496F):Sumitomo Bakelite Co.,Ltd.;酶标仪(Model 680):日本伯乐生命医学公司;中草药粉碎机(FW135):天津市泰斯特仪器有限公司;高效液相色谱仪(LC-10A):日本岛津公司;真空冷冻干燥机(EYELA FDU-540):Tokyo Rikakikai Co.,Ltd.;紫外-分光光度计(UV mini 1240):Shimadzu Co.;台式离心机(TDL-40B):上海安亭科学仪器厂。
1.3 方法
1.3.1 样品制备
样品制备方法同前期研究中的样品制备方法[5]。
1.3.1.1 腐乳对照样品的制备
通过喷洒雅致放射毛霉孢子悬浮液于卤水豆坯上制得毛坯,然后腌制5 d(食盐含量达11%~14%),将腌制好的12块盐坯放入玻璃瓶中,加入140 mL后酵汤料,在28℃左右后酵45 d,即可制得腐乳对照样品。
1.3.1.2 低盐样品1的制备
通过喷洒雅致放射毛霉孢子悬浮液于乳酸菌豆坯上制得毛坯,然后不经腌制将毛坯直接放入玻璃瓶中,加入140 mL后酵汤料,在28℃左右后酵45 d,即可制得低盐样品1。
1.3.1.3 低盐样品2的制备
通过喷洒雅致放射毛霉孢子悬浮液于乳酸菌豆坯上制得毛坯,然后不经腌制将毛坯直接放入玻璃瓶中,加入140 mL后酵汤料,加入浓度为1×106CFU/mL的乳酸菌和丁酸梭菌菌悬液各5 mL,在28℃左右后酵45 d,即可制得低盐样品2。
1.3.2 关键挥发性风味物质含量测定
采用动态顶空法萃取样品挥发性风味物质,气质联用法 (gas chromatography-mass spectrometry,GCMS)对萃取的成分进行鉴定,再通过动态顶空稀释法(dynamic headspace dilution analysis,DHDA)结合嗅闻检测技术对关键挥发性成分进行分析确定,参考马艳莉等[6]方法。
1.3.3 γ-氨基丁酸(GABA)含量测定方法
使用高效液相色谱法 (high performance liquid chromatography,HPLC)法测定样品中GABA含量,参考Pyo等[7]的方法,略有改动。
1.3.3.1 样品提取液制备
称取0.50 g冻干粉样品于离心管中,加入5.0 mL质量分数为10%的三氯乙酸,涡旋振荡1 min,然后在40℃水浴中振荡提取2 h,10 000 r/min离心15 min,上清液经0.45 μm滤膜过滤,得到样品提取液备用。
1.3.3.2 样品柱前衍生
将邻苯二甲醛(OPA)10 mg,β-巯基乙醇 20 μL 溶于2.5 mL乙腈中,得到OPA衍生试剂。吸取0.4 mol/L硼酸缓冲液(pH 10.4)400 μL,OPA 衍生试剂 80 μL,样品提取液80 μL,混合均匀后室温(25℃左右)反应5 min,衍生后取20 μL进HPLC检测。
1.3.3.3 HPLC检测条件
C18 色谱柱:4.6 mm×150 mm×5 μm;流动相:20%乙腈的醋酸钠缓冲液;流速:0.8 mL/min;检测波长:254 nm;柱温:40℃。
1.3.4 丁酸含量测定方法
使用HPLC法测定样品中丁酸含量,参考Zhang等[8]的方法,略有改动。
1.3.4.1 样品提取液制备
称取样品冻干粉0.50 g于50 mL离心管中,加入40 mL蒸馏水,超声振荡30 min,8 000 r/min离心20 min,取上清液,过0.45 μm滤膜制得样品提取液。
1.3.4.2 HPLC检测条件
色谱柱:Shimadzu SCR-101(H)7.9 mm×300 mm;流动相:5 mmol/L的硫酸水溶液;柱温:40℃;流速:1.0 mL/min;检测波长:210 nm。
1.3.5 乙酰胆碱酯酶(AchE)抑制活性测定方法
采用Ellman光度检测法测定样品AchE抑制活性,参照Ellman等[9]的方法,略有修改。
1.3.5.1 样品提取液制备
称取样品冻干粉0.50 g,加入5 mL 80%乙醇溶液,16 000 r/min均质1 min,超声提取20 min,常温(25℃左右)振荡提取1 h,沸水浴15 min,4 000 r/min离心15 min,取上清液过0.45 μm滤膜,得到样品提取液备用。
1.3.5.2 AchE抑制活性测定方法
在96孔酶标板中加入150 μL磷酸盐缓冲液(0.1 mol/L,pH 8.04),30 μL 不同稀释浓度的样品提取液,阴性和阳性对照中以30 μL磷酸盐缓冲液代替,然后加入 50 μL DTNB (756 μmol/L),20 μL 稀释后的AchE酶液(0.54 U/mL),阴性对照不加酶液,以磷酸盐缓冲液代替,微孔板振荡器上混合均匀后,置于37℃培养箱中保温5 min,取出后在所有微孔中加入50 μL底物(3 mmol/L),振荡混合均匀,用酶标仪测定样品动力学速率。酶标仪设为动力学测定模式,检测波长405 nm,连续读数10次,每次测定间隔28 s,振荡3 s,抑制率的计算公式为:
抑制率/%=(K阳性对照-K样品)/(K阳性对照-K阴性对照)×100
1.3.6 血管紧张素转换酶(ACE)抑制活性测定方法
ACE抑制活性测定参考Li等[10]的方法,略有改进。
1.3.6.1 样品提取液制备
称取0.50 g样品冻干粉于离心管中,加入5.0 mL蒸馏水,振荡混匀。15 000 r/min均质2 min,超声提取5 min,再于室温(25℃左右)下摇床振荡提取1 h。将上述样液沸水浴15 min,5 000 r/min离心10 min,上清液过0.45 μm滤膜,得到样品提取液备用,其浓度标记为100 mg/mL。
1.3.6.2 ACE抑制活性测定方法
将样品提取液适当稀释,在96孔酶标板上将20 μL样液(无抑制的反应液中以蒸馏水代替)与40 μL 4.66 mmol/L的底物溶液混合,然后加入40 μL 12.5 mU/mL的酶液(对照液中以蒸馏水代替),在微孔板混合器上混匀后置于37℃恒温箱中反应1 h,然后加入150 μL 1.2 mol/L NaOH溶液终止酶反应。接着在反应液中加入40 μL 2%的OPA溶液,混合均匀,室温(25℃左右)下静置20 min后加入40 μL 6 mol/L的HCl溶液终止衍生反应。将上述溶液适当稀释后,在30 min~90 min内测定荧光吸收强度,条件如下:激发波长340 nm;发射波长455 nm;狭缝宽度5 nm。样液的ACE抑制活性计算公式如下:
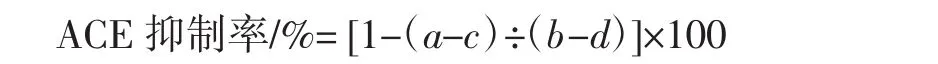
式中:a为抑制剂与ACE都存在时对荧光的吸收强度;b为抑制剂不存在,而ACE存在时对荧光的吸收强度;c为抑制剂存在而ACE不存在时的荧光吸收强度;d为抑制剂与ACE都不存在时的荧光吸收强度。
ACE抑制率越大,说明抑制剂在该浓度条件下抑制ACE活性的能力越强。以抑制剂浓度的对数值为横坐标,以抑制率为纵坐标,绘制回归曲线,计算抑制率达到50%时抑制剂的浓度,即为半抑制浓度,记为IC50。IC50值越小,代表抑制剂对ACE活性抑制能力越强。
1.3.7 多肽含量测定方法
样品多肽含量测定参照Church等[11]的方法。
1.3.8 数据处理方法
采用SPSS 16.0软件对所得数据进行方差分析,显著水平为P<0.05。
2 结果与分析
2.1 低盐腐乳关键挥发性风味物质相对含量研究
使用GC-MS法对低盐腐乳风味物质进行测定,对照前期研究基础[12]鉴定的青方腐乳关键挥发性风味物质,发现大多数关键性风味物质在低盐腐乳中被检测到,所以进一步使用内标物2-甲基3-庚酮对低盐腐乳关键挥发性风味物质进行相对定量,其相对含量如表1所示。
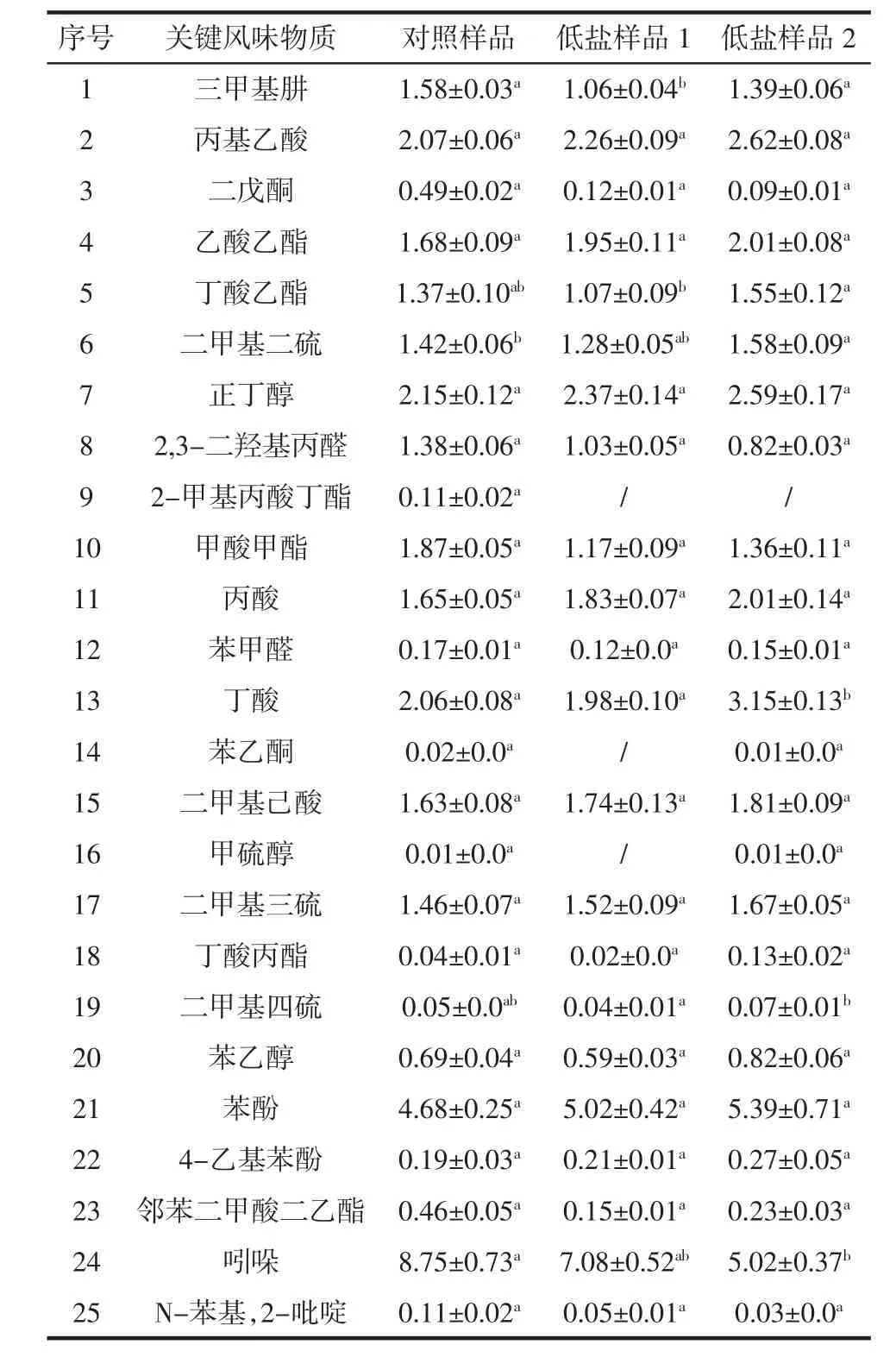
表1 低盐腐乳关键挥发性风味物质相对含量Table 1 Relative content of key flavor compounds in low-salt sufu μg/g
与对照样品相比,低盐样品中部分关键风味物质相对含量降低,特别是低盐样品1降低更明显,可能导致低盐样品1特征性风味有所改变。低盐样品2中一些风味物质相对含量也有所降低,特别是吲哚相对含量降低明显,与对照和低盐样品1有显著性差异。吲哚是一种亚胺类物质,高浓度时有强烈的臭味,并对人体产生一定危害,某些有害菌,如大肠埃希菌、变形杆菌、霍乱弧菌等能分解色氨酸生成吲哚。低盐样品2中吲哚相对含量降低可能与其后发酵汤料中添加益生菌有关,乳酸杆菌和丁酸梭菌可能会抑制致病菌及腐败菌的生长繁殖,进而抑制这些有害菌代谢产物产生,进而降低了吲哚等胺类物质的相对含量。
2.2 低盐腐乳GABA含量和丁酸含量研究
对低盐样品GABA含量研究结果如图1所示。
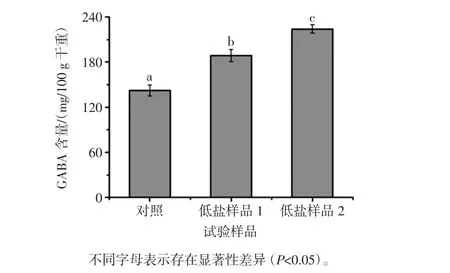
图1 低盐腐乳GABA含量Fig.1 GABA content of low-salt sufu
低盐样品GABA含量分别达188.92 mg/100 g干重和223.95 mg/100 g干重,为对照样品的1.33倍和1.57倍,由此可见,低盐发酵提高了样品的GABA含量,推测原因有以下几方面:首先,低盐腐乳样品使用乳酸菌发酵豆坯制作,乳酸菌发酵提高食品GABA含量已有大量报道[13-14]。因此,由于乳酸菌的作用,低盐腐乳豆坯中GABA含量可能已高于对照中的卤水豆坯。其次,本研究中低盐腐乳生产不经历盐腌过程,有利于GABA的合成,并且在一定程度上会减少GABA随坯体中水分流失而减少。在两种低盐样品中,后发酵添加乳酸菌和丁酸梭菌的低盐样品2中GABA含量明显高于未添加的样品1,进一步说明了乳酸菌对GABA合成具有促进作用。对低盐腐乳丁酸含量测定结果如图2所示。
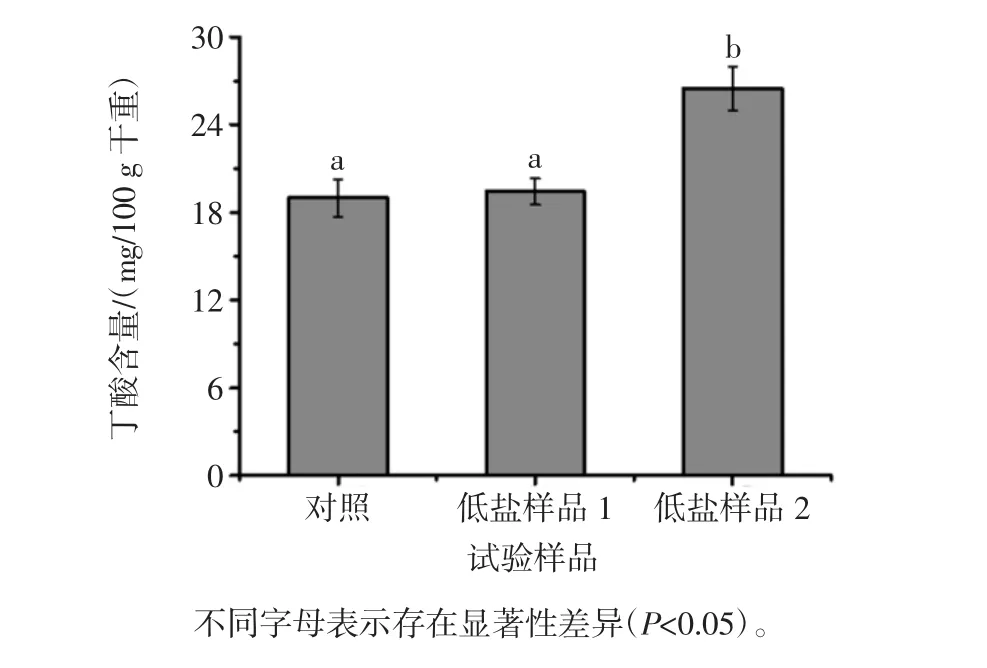
图2 低盐腐乳丁酸含量Fig.2 Butyrate content of low-salt sufu
低盐样品1丁酸含量与对照没有显著性差异(P>0.05),而低盐样品2丁酸含量大约比对照增加了39.46%,表明腐乳后酵汤料中添加丁酸梭菌可以提高丁酸含量。
2.3 低盐腐乳乙酰胆碱酯酶抑制活性研究
阿尔兹海默症患者大脑内的神经递质-乙酰胆碱的缺失是引起该疾病的关键因素,乙酰胆碱酯酶(acetylcholinesterase,AchE)可以催化乙酰胆碱发生裂解反应,引起乙酰胆碱缺失,因此,抑制AchE活性可以预防阿尔兹海默症的发生[15]。发酵豆制品作为发酵食品的重要组成部分,其AchE抑制活性也被关注,Liu等[16]调查了19种市售豆豉样品,发现其不同程度地存在AchE抑制活性。前期试验证实青方腐乳具有乙酰胆碱酯酶(AchE)抑制活性,且其活性高于所测定的其他类型腐乳,本研究对益生菌发酵生产的低盐腐乳AchE抑制活性进行测定,结果如图3所示,益生菌发酵低盐样品具有AchE抑制活性,但是与对照无显著性差异(P>0.05)。
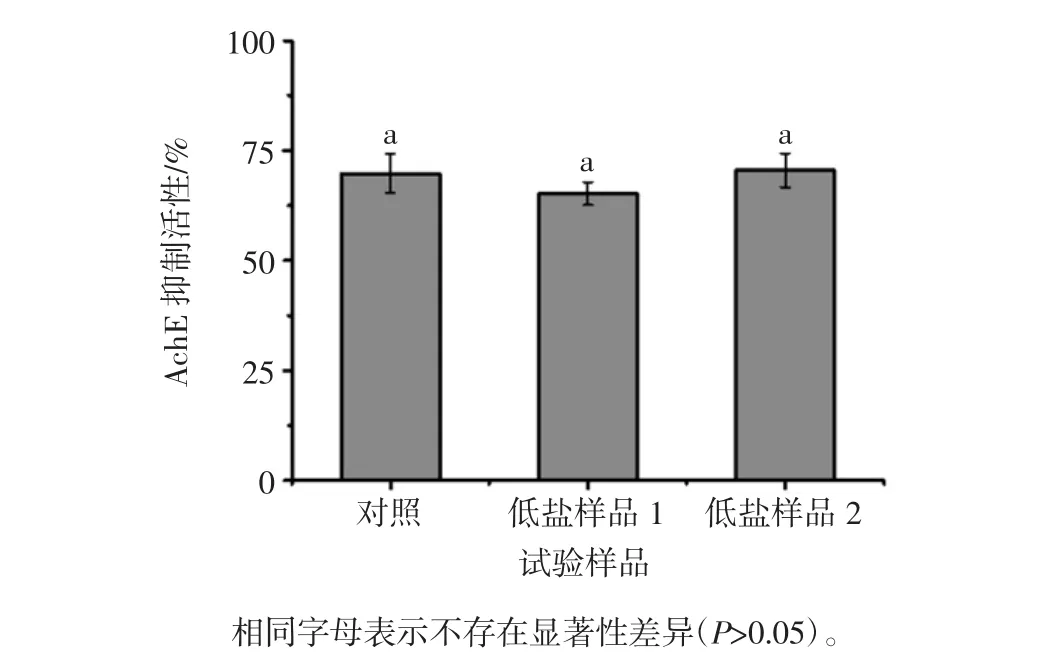
图3 低盐腐乳乙酰胆碱酯酶抑制活性Fig.3 Acetylcholinesterase inhibitory activity of low-salt sufu
2.4 低盐腐乳血管紧张素转换酶抑制活性和多肽含量
血管紧张素转换酶(angiotensinconverting enzyme,ACE)可以催化无活性的血管紧张素Ⅰ转化为刺激血管收缩、引起血压升高的血管紧张素Ⅱ。ACE抑制剂可以抑制ACE活性,从而减少血管紧张素Ⅱ的形成,达到防治高血压的目的[17]。研究表明,腐乳具有ACE抑制活性[18],目前,腐乳ACE抑制活性被认为由多肽引起,这些ACE抑制肽能抑制ACE活性,防止血管平滑肌收缩,起到降压作用,并且不会引起正常血压降低。对低盐腐乳血管紧张素转换酶(ACE)抑制活性和多肽含量进行研究,结果如图4所示。
低盐腐乳ACE抑制活性和多肽含量均显著高于对照(P<0.05),其中低盐样品2具有最高ACE抑制活性,后发酵45 d时,其ACE抑制活性达84.66%,同时,其多肽含量也高于对照和低盐样品1。在前期对使用传统方法生产的青方腐乳发酵过程中ACE抑制活性和多肽含量进行研究时发现,降低食盐含量并控制发酵时间有助于ACE抑制活性和多肽含量增加,本研究中生产的低盐腐乳降低了食盐含量并把发酵时间控制在45 d。所以,其ACE抑制活性和多肽含量增加可能与该生产工艺改进相关。此外,本研究中低盐腐乳2生产过程去除盐腌过程,且后发酵添加益生菌,这些工艺的改进均有可能促进ACE抑制活性的提高。
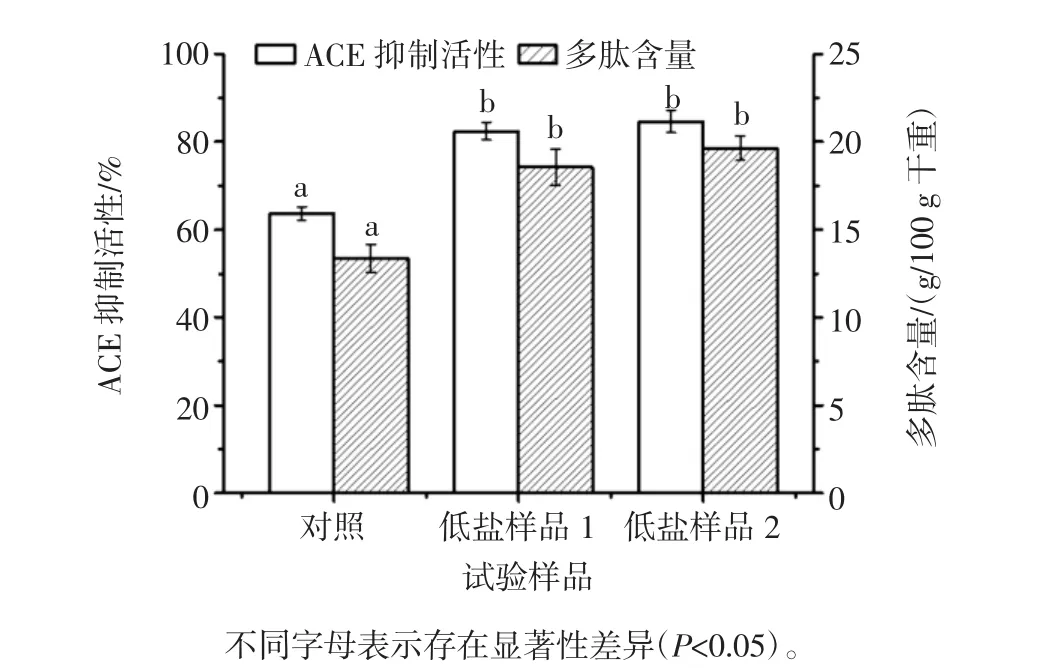
图4 低盐腐乳血管紧张素转换酶抑制活性和多肽含量Fig.4 Angiotensin-converting enzyme inhibitory activity and peptide content of low-salt sufu
3 结论
后发酵汤料中添加益生菌会抑制致病菌及腐败菌的生长繁殖,一定程度上提高青方腐乳的食用安全性和功能性。后酵汤料添加益生菌发酵可降低吲哚相对含量等胺类物质的相对含量,明显提高低盐腐乳样品中GABA和丁酸含量,低盐样品GABA含量为对照样品的1.33倍和1.57倍,丁酸含量大约比对照增加了39.46%,益生菌发酵低盐腐乳具有乙酰胆碱酯酶抑制活性,但是与对照无显著差异(P<0.05),其血管紧张素转换酶抑制活性和多肽含量与对照相比有显著提高(P<0.05),说明益生菌低盐发酵对不同功能性的影响存在差异。

