美藤果油和普洱茶籽油的主要脂肪酸组成及氧化动力学研究
张丽,杨志,邹维,熊华斌,高云涛,2,3,*
(1.云南民族大学化学与环境学院,云南昆明650500;2.云南民族大学云南省跨境民族地区生物质资源清洁利用国际联合研究中心,云南昆明650500;3.云南民族大学生物基材料绿色制备技术国家地方联合工程研究中心,云南昆明650500)
美藤果(sacha inchi),又名星油果、星油藤、印加果,属大戟科多年生木质藤本植物。美藤果原产于南美洲的安第斯山脉地区,如秘鲁和厄瓜多尔[1]。我国云南普洱、西双版纳于2006年开始引进种植美藤果,已在西双版纳建成世界最大的美藤果油工厂。美藤果主要用于榨制美藤果油,美藤果油因其不饱和脂肪酸(ω-3、6、9)含量可达90%以上,是目前已知不饱和脂肪酸含量最高的植物油之一[2],摄入美藤果油具有预防心脑血管疾病、降低血糖和血脂的作用,因此日益受到关注。此外,当地具有丰富的普洱茶籽资源,普洱茶籽是山茶科植物普洱茶(Camellia Sinensis O.Ktze.)的果实,从普洱茶籽中榨制的普洱茶籽油的油酸含量超过60%,其脂肪酸组成与橄榄油相似,被誉为“东方橄榄油”[3]。它具有抗凝血、调节血脂、防止动脉粥样硬化斑块形成、降低胆固醇等作用[4],越来越受到人们的青睐。目前,当地已建成年产达10万吨以上的普洱茶籽油生产基地。
由于植物油中含有较多的不饱和脂肪酸,因此在光照和氧气的作用下,植物油容易发生氧化、裂解、聚合等反应而氧化酸败[5]。如果人体摄入氧化酸败的油脂,会对人体消化系统、生物膜、心脏等造成损害[6]。目前,国内外研究油脂氧化程度的方法主要有Schall烘箱法、Rancimat法、气相色谱法(gas chromatography,GC)等[7]。刘付英等[8]用过氧化值和酸值研究了美藤果油的氧化过程,发现在低温、干燥、黑暗环境中贮藏可降低美藤果油的氧化程度。Vicente J[9]、张和平等[10]用Schall烘箱法测定美藤果油不同贮藏条件下的过氧化值,推算了美藤果油的货架期,并研究了外加抗氧化剂的影响。
热重分析法(thermogravimetric analysis,TGA)是一种在程控下,测量温度升高,温度下降或恒温期间样品重量变化的方法。可用于评估油脂的热氧化稳定性,具有操作简单快速、所需样品量少、可精确记录样品的重量变化等优点,张巧智等[5]用热重分析法研究了橄榄油、葡萄籽油、大豆油等常见植物油的氧化过程,并推导出其动力学方程,美藤果油和普洱茶籽油氧化动力学的热重分析法鲜见报道。本文以版纳和普洱等地产的美藤果油和普洱茶籽油为研究对象,采用热重分析法测定两种植物油在不同升温速率下的起始氧化温度和氧化峰值温度,计算动力学参数如活化能、前指数因子,并结合气相质谱联用技术(gas chromatography-mass spectrometry,GC-MS) 测定两种植物油的脂肪酸组成。
1 材料与方法
1.1 试验材料与仪器
美藤果油:云南省西双版纳印奇生物资源开发有限公司;普洱茶籽油:云南省普洱健源油脂有限公司。正己烷(色谱级)、无水甲醇(色谱级)、氢氧化钾(分析纯):天津市风船化学试剂科技有限公司;蒸馏水:云南民族大学化学与环境学院实验室自制。
STA449 F3型同步热分析仪:德国耐驰仪器制造有限公司;KO733B730000080气相质谱联用仪:美国赛默飞世尔科技公司。
1.2 试验方法
1.2.1 植物油脂肪酸组成的分析
样品甲酯化[11]:分别称取0.3 g美藤果油和普洱茶籽油置于两个25mL比色管中,加入10 mL正己烷溶解油脂,再加入0.5 mL浓度为0.112 g/mL的KOH-CH3OH溶液,摇匀,萃取3 h,取正己烷相进行分析。
色谱条件:色谱柱:DB-WAX(30m×0.25m×0.25μm)毛细管色谱柱;进样口温度:250℃;柱初始温度80℃,以20℃/min升到200℃,8℃/min升到217℃,0.5℃/min升到220℃,最后以15℃/min升至250℃,保留3 min;进样量 1.0 μL;载气流速 1.5 mL/min;分流比为 60 ∶1;高纯氦气(纯度>99.999%)。质谱条件:使用电子轰击离子源(electron bombardment ion source,EI)的电离方法;传输线温度280℃;离子源温度260℃;电子能量70 eV;质量扫描范围 30 m/z~500 m/z。
1.2.2 起始氧化温度(Ton)和氧化峰值温度(Tp)的测定
准确称量3.0 mg样品置于坩埚中,放入同步热分析仪加热炉,以O2为吹扫气氛,N2为保护气氛,气体流速为 100 mL/min。分别以不同升温速率(5、10、15、20℃/min)升至600℃,测得热重曲线,记录温度或时间的一阶导数可以获得相应的微商热重曲线,曲线偏离基线时的温度是起始氧化温度Ton,在曲线出峰后第一次下降到最低点时的温度是氧化峰值温度Tp[12]。
1.2.3 动力学参数的推导
参照SouLtani S等[13]研究中的Ozawa-Flynn-Wall和Arrhenius方程,对美藤果油和普洱茶籽油的动力学参数进行推导。
1.2.4 数据处理
采用Origin Pro 8.5软件拟合动力学曲线,SPSS 19.0统计分析软件进行差异显著性分析。
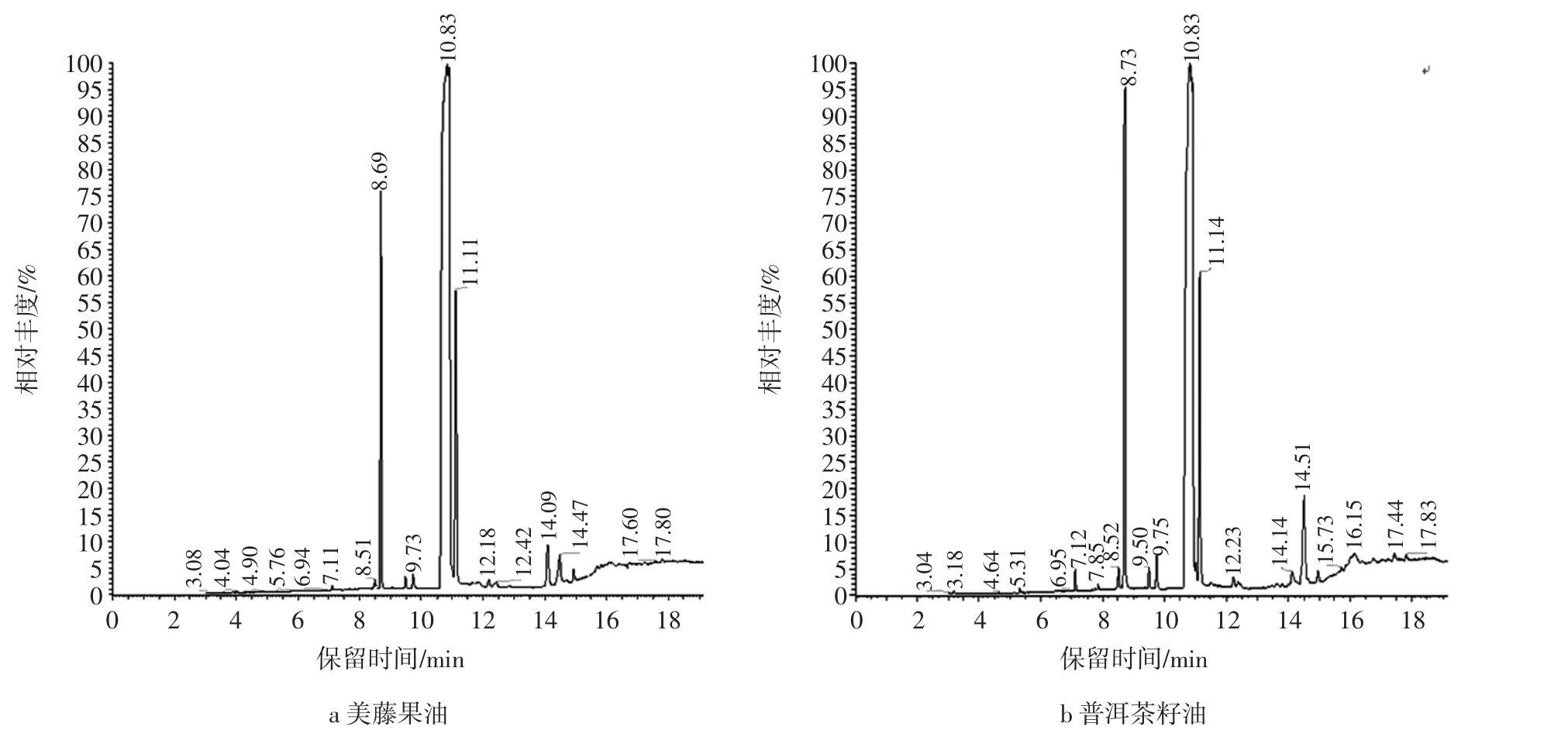
图1 美藤果油和普洱茶籽油的总离子流图Fig.1 Total ion current spectrum of sacha inchi oil and Puer tea seed oil
2 结果与讨论
2.1 美藤果油和普洱茶籽油脂肪酸组成的分析
通过GC-MS法分析两种植物油,获得美藤果油和普洱茶籽油的总离子流色谱图,结果如图1所示。
人工解析每个色谱峰对应的质谱图,并进行计算机检索,确定其化学结构,分别鉴定出7种主要的脂肪酸,并通过峰面积归一化法来确定其相对含量,结果见表1。
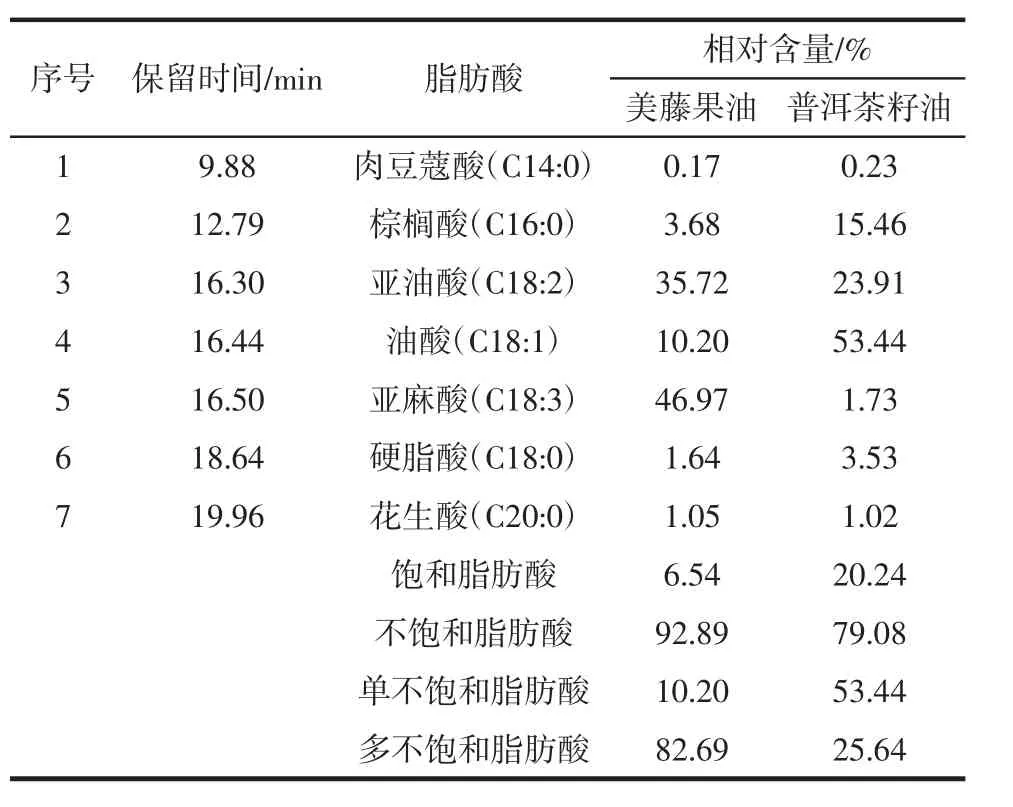
表1 两种植物油的脂肪酸组成及相对含量Table 1 Composition of fatty acid and relative content of two vegetable oils
从表1可以看出,美藤果油主要由亚麻酸(46.97%)、亚油酸(35.72%)、棕榈酸(3.68%)和硬脂酸(1.64%)等脂肪酸组成,不饱和脂肪酸含量为92.89%,显著高于其他常见植物油,如橄榄油(83.20%)和芝麻油(80.17%)[14]。棕榈酸(15.46%)、亚油酸(23.91%)、油酸(53.44%)是普洱茶籽油的主要脂肪酸组成。美藤果油中亚麻酸含量最高,为46.97%,普洱茶籽油中油酸含量最高,为53.44%。亚麻酸和亚油酸是人体必需的营养物质,具有提高智力、促进营养吸收、抗癌和降血压的作用,油酸在软化血管和调节人体的生理功能中起重要作用。对于植物油,其氧化速度与脂肪酸的不饱和程度有关,不饱和程度越高,油脂越容易发生氧化。
2.2 确定起始氧化温度(Ton)和氧化峰值温度(Tp)
通过程序升温法在不同的升温速率(5、10、15、20℃/min)下测定两种植物油的氧化分解温度,结果见图2。
从图2可以看出,热解过程的变化分为3个阶段:第一阶段曲线比较平坦,在温度升高的情况下,质量几乎不变化,这个主要是饱和与不饱和脂肪酸链的降解,在此阶段,植物油还未能充分进行氧化[7]。第二阶段变化非常快,迅速失重,说明达到分解温度时它就快速分解,对应挥发性物质的挥发与氧化。第三阶段曲线变化较小,较为平稳,主要是碳质残渣的反应[15]。根据图2a和图2b,利用基线外推计算法[16]求得美藤果油和普洱茶籽油在不同升温速率下的分解温度,以美藤果油在升温速率为5℃/min的曲线为例,结果如图3所示。

图2 美藤果油的热重曲线与普洱茶籽油的热重分析曲线Fig.2 The TGA curve of sacha inchi oil and Puer tea seed oil
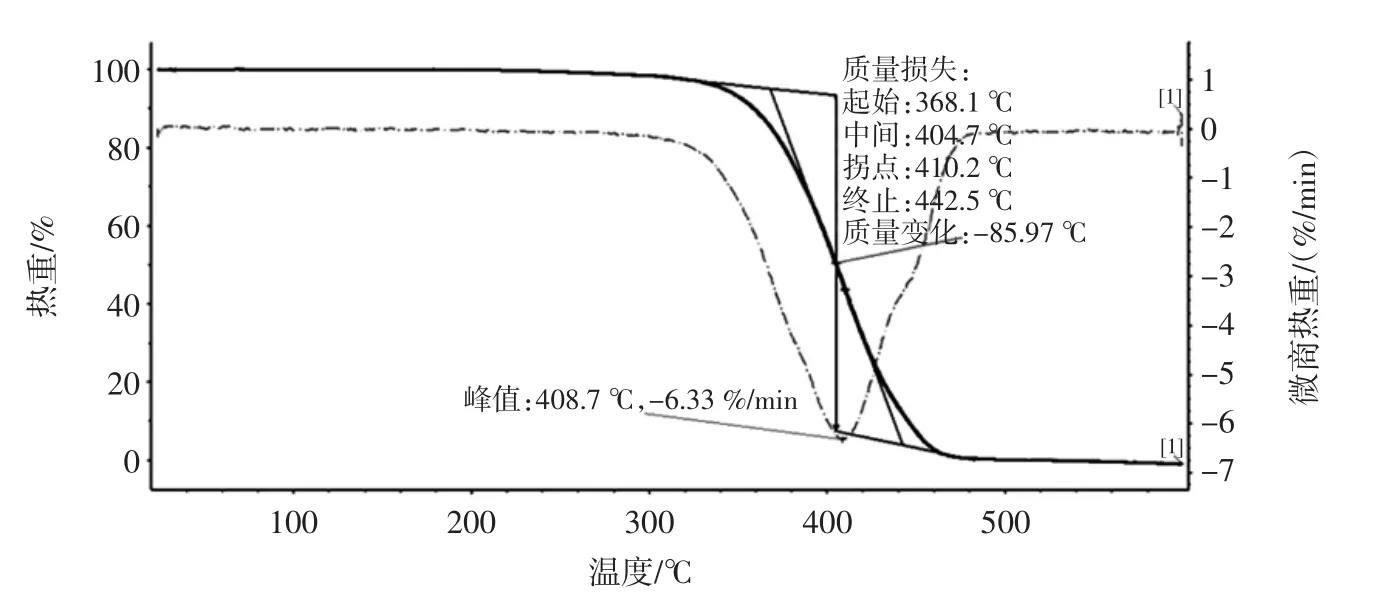
图3 美藤果油起始(峰值)氧化温度的确定Fig.3 Determination of onset(peak)oxidation temperature of sacha inchi oil
从图3可以看出,美藤果油的起始氧化温度Ton为368.1℃,氧化峰值温度Tp为408.7℃。以此类推,可以获得两种植物油在不同升温速率下的起始氧化温度Ton和氧化峰值温度Tp,结果见表2。

表2 不同升温速率下植物油的起始(峰值)氧化温度Table 2 Onset(peak)oxidation temperature of vegetable oil at different heating rates
从表2可以看出,两种油的起始(峰值)氧化温度,随着升温速率的增加而增加,以起始氧化温度Ton为例:美藤果油:368.1℃(5℃/min)<391.0℃(10℃/min)<397.7℃(15℃/min)<406.9℃(20℃/min),普洱茶籽油:371.1℃(5℃/min)<388.5℃(10℃/min)<397.9℃(15℃/min)<410.2℃(20℃/min),但在个别高升温速率(15℃/min)下,美藤果油的Tp值反而降低,造成这种现象是因为植物油的热分解速率较快,产生的挥发性物质没有及时排到坩埚外,使样品质量变化没有规律。根据已有文献报道,Ton可以表征植物油对热氧化分解的耐受性,Tp与氧化终止过程有关[17]。在相同的升温速率下,两种植物油的氧化分解温度几乎一致,升温速率越快,分解温度越高,氧化稳定性逐渐增强。
2.3 动力学参数的求解
在非等温条件下,吹扫气氛O2始终处于过量的状态,可以忽略油脂氧化过程中O2的消耗。两种植物油的动力学参数计算采用Ozawa-Flynn-Wall等[18]转化率方程,将植物油在不同升温速率下的Ton或Tp分别代入方程:

式中:β 为升温速率,℃/min;T 为 Ton或 Tp,K。

式中:R摩尔气体常数,为8.314 J/(mol.k)。
以log β对起始氧化温度1/Ton或氧化峰值温度1/Tp作图,得到相应植物油的线性曲线。以美藤果油为例,图4为log β与1/Ton之间的关系曲线。
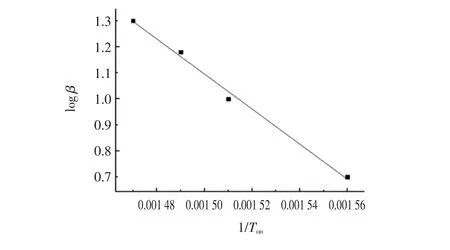
图4 美藤果油起始氧化温度与升温速率之间的线性关系Fig.4 Relationship between onset oxidation temperature and heating rates of sacha inchi oil
可以看出,美藤果油具有很好的线性关系。对拟合曲线中的每个点进行回归拟合,log β与1/Ton之间的关系可以用方程y=-6.7813 x+11.264来表示,决定系数为0.972 8(表3)。除个别情况外,普洱茶籽油的R2也大于0.94(表4),根据公式,求解得到的动力学参数见表3和表4。
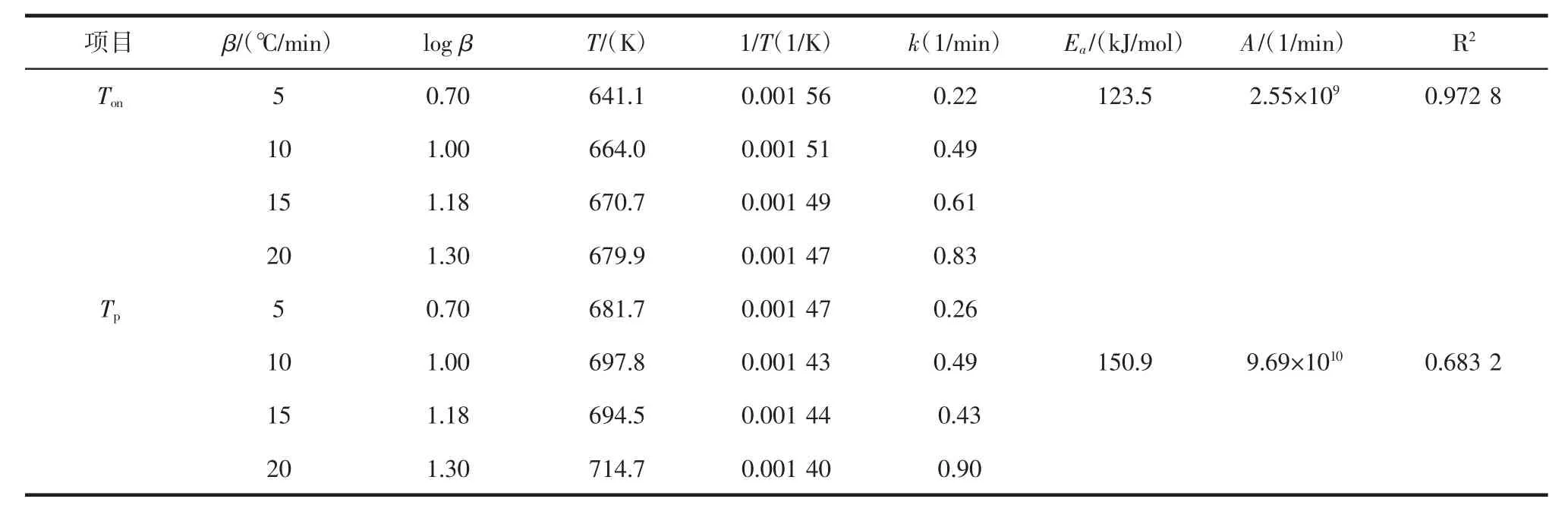
表3 美藤果油的动力学参数计算值Table 3 Value of kinetic parameters of sacha inchi oil
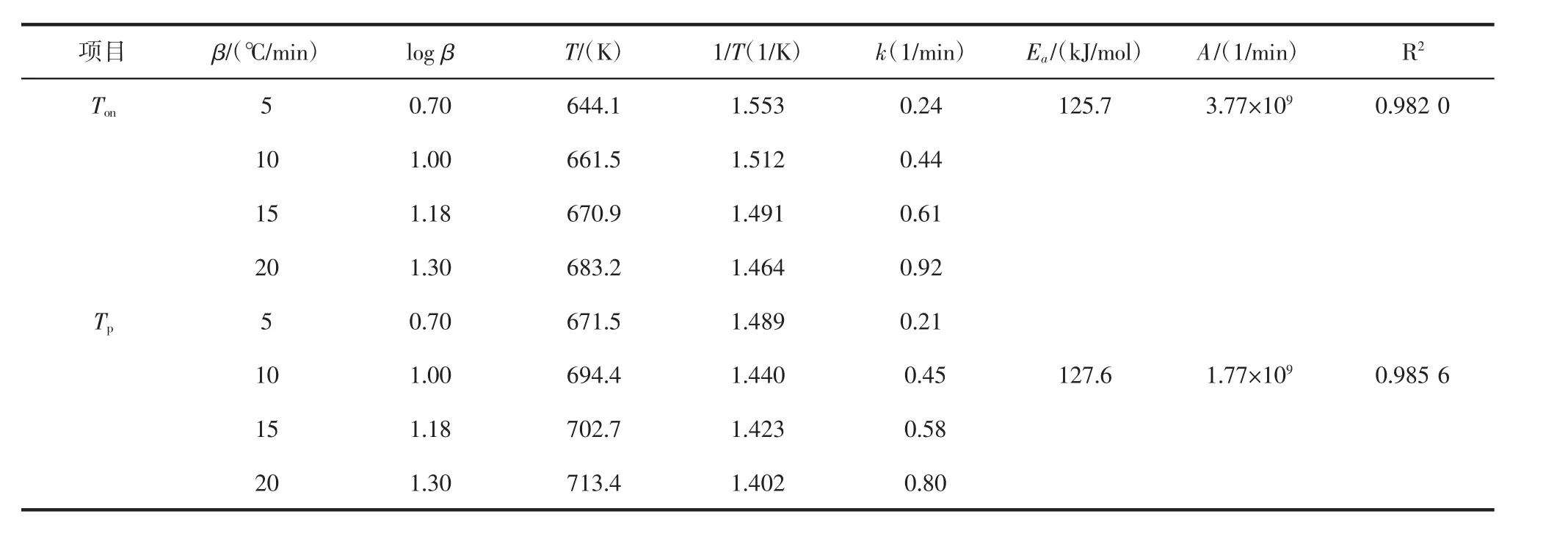
表4 普洱茶籽油的动力学参数计算值Table 4 Value of kinetic parameters of Puer tea seed oil
两种植物油在Ton处的活化能(Ea)分别为:美藤果油,123.5 kJ/mol;普洱茶籽油,125.7 kJ/mol。在 Tp处的活化能(Ea)分别为:美藤果油 150.9 kJ/mol;普洱茶籽油127.6 kJ/mol。这与Ton处的活化能高低略有差异。
2.4 美藤果油和普洱茶籽油与其他植物油动力学参数的比较
比较美藤果油和普洱茶籽油与其他常见植物油的 Ton、Tp、Ea,结果见表 5。方差分析见表 6。
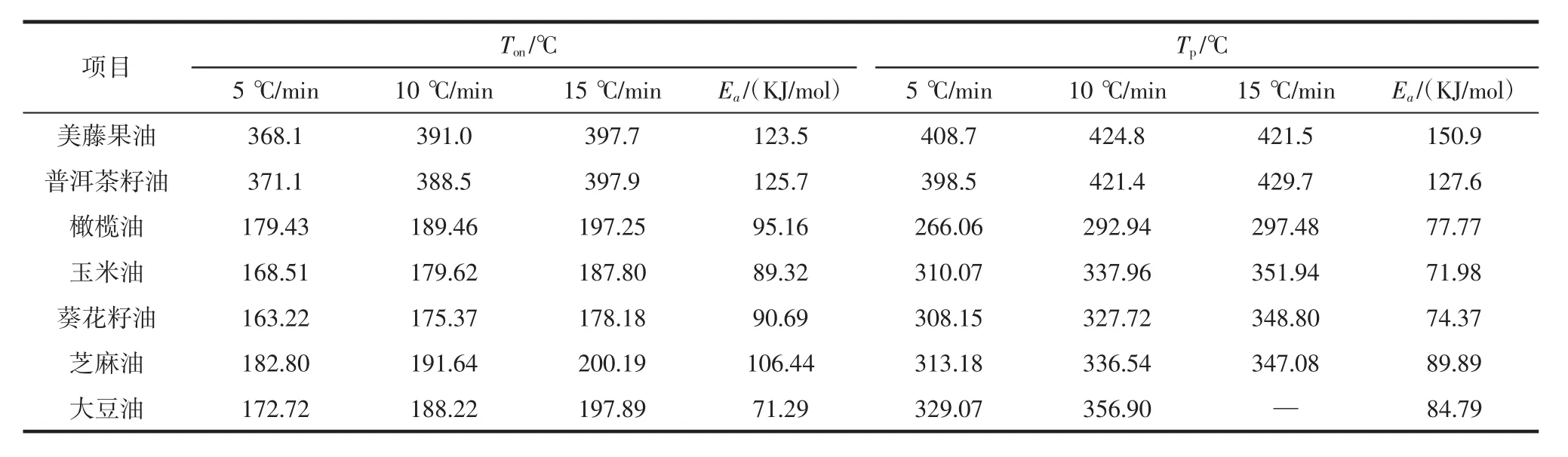
表5 美藤果油和普洱茶籽油与其他植物油[5]动力学参数的比较Table 5 Comparison of kinetic parameters of sacha inchi oil and Puer tea seed oil with other vegetable oils[5]
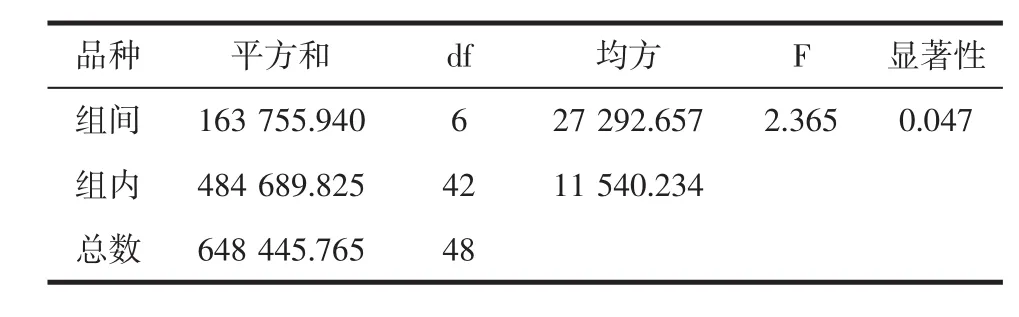
表6 方差分析Table 6 Analysis of variance
上述动力学参数的比较和方差分析的研究表明,不同品种的植物油存在明显差异。无论在哪一升温速率下,美藤果油和普洱茶籽油的起始氧化温度Ton和氧化峰值温度Tp均明显高于其他植物油。例如:在升温速率为5℃/min时,美藤果油和普洱茶籽油的起始氧化温度Ton分别为368.1℃和371.1℃,均是橄榄油、芝麻油、玉米油、葵花籽油和大豆油的两倍多。美藤果油和普洱茶籽油的氧化峰值温度Tp分别为408.7℃和398.5℃,也明显高于橄榄油(266.06℃)、玉米油(310.07℃)、葵花籽油(308.15℃)、芝麻油(313.18℃)、大豆油(329.07℃)。从表5可以看出,升温速率越快,上述7种植物油的分解温度越高,氧化稳定性逐渐增强。对于植物油的氧化过程,活化能可评价其氧化稳定性,以活化能的高低评价植物油的氧化稳定性从高到低排序,Ea(Ton)为:普洱茶籽油>美藤果油>芝麻油>橄榄油>葵花籽油>玉米油>大豆油;Ea(Tp)为:美藤果油>普洱茶籽油>芝麻油>大豆油>橄榄油>葵花籽油>玉米油,普洱茶籽油和美藤果油与其他常见植物油相比,具有更好的热稳定性。虽然美藤果油含有较高的不饱和脂肪酸,如亚麻酸(46.97%)和亚油酸(35.72%),容易导致氧化酸败,但是,根据已有文献报道,其抗氧化活性成分维生素E含量高达177.9 mg/100 g~208.12 mg/100 g,明显高于大豆油(80.45 mg/100 g~124.66 mg/100 g)、玉米油(68.46 mg/100 g~109.77 mg/100 g)[19]。茶籽油主要含油酸(53.44%)、亚油酸(23.91%),而维生素E的含量也同样高达180 mg/100 g[20]。维生素E是重要的天然抗氧化剂,能有效预防和减缓植物油的氧化,起到协同增效的作用,因此两种植物油呈现出更好的热稳定性可能与其含有较高的维生素E有关。
3 结论
本研究表明,美藤果油主要成分为亚麻酸46.97%、亚油酸35.72%,不饱和脂肪酸达92.89%,明显高于橄榄油(83.20%)、芝麻油(80.17%)等常见植物油。普洱茶籽油主要成分为油酸53.44%、亚油酸23.91%,有助于增强人体免疫力、防治心血管疾病等作用。从热重分析结果得出,随着升温速率的增加,氧化起始(峰值)温度也随之增高,Ton处的活化能分别为:美藤果油123.5 kJ/mol;普洱茶籽油125.7 kJ/mol。在Tp处的活化能分别为:美藤果油150.9 kJ/mol;普洱茶籽油127.6 kJ/mol,均明显高于其他常见植物油。虽然这两种植物油含有较高的不饱和脂肪酸,但具有较好的热稳定性,可能是由于其维生素E的含量较高,起到协同保护作用。美藤果油和普洱茶籽油不仅亚麻酸、油酸、维生素E等营养物质含量高,而且热氧化稳定性较强,在化妆品、食品等领域都具有较好的开发应用前景。

