青蟹对As和Cd的生物富集动力学特性
乔艺飘,张龙飞,刘欢,娄晓祎,黄冬梅,黄宣运,韩峰,史永富,*
1. 中国水产科学研究院东海水产研究所,农业农村部水产品质量监督检验测试中心(上海),上海 200090 2. 上海海洋大学食品学院,上海 201306 3. 中国水产科学研究院,农业农村部水产品质量安全重点实验室,北京 100141
拟穴青蟹(Scyllaparamamosain)属节肢动物门(Arthropoda),甲壳纲(Crustacea),十足目(Decapoda),梭子蟹科(Portunidae),青蟹属(Scylla),其环境适应性强,生长速度快。在印度洋地区以及日本、泰国和菲律宾等国家均有分布,在中国主要分布在浙江、广东、广西和福建等沿海地区[1]。青蟹已成为中国重要的海洋经济动物,2018年,海水养殖青蟹面积23 129 hm2,养殖产量达15.77万t[2]。但随着近年来工农业的迅速发展,城市生活污水、工业废水以及矿山开采和金属冶炼等所产生的污染物通过不同方式排入水体中,使水体中的重金属浓度急剧升高。养殖水体也受到较大影响,进而导致养殖水产品受到重金属的污染[3]。
甲壳类生物比其他水产品具有更强的重金属富集能力,这点已有诸多研究证实,如陈伟珍等[4]对湛江市售鱼类与甲壳类海产品重金属浓度研究发现,甲壳类受镉(Cd)污染较严重;施沁璇[5]研究钱塘江流域杭州段水产动物中重金属分布特征并进行了安全性评价,发现甲壳类中铜(Cu)和Cd的浓度显著高于其他品种。此外,海洋生态系统被称为全球砷(As)循环的“As库”,海水中As的浓度最高可达24 μg·L-1[6]。As进入水生生物体内后不断累积富集,导致许多鱼类、甲壳类生物体As浓度高至10~100 mg·kg-1(湿重)[7]。As和Cd可与含有巯基(—SH)的大分子基团紧密结合成金属螯合物,抑制酶活性,阻碍细胞的呼吸和氧化功能,干扰机体生理生化多方面的活动,具有致畸致癌性[8-9]。
因此,近年来对重金属在海洋生物体内的富集动力学研究引起了国内外学者们的持续关注。双箱动力学模型作为应用最广泛的经典模型之一,可以较好地反映暴露条件下水生生物对重金属的富集特征,在水生生物中已有较多的应用报道[10-11],包括大型海藻如龙须菜(Gracilarialemaneiformis)[12],贝类如斑马贻贝(Dreissenapolymorpha)[13]、褶牡蛎(Alectryonellaplicatula)[14]等,鱼类如黑鲷鱼(Acanthopagrusschlegeli)[15],蟹类如中华绒螯蟹(Eriocheirsinensis)[16]以及其他淡水大型无脊椎动物和水生植物[17]对重金属的富集动力学研究。青蟹作为重要的海洋经济动物之一,目前尚未见到重金属在其体内的富集与释放特性的相关报道。该研究以拟穴青蟹为研究对象,使用双箱动力学模型,对As和Cd的富集与释放过程的双曲线拟合,探讨了As和Cd在青蟹体内不同组织器官(肌肉、肝胰腺和蟹腮)随暴露浓度的变化特征及其富集动力学参数,以系统地认识其动力学特性,为海洋环境质量评价和生态风险评估提供参考,同时也可为青蟹安全生产提供科学依据。
1 材料与方法(Materials and methods)
1.1 材料
1.1.1 实验动物
2019年5月拟穴青蟹采自上海市东方国际水产市场,其产地为广西南宁合浦县山口镇养殖场,数量200只,体重(150±13.7) g,壳长(95±4.8) mm,壳宽(75±3.7) mm。实验前暂养一周,保持充氧,每天投喂新鲜花蛤,挑选健康的拟穴青蟹为实验生物。
1.1.2 实验用水及容器
海水晶(上海保嘉工贸有限公司),按比例配制盐度25‰±0.5‰的海水;实验期间海水平均温度(21±1) ℃,pH 7.8±0.3,溶解氧>6.0 mg·L-1,As本底值4.07×10-3mg·L-1,Cd本底值9.1×10-5mg·L-1(配制重金属暴露浓度过程中扣除本底值)。实验在120 L的长方体水族箱中进行,使用之前充分清洗消毒。
1.1.3 试剂与仪器
1 000 μg·L-1As(Ⅴ)标准溶液(GR)购自美国Inorganic Ventures公司;氯化镉(CdCl2·2.5H2O)(AR)购自中国上海化工试剂厂,用去离子水配成Cd浓度为1 000 μg·L-1的储备液,稀释成实验所需要的浓度梯度;硝酸(AR)购自中国国药集团化学试剂有限公司。
Agilent 7500型电感耦合等离子体质谱仪(ICP-MS)购自美国Agilent公司;Ethos 1/A微波消解仪购自意大利Milestone公司;Element DDS-307型Milli-Q超纯水处理系统购自美国Millipore公司;MIK-PH3.0型精密pH计购自上海伟业仪器公司;BSA224S-CW型精密电子天平购自德国Sartorius公司。
1.2 实验方法
1.2.1 暴露溶液的浓度梯度设定
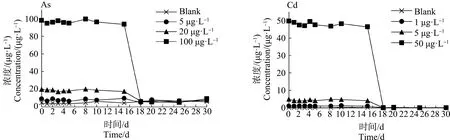
暴露溶液由1.1.2中的新鲜配制的海水和As、Cd储备液(质量浓度为1 000 μg·L-1)混合而成。分别设置低、中和高浓度3个实验组,每组3个平行,另外设置1组海水对照组,每组容器放入15只青蟹。根据《污水综合排放标准》(GB 8978—1996)规定[18],As和Cd最高允许排放浓度分别为0.5 mg·L-1和0.1 mg·L-1,以《中华人民共和国渔业水质标准》(GB 11607—1989)[19]对As和Cd浓度的规定为参考,渔业用水中As和Cd应分别低于0.05 mg·L-1和0.0005 mg·L-1。设计As的暴露浓度分别为5、20和100 μg·L-1,Cd的暴露浓度分别为1、5和50 μg·L-1。暴露实验海水按以上方法配制完成后,对配制的实验海水中As和Cd浓度进行测定,测得的实际浓度值与设计浓度一致后,用于暴露实验。实验期间,海水样品的采集均在次日换水前进行,采集完海水样品,立刻检测其As和Cd的浓度,保证水环境中重金属暴露浓度的稳定。
1.2.2 As和Cd的富集与释放实验
实验分为富集(15 d)和释放(15 d)两部分,整个实验过程持续30 d。富集实验加入含有不同重金属浓度的海水,海水量为100 L,在富集实验第0、2、3、5、10和15天从各箱中取出青蟹3只,分别取青蟹的肝胰腺、肌肉(包括胸肌和腿肌)和蟹腮3个部分的组织器官制样,于-40 ℃冰箱中迅速冷冻。富集阶段结束后,将各实验箱中溶液换成100 L清洁海水,分别于第18、20、25和30天采集青蟹样品,处理方式同富集实验。每24小时100%更换一次实验海水。实验期间每个水槽持续充氧,以保持实验期间水体中溶解氧含量充足(溶氧量>6 mg·L-1)和水体重金属的浓度分布均匀。实验过程中每天投喂新鲜花蛤2次,在早上8:00与晚上18:00投喂。每天第一次投喂前先将实验缸内的海水排尽并更换上相同浓度新配制的实验海水以保证实验期间海水中重金属浓度的稳定。
1.3 样品处理与分析
取出拟穴青蟹先称重,将蟹壳去掉,取出蟹腮、肝胰腺,刮出四肢、螯足腿部肌肉及胸肌混合,最终得到拟穴青蟹的蟹腮、肝胰腺和肌肉3个部分组织器官样品。同一暴露浓度下,拟穴青蟹的同一组织器官样品合并为一组,袋装冷冻保存,待检测。
样品前处理使用微波消解法。准确称量待测样品1.0 g于聚四氟乙烯消化罐中,加入5 mL硝酸,加盖密封后置于微波消解仪中,设定消解步骤(功率1 800 W,0~15 min升温至180 ℃,15~45 min维持180 ℃)。消解完毕后,消解溶液定容到100 mL,同时做空白实验。
按照《食品安全国家标准 食品中多元素含量的测定》(GB 5009.268—2016)的方法测定[20]。ICP-MS仪器条件:RF射频功率1 500 W,等离子体气流量15 L·min-1,载气为高纯氩气,载气流速为1.08 L·min-1,辅助气流量0.4 L·min-1,雾化器为同心雾化器,雾化室温度2 ℃,采集深度为8 mm,样品提升速率0.3 r·s-1,碰撞反应气为高纯氦气,流速4~5 mL·min-1。
1.4 半静态双箱模型
半静态双箱动力学模型认为重金属污染物在生物体内的富集可近似看作是污染物在生物体和水体之间的两相分配过程,其富集、释放过程可用一级动力学过程描述(图1)[21]。
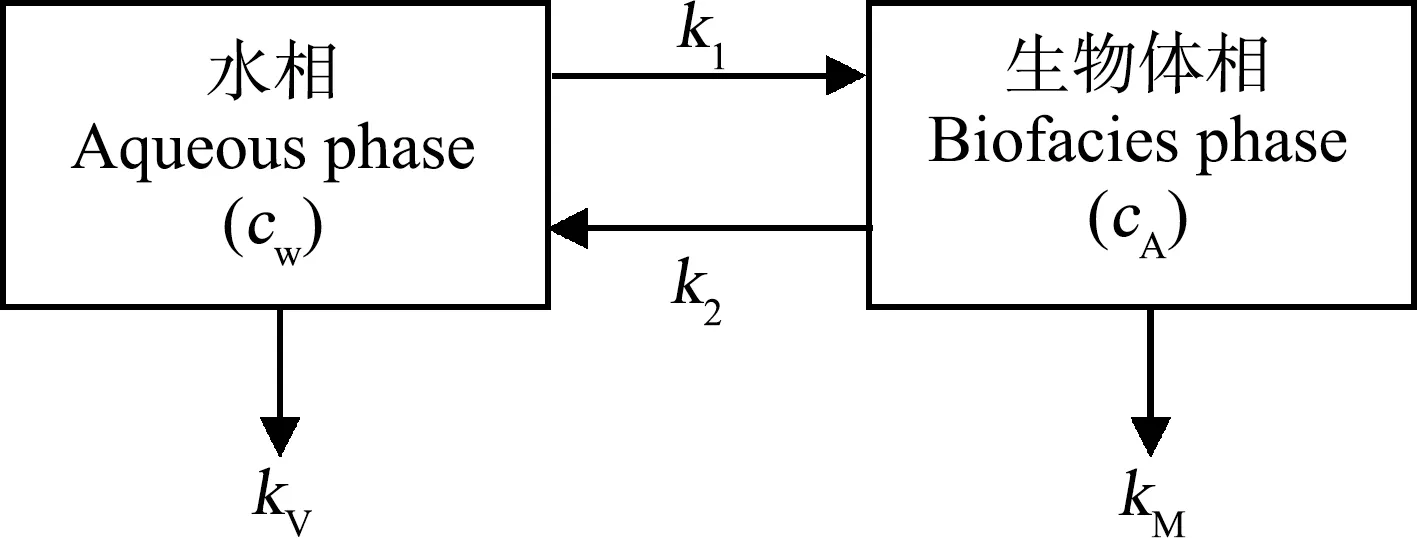
图1 生物富集双箱动力学模型Fig. 1 Two-compartment kinetic model of bioconcentration
重金属在生物体内的富集和释放过程,在毒理动力学的研究中采用双箱动力学模型与一级动力学方程来评价,其中,含有重金属污染物的水体作为第一相,生物体作为第二相。那么,重金属浓度的变化过程如下。
(1)
(2)
式中:t为实验进行的时间(d);k1为生物对重金属的吸收速率常数;k2为生物对重金属的释放速率常数;kV为挥发速率常数;kM为生物体的代谢速率常数;cW为水相中As、Cd质量浓度(mg·L-1);cA为生物体内As、Cd质量浓度(mg·kg-1)。
由于生物富集与释放实验时间较短,且重金属As、Cd难以挥发,因此,可以忽略水相中重金属污染物的自然挥发及生物体的代谢,即假设kV和kM均为零,由式(1)和式(2)推导可得:
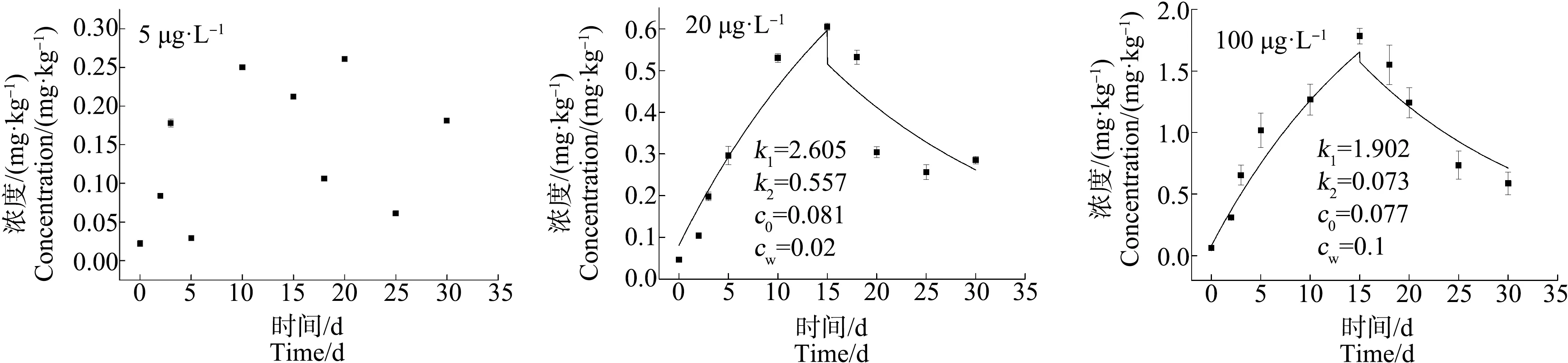
富集过程(0 (3) 释放过程(t>t*):cA=cWk1/k2(ek2(t-t*)-ek2t) (4) 式中:c0为实验开始前生物体中的As、Cd质量浓度(mg·kg-1);t*为富集阶段结束时实验进行的时间(d)。由富集实验和释放实验中生物体内重金属浓度的监测结果,通过非线性拟合得到重金属的k1和k2。 理论平衡状态下,生物富集系数(BCF)用式(5)求得;重金属的生物学半衰期(T1/2)指的是生物体内的重金属释放一半所需的时间,用式(6)求得: BCF =k1/k2= lim(cA/cW) (t→∞) (5) T1/2= ln2/k2 (6) 当富集达到理论平衡时,生物体内重金属浓度(cAmax)由式(7)求得: cAmax= BCF×cW (7) 双箱动力学模型优势在于即使生物富集没有达到平衡状态,也可以用来推断计算理论平衡状态下的重金属动力学参数。该模型目前在研究水体重金属的富集中应用广泛,也较为成熟[22]。 应用拟合软件Origin 9.0对数据进行非线性拟合,根据式(3)和式(4)得到k1和k2,结合判定系数(r2)来评价该模型的拟合优度,并采用F检验对模型整体的显著性进行检验,以此验证双箱模型用于拟穴青蟹对As和Cd的生物富集研究的可行性。采用SPSS 19.0软件对实验数据进行配对t检验,当P<0.05时,差异显著。 各实验组海水中As和Cd的质量浓度如图2所示,实测暴露浓度值在误差允许范围内波动,对实验影响可忽略不计。 图2 各实验组水中As和Cd的浓度(0~30 d)Fig. 2 As and Cd concentration of water in each experimental group (0~30 d) 由图3~图5可知,拟穴青蟹暴露在含As浓度为5、20和100 μg·L-1的水体环境中,暴露15 d后,As在青蟹体内尚未达到富集平衡状态,除5 μg·L-1As暴露组中,肌肉组织对As富集没有呈现显著规律性外,其他各实验组的组织器官中As浓度相对其初始值都表现出明显的上升趋势。在富集的第15天,各组织器官中As浓度达到最大,其中,肝胰腺组织中As的富集速度最快,浓度最高。对图3~图5中的数据进行方差分析,选择水相中As浓度作为分类变量,结果表明,除了5 μg·L-1As实验组中肌肉的As浓度无显著性差异(P>0.05)外,其他实验组中肌肉、肝胰腺和蟹腮的As浓度均有显著性差异(P<0.05)。因此,水相中的As浓度与拟穴青蟹不同组织器官中的As浓度表现出正相关。同一暴露浓度下,各组织器官中As浓度呈现出肝胰腺>蟹腮>肌肉的富集趋势。在释放阶段,各组织器官中As的浓度随着释放时间的延长而减小,表现出明显的释放过程。 图3 拟穴青蟹肌肉组织对As的生物富集和释放曲线Fig. 3 The bioconcentration and bioelimination curve of As in the muscle tissues of Scylla paramamosain 图4 拟穴青蟹肝胰腺组织对As的生物富集和释放曲线Fig. 4 The bioconcentration and bioelimination curve of As in the hepatopancreas tissues of Scylla paramamosain 图5 拟穴青蟹蟹腮组织对As的生物富集和释放曲线Fig. 5 The bioconcentration and bioelimination curve of As in the gill tissues of Scylla paramamosain 与As类似,各实验组对Cd的吸收也尚未达到富集平衡状态,Cd暴露浓度为1、5和50 μg·L-1,拟穴青蟹肌肉、肝胰腺和蟹腮均对水相中的Cd具有明显的吸收,Cd浓度明显增加。在富集的第15天,各实验组中的Cd浓度均到达到最高。对图6和图7中的数据进行方差分析,选择水相中Cd浓度作为分类变量,结果显示,拟穴青蟹肌肉、肝胰腺和蟹腮的Cd浓度均有显著性差异(P<0.05)。因此,水相中的Cd浓度与拟穴青蟹不同组织器官中的Cd浓度表现出正相关。在同一暴露浓度下,3个组织器官中Cd浓度同样也呈现出肝胰腺>蟹腮>肌肉的富集趋势。在释放阶段,各个器官中Cd的浓度随着释放时间的增加而减小,表现出明显的释放过程。拟穴青蟹组织器官中重金属的浓度不仅与富集的时间成正相关,也与水相中重金属的浓度呈现浓度-效应关系。 由非线性拟合得到k1和k2,再根据式(5)、式(6)和式(7)得到拟穴青蟹对As和Cd生物富集动力学参数BCF、cAmax和T1/2。拟穴青蟹不同组织器官对As和Cd的富集动力学参数如表1所示。 图6 拟穴青蟹肌肉组织对Cd的生物富集和释放曲线Fig. 6 The bioconcentration and bioelimination curve of Cd in the muscle tissues of Scylla paramamosain 图7 拟穴青蟹肝胰腺组织对Cd的生物富集和释放曲线Fig. 7 The bioconcentration and bioelimination curve of Cd in the hepatopancreas tissues of Scylla paramamosain 图8 拟穴青蟹蟹腮组织对Cd的生物富集和释放曲线Fig. 8 The bioconcentration and bioelimination curve of Cd in the gill tissues of Scylla paramamosain 由表2可知,拟穴青蟹各组织器官对As和Cd生物动力学拟合曲线判定系数(r2)范围分别为0.885~0.985和0.915~0.972,F检验的P值均<0.05,表明模型拟合程度较好且回归方程是显著的。在该模型是显著的基础上,利用模型计算拟穴青蟹体内重金属As和Cd的拟合浓度,与实测值进行配对t检验,得到的P值均>0.05,说明模型拟合输出值和实测值之间不存在显著差异性,拟合方程和拟合参数可信,由此验证本实验条件下双箱动力学模型是可信的。 拟穴青蟹对As和Cd的富集参数在不同组织器官存在特异性。由表1可知,各组织器官对As的富集参数k1和BCF均表现为肝胰腺>蟹腮>肌肉,且均为显著相关(P<0.05),理论平衡状态下各组织器官中cAmax值随着水中As浓度升高而增大。k2值较小,k2与T1/2在3种组织器官中没有显著差异(P>0.05)。同样,各组织器官对Cd的富集参数k1和BCF均表现为肝胰腺>蟹腮>肌肉,且均为显著相关(P<0.05),理论平衡状态下Cd的cAmax值随着水中Cd浓度升高而增大。但k2与T1/2无显著差异(P>0.05)。重金属As和Cd在拟穴青蟹体内的富集具有组织特异性,这可能与不同组织器官的生理功能和代谢水平有关。肝胰腺是水生生物的主要解毒和排泄器官,可以快速大量合成金属硫蛋白(MT)而使重金属得以大量蓄积,对重金属的富集能力明显高于肌肉等部位[23]。鳃是许多水生生物的呼吸器官,其表面积大,结合位点多,重金属进入生物体内首先在腮表面附着,通过结合位点进入体内,因此腮也可以使重金属大量积累[24]。本研究中,肌肉组织在As的暴露浓度为5 μg·L-1时无富集规律,可能是由于As的浓度较低,富集量少,As被摄入生物后先经过肝胰腺等器官,当该部位发生过度积累后才会加快向肌肉组织转移,所以肌肉未表现出明显的富集特征。有关组织蓄积特异性的相似报道也出现在克氏原螯虾(Procambarusclarkii)[25]、日本沼虾(Macrobrachiumnipponense)[22]、中华绒螯蟹(Eriocheirsinensis)[26]和菲律宾花蛤(Ruditapesphilippinarum)[27]等水生生物中。 表1 拟穴青蟹各组织器官对不同浓度As和Cd的生物富集动力学参数Table 1 The kinetic parameters of bioconcentration of As and Cd by different tissues and organs of Scylla paramamosain in the different concentration of As and Cd 同一暴露浓度下,拟穴青蟹各组织器官对Cd和As的富集速率不同。在As和Cd暴露浓度相同的条件下(5 μg·L-1),k1和BCF值在肝胰腺和蟹腮中均呈现出Cd>As(P<0.05),表明对Cd富集能力大于As,其中,As在肝胰腺的BCF为158.2,在蟹腮中的BCF为95.53;Cd在肝胰腺的BCF为1 738,在蟹腮中的BCF为603.8,表明As和Cd在拟穴青蟹的这2个组织器官中具有很强的富集性,而在肌肉中的富集系数相对较小。但拟穴青蟹各组织器官对As和Cd的k2值无显著差异(P>0.05)。生物体对Cd的富集能力强于As也在其他生物暴露实验中被发现。牡蛎(OstreagigasThunberg)对重金属As和Cd在不同暴露浓度下的BCF分别为48.98~56.67和880.6~986.3,表明牡蛎对Cd表现出更强的富集能力[28]。魁蚶(Scapharcabroughtonii)在As暴露浓度为30 μg·L-1和Cd暴露浓度为5 μg·L-1时得到的BCF分别为38.97和1 566.80,表明Cd的富集能力强于As[29]。各组织器官对Cd表现出比As更强的富集能力,可能是Cd是以Cd(Ⅱ)形态进入生物体,而MT是一种富含巯基的金属结合蛋白,大量巯基对二价金属离子尤其重金属离子具有极高的亲和力,能与非必需有毒金属(Cd(Ⅱ))结合,这可以保护细胞器免受损伤,这种结合反应主要存在于生物体的肝脏和肠道中[23]。 表2 拟穴青蟹各组织器官对As和Cd生物富集双箱动力学模型的拟合优度检验Table 2 Goodness of fit test of two-compartment kinetic model applied in the As and Cd bioaccumulation in the different tissues and organs of Scylla paramamosain As和Cd在拟穴青蟹各组织器官的BCF呈规律性的变化特征,即BCF随水相暴露浓度的增加而减少。海洋生物对重金属的富集实际上取决于重金属进出生物体的速率,相对的速率变化决定了生物对重金属的富集能力[30]。因此,在实验初期,在低浓度暴露时,拟穴青蟹体内重金属浓度较低,生物体开始大量吸收重金属,重金属主要从水相向生物体相迁移,此时k1>k2。经过一段时间富集后,拟穴青蟹对重金属的吸收速率趋于平稳状态,富集增加幅度减小,吸收和释放2个过程逐渐趋于平缓,富集曲线也趋于平缓。同时,增大的重金属浓度更加接近拟穴青蟹的毒性效应阈值,因此,高暴露浓度下的代谢能力弱于低暴露浓度,最终表现为低浓度条件下的BCF比高浓度下的BCF值高。相同的规律也在翡翠贻贝(Pernaviridis)[31]、三疣梭子蟹(Portunustrituberculatus)[32]和栉孔扇贝(Azumapectenfarreri)[33]对重金属的富集研究中被发现。此外,海洋生物对有机污染物(苯并[a]芘和苯酚等)的生物富集中也有此现象,具有一定的普遍性[34-35]。本文研究了不同浓度As和Cd在拟穴青蟹中的富集与释放特征,通过双箱动力学模型得到了可供参考的BCF、cAmax和T1/2等生物富集动力学参数值,进一步推进了重金属在蟹体中的分布、生物传递和蓄积特征的研究。1.5 模型的拟合优度检验
2 结果(Results)
2.1 水中As和Cd的浓度测定
2.2 青蟹不同组织器官对不同浓度As的富集与释放特性
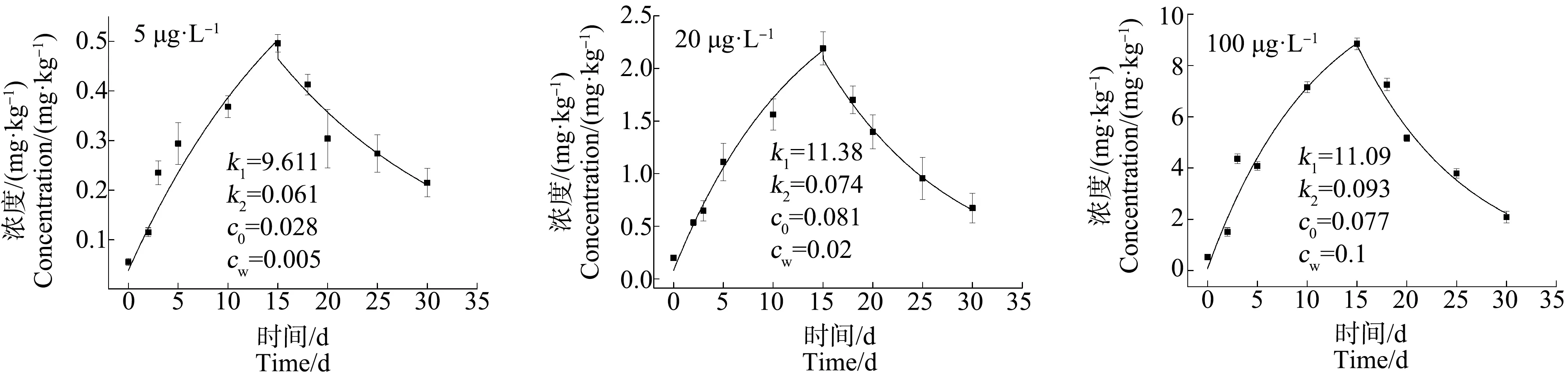
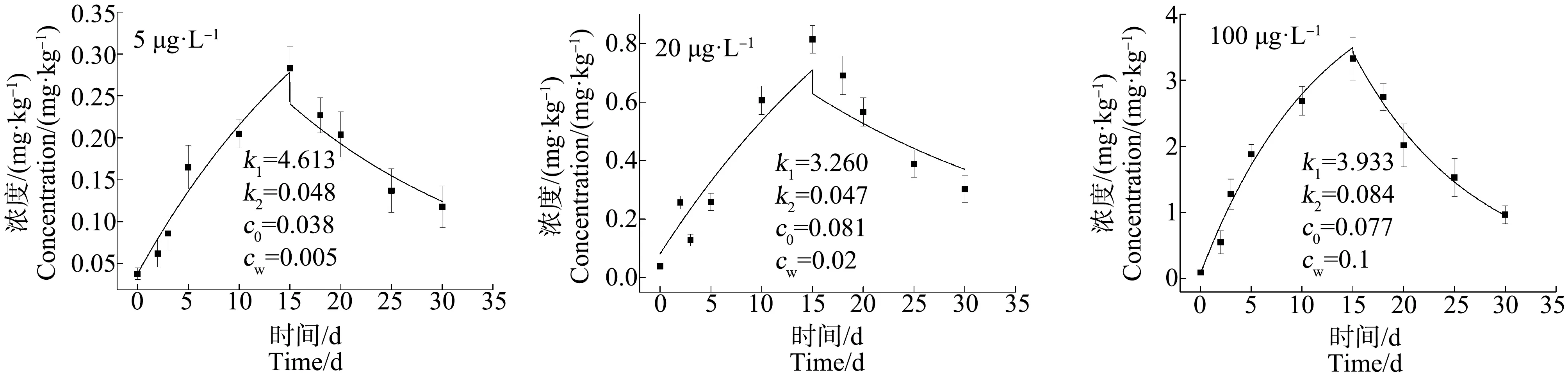
2.3 青蟹不同组织器官对不同浓度Cd的富集与释放特性
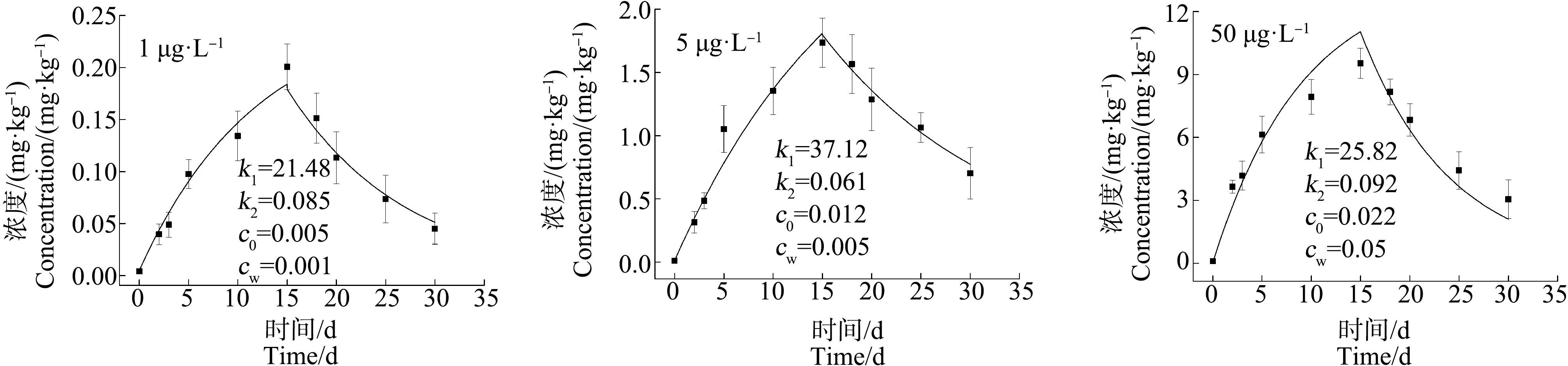
2.4 拟穴青蟹对As和Cd的生物富集动力学参数

2.5 模型的拟合优度检验
3 讨论(Discussion)



