皮肤中原代黑色素细胞和角质形成细胞同时分离法及其在超细颗粒物毒性效应评价中的应用
程战文,殷诺雅,郑卫,Francesco Faiola,*
1. 中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京 100085 2. 中国科学院大学资源与环境学院,北京 100049 3. 重庆医科大学附属第三医院泌尿外科,重庆 401120
近年来,随着工业技术的逐渐发展,大气污染日益严重,越来越多的国家和地区开始关注大气污染问题。已有流行病学研究表明,大气污染物的暴露会导致人群中呼吸系统[1]和心血管系统[2-3]疾病发病率的增加,以及人群中死亡率的上升[4-5],存在一定的健康风险。除此之外,皮肤作为人体最大的器官,流行病学研究同样证实大气污染会引起内源性的皮肤老化[6-7]、过敏性皮炎[8-9]及湿疹[10]等皮肤疾病发病率的增加,同时还伴随着黑色素在皮肤中的累积和老年雀斑比例的上升[7,11],对人体皮肤具有潜在的毒性效应。考虑到皮肤是保护人体免受外界污染物危害的第一道防线,且目前关于污染物是如何影响人体皮肤的病因,也并未阐明。因此,从皮肤细胞角度出发衡量大气污染物潜在的危害效应,将有助于大气污染毒性的评估以及污染物排放标准的制定。
大气中的各种颗粒物成分,组成了大气气溶胶的悬浮体系。而粒径<100 nm的超细颗粒物,虽然在质量上只占大气总颗粒物的很少一部分,但却是大气中数量最多的颗粒物[12]。与PM2.5以及PM10相比,超细颗粒物具有更小的粒径,不仅能透过呼吸系统的各种屏障,还能直接透过肺泡细胞,进入人体血液循环,在人体内造成严重的炎症反应并伴随氧化应激的产生[13-14]。事实上,超细颗粒物已被证实是雾霾期间儿童若干疾病如收缩压升高[15]、哮喘发病率上升[16]的元凶。虽然,超细颗粒物对人体存在着潜在的健康风险,但目前对超细颗粒物的风险评估还处于较早的阶段,美国环境保护局(US EPA)以及欧盟(EU)对超细碳颗粒物的排放还未制定规范标准。因此,从超细颗粒物角度解释大气污染潜在毒性效应特别是皮肤毒性效应,将有助于大气污染风险的评估。
目前,已有许多实验数据,从纳米毒理学角度出发,探讨了纳米尺度颗粒物的潜在皮肤暴露风险。作为常见的碳纳米材料的代表,单壁碳纳米管能导致皮肤中的角质形成细胞内出现明显的活性氧(reactive oxygen species, ROS)蓄积[17],诱导细胞内胁迫相关基因的过量表达。除此之外,纳米颗粒物的暴露,还会导致细胞内炎症因子的高表达。例如24 h内20、50和80 nm纳米银暴露会导致角质形成细胞分泌的IL-1β、IL-6、IL-8以及TNF-α的浓度显著升高,并伴随着纳米银作用位点出现明显的局灶性炎症现象[18]。Li和Monteiro-Riviere[19]使用硫辛酸、聚乙二醇以及聚乙烯亚胺修饰过的纳米金颗粒,研究了人表皮角质形成细胞对不同粒径纳米金颗粒的摄取和内吞效应,研究发现不同材料修饰的纳米金颗粒均会促进促炎症因子IL-1α、IL-1β和趋化因子IL-8的表达和分泌。相同的炎症效应,同时也出现于纳米碳管[20]、纳米锌[21]以及纳米二氧化钛[22]暴露后的角质形成细胞中。
值得注意的是,以上研究大多基于人体角质形成细胞。虽然,角质形成细胞占表皮细胞的90%,但对于表皮中具有黑色素分泌功能,同时能调节皮肤颜色并保护皮肤免受紫外线干扰的黑色素细胞而言,研究还较少。只有少量研究表明,大气污染中的某些持久性有机污染物如二噁英会通过AhR受体介导的形式,上调黑色素细胞内与黑色素产生相关的TYR、TYRP1以及TYRP2基因的表达,促进黑色素产生[23-24]。此外,目前的研究多是从氧化应激和炎症反应2个方面揭示纳米颗粒物的毒性,从细胞功能角度阐明纳米尺度颗粒物毒性效应的研究还较少。鉴于以上原因,使用原代细胞分离的方法,从人体皮肤中同时分离了角质形成细胞和黑色素细胞,用商业化的超细碳颗粒物模拟了大气中的超细颗粒物,探究了大气颗粒物的潜在皮肤毒性。考虑到目前已有若干基于原代角质形成细胞的研究,此处重点探讨了超细碳颗粒物对黑色素功能基因表达的影响。以上研究将有助于大气颗粒物风险评价,解释超细颗粒物的皮肤致毒机制。
1 材料与方法(Materials and methods)
1.1 实验材料
实验室中分离的黑色素细胞和角质形成细胞来源于医院健康男性包皮环切术(已告知样品用途并获得口头许可)。手术结束后的皮肤样品迅速保存至含有5 mg·L-1庆大霉素(Gibco,R01510)的D-KSFM培养基(Gibco,10744019)中,并置于冰中转移至实验室进行细胞分离。
实验使用的超细碳颗粒物为商业化的碳颗粒物(Sigma,633100),使用二甲基亚砜(DMSO)(Amresco,0231)为分散剂并置于37 ℃恒温水浴锅(Elma,P60H)中超声30 min,获得浓度为10 g·L-1的超细碳颗粒物母液,再次梯度稀释为1 mg·L-1~10 g·L-1储备液。
1.2 原代细胞的分离
使用含有20 mg·L-1庆大霉素的杜氏磷酸缓冲液(DPBS)(Gibco,14190250)清洗包皮样品5次,每次5 min,并将包皮样品剪成2 cm3左右的片状,充分清洗去除其中的血渍。将清洗过后的包皮样品转移至含有25 000 units·L-1蛋白酶(Gibco,17105041)和5 mg·L-1庆大霉素的DPBS溶液中,4 ℃条件下消化24 h。消化完成后,使用镊子将表皮从样品中剥离出来,并使用0.05% Trypsin-EDTA(Gibco,12605010)在37 ℃条件下消化15 min,消化过程中使用巴氏吸管吹打样品使表皮更加充分的消化。消化完成后,使用10倍体积的DPBS溶液稀释消化液终止消化,并使用40 μm细胞过滤器(Corning,431750)去除未消化的残渣,最后在200 g离心5 min。离心完成之后,使用D-KSFM培养基重新悬浮,并按照1×108cells·L-1浓度将细胞接种于胶原蛋白(Gibco,R011K)修饰过的培养皿中,用于角质形成细胞的培养。使用含有HMGS-2(Gibco,S0165)的m254培养基(Gibco,M254500)(黑色素细胞培养基)重悬细胞并将其接种于纤连蛋白(Corning,354008)修饰过的培养皿中,用于黑色素细胞的培养。分离的原代细胞在一周后能逐渐长满整个培养皿,在2~3次传代后能逐渐被分离纯化(图1)。

图1 表皮分离过程Fig. 1 The procedure of epidermis isolation
1.3 超细碳颗粒物表征
将纳米碳颗粒粉末均匀分布在样品台的导电胶上,使用洗耳球从不同角度吹拂样品台上的纳米碳颗粒样品,使粉末牢固、均匀地粘在导电胶上。使用场发射高分辨率扫描电镜(field-emission scanning electron microscopy, FE-SEM)(Hitachi,SU-8020)拍摄超细碳颗粒物照片,并使用其元素分析模块(energy dispersive X-ray spectroscopy, EDS)分析其元素组成和含量。
将1 g·L-1碳颗粒物储备液用DMEM/F12(Gibco,11320082)稀释至1 mg·L-1,用以模拟其在培养基中的条件,并将其滴加至碳膜覆盖的铜网(Electron Microscopy China,BZ11032a)上,使用红外灯烘干1 h,使铜网完全干燥后,即可置于透射电子显微镜(transmission electron microscopy, TEM)(Hitachi,H7500)中在80 kV下拍摄TEM照片。
1.4 细胞活性检测
将传代3代之后原代黑色素细胞使用TrypLE消化液(Gibco,12604013)消化并重悬浮,并按1×108cell·L-1接种于纤连蛋白修饰后的96孔板中。将1 mg·L-1~10 g·L-1超细碳颗粒储备液用黑色素细胞培养基稀释1 000倍(DMSO浓度为0.1%),使超细碳颗粒物暴露浓度分别为1、10、100、1 000和10 000 μg·L-1,阴性对照为0.1% DMSO处理组,每孔100 μL,共持续暴露72 h。暴露过程中每天更换培养基。暴露结束使用AlamarBlue(Thermo,DAL1025)试剂,在酶标仪(Thermo,Varioskan LUX)上检测(激发波长530 nm,发射波长590 nm)细胞存活率。细胞存活率计算方法如下:
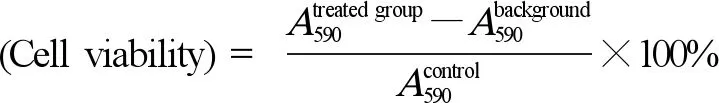
1.5 超细碳颗粒物对黑色素基因表达分析
将黑色素细胞按照相同浓度接种于纤连蛋白修饰后的培养皿中并暴露于含有1~10 000 μg·L-1超细碳颗粒的黑色素细胞培养基中。待细胞长满整个培养皿时,加入1 mL Trizol试剂(Invitrogen,15596018)按照其说明提取样品中的RNA,并使用NanoDrop紫外可见分光光度计(Thermo,NanoDrop 2000)测量RNA溶液浓度和260、280及230 nm的吸光值,进行RNA定量。使用FastKing RT Kit试剂(TIANGEN,KR116)将RNA逆转录成cDNA,加入SYBR Green试剂(Takara,RR420L)后按照以下步骤测量基因表达水平:预变性(95 ℃,30 s),PCR(95 ℃,3 s;60 ℃,30 s;40个循环)。基因表达以GAPDH作为内参基因,引物以及其序列如表1所示。
1.6 免疫荧光染色
将样品使用DPBS清洗3次,加入4%福尔马林试剂在室温条件下固定20 min后再次使用DPBS清洗。加入含有0.1% Triton X-100(Amresco,0694)和5%山羊血清(Solarbio,SL038)的DPBS试剂作为封闭液室温条件下孵育1 h。加入一抗4 ℃过夜孵育,使用DPBS清洗后加入二抗4 ℃孵育2 h即可。本部分抗体使用信息如表2所示。
2 结果(Results)
2.1 原代黑色素细胞和角质形成细胞分离
原代细胞分离过程如图1所示,由于表皮中大多数细胞为角质形成细胞,黑色素细胞只占很少一部分,因此,在细胞分离过程中使用黑色素细胞培养基(在m254培养基中添加HMGS-2)以及以纤连蛋白为基质,对黑色素细胞进行分离和筛选。结果表明,经过2~3次传代后,黑色素细胞能逐渐被纯化并表现出较高的纯度。在体外分离出来的黑色素细胞胞质透明可见,细胞核较小,每个细胞具有多个树突状结构。同时,分离出的黑色素细胞能在离体条件下进行传代和扩增,并维持均一的细胞形态(图2)。通过将黑色素细胞消化收集并离心,能在试管底部发现明显的黑色素沉淀,这说明分离的原代黑色素细胞在体外具有合成黑色素的能力(图2),验证细胞分离实验的成功。

表1 qRT-PCR引物及其序列Table 1 qRT-PCR primer sequences
除了黑色素细胞,还获得了皮肤中的角质形成细胞,并在几次传代后实现了细胞分离纯化(图2)。显微镜下角质形成细胞呈不规则鳞片形,细胞边缘较为明亮,且相互之间紧密相连。通过荧光免疫染色,发现所有的细胞都能表达角质形成细胞特异的骨架蛋白KRT14。以上结果说明,我们的原代细胞分离方法不仅能分离黑色素细胞,也能用于提取皮肤中的角质形成细胞,实现了同时分离皮肤中两大类细胞。
2.2 超细碳颗粒物表征
如图3(a)所示,超细碳颗粒粉末呈聚集的团状,聚集体之间存在较大范围的间隙,同时颗粒与颗粒之间存在明显的团聚。因此,下述准备超细碳颗粒悬浮液时,均使用超声水浴使碳颗粒尽量分散。SEM结果显示,粉末状碳颗粒粒径约50 nm。EDS元素分析结果显示,除去光谱中存在的元素氧信号外,粉末主要成分都为元素碳,这说明粉末状样品主要组成元素为碳,样品具有较高的纯度。
超细碳颗粒的TEM表征结果如图3(c)所示,将1 g·L-1分散于DMSO的超细碳颗粒物悬液用DMEM/F12稀释至1 mg·L-1,超声分散后,超细碳颗粒物能在培养基中被分散成单个球形的颗粒物,且能在DMEM/F12中均匀分散,此浓度下未见明显的碳颗粒聚集体。TEM表征结果显示,单个碳颗粒在DMEM/F12中粒径<100 nm,为纳米尺度颗粒物,这与SEM结果相符。

图3 超细碳颗粒物的扫描电镜(SEM)、X射线能谱分析(EDS)和透射电镜(TEM)表征注:(a) SEM表征超细碳颗粒粉末形态;(b) 超细碳颗粒粉末的EDS元素分析;(c) TEM表征超细碳颗粒形态(1 μm)。Fig. 3 Characterization of ultrafine carbon particles by scanning electron microscopy (SEM), energy dispersive X-ray spectroscopy (EDS) and transmission electron microscopy (TEM)Note: (a) morphology of ultrafine carbon powder under SEM; (b) EDS results for ultrafine carbon particles; (c) ultrafine carbon particles under TEM (scale bar, 1 μm).
2.3 超细碳颗粒物暴露对黑色素细胞的急性毒性
考虑到目前已有许多基于角质形成细胞的实验数据,此处重点关注了黑色素细胞的毒性效应。为了探究超细碳颗粒物暴露对黑色素细胞急性毒性的影响,使用AlamarBlue测量72 h碳颗粒暴露之后黑色素细胞的细胞活性。由于氧化型AlamarBlue能被活细胞摄取进入细胞并被活细胞中的线粒体酶还原成具有荧光效应的还原态,故可通过其特定波段的荧光值来测定细胞活性。如图4所示,相比于DMSO对照组,72 h超细碳颗粒暴露并不会对黑色素细胞造成明显的急性细胞毒性。这说明,超细碳颗粒物在1~10 000 μg·L-1浓度范围内,不具有显著的细胞毒性效应。
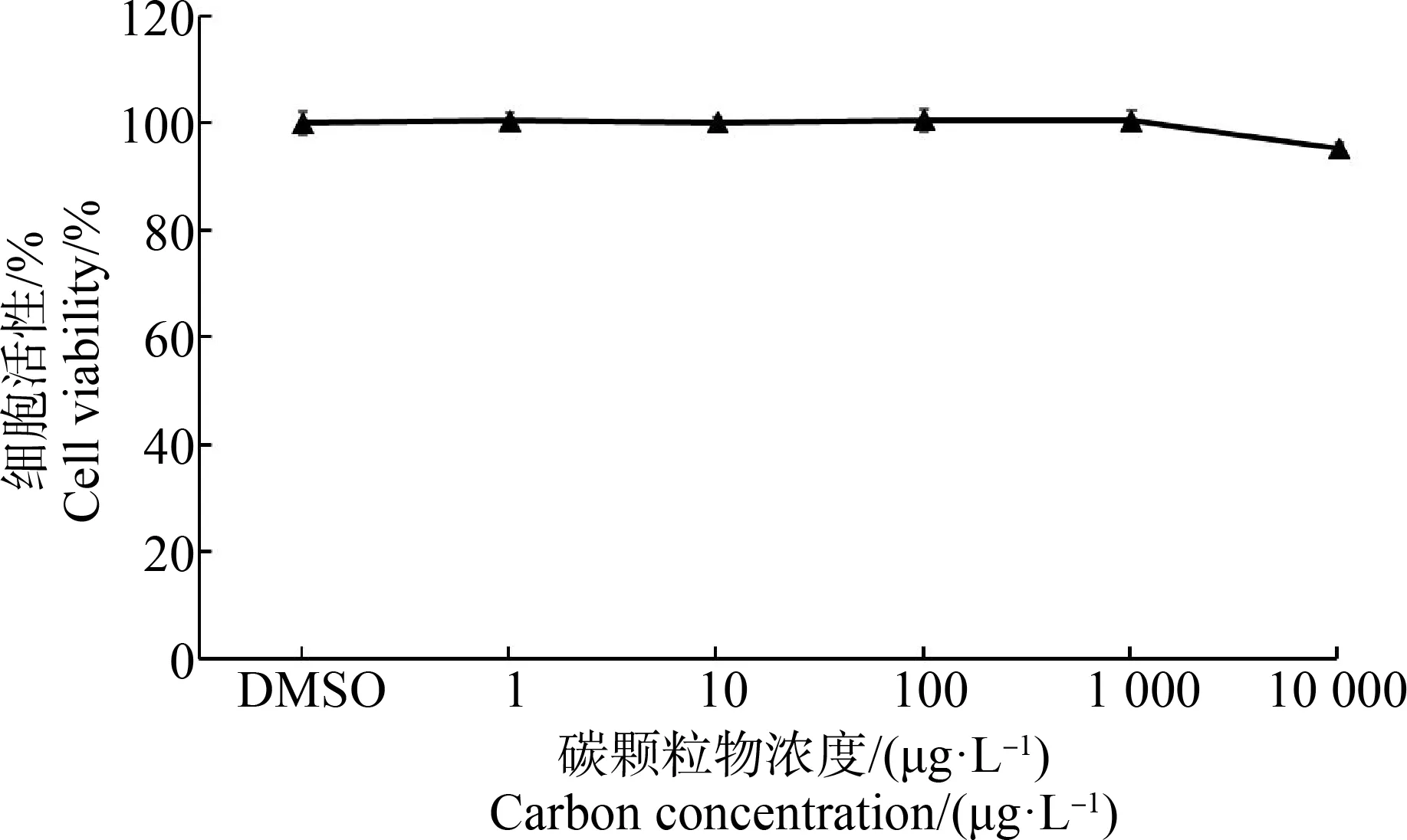
图4 超细碳颗粒物72 h暴露对黑色素细胞急性毒性的影响注:DMSO表示0.1%二甲基亚砜溶剂对照组。Fig. 4 72 h acute toxicity of ultrafine carbon particles on melanocytesNote: DMSO represents 0.1% dimethyl sulfoxide solvent control.
2.4 超细碳颗粒物暴露对黑色素细胞功能基因表达的影响
为了进一步探究超细碳颗粒物对黑色素细胞功能基因表达的影响,使用qRT-PCR测量了若干黑色素细胞功能基因的表达。如图5所示,对于黑色素细胞的标志基因MITF、MITF-M以及c-KIT,当超细碳颗粒物浓度>1 000 g·L-1时,基因表达水平会显著上升。同时,其上游调控基因PAX3和SLUG的表达,也能被超细碳颗粒物所促进。对于黑色素形成过程中的关键酶TYRP1和TYR以及黑色素小体特异型跨膜糖蛋白SILV而言,超细碳颗粒物暴露也会使其基因表达出现相同的趋势。以上结果说明,超细碳颗粒物暴露会显著促进黑色素细胞的活动,特别是当超细碳颗粒物浓度>1 000 g·L-1时。
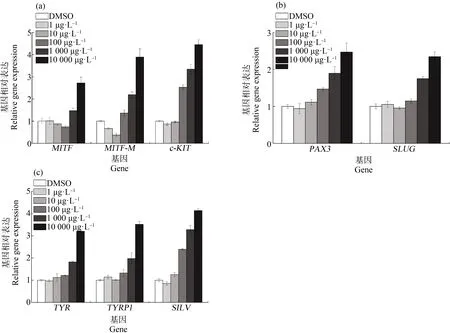
图5 超细碳颗粒物暴露对黑色素细胞基因表达的影响注:(a)黑色素细胞标志基因MITF、MITF-M和c-KIT表达水平;(b)黑色素细胞标志基因上游调控基因PAX3和SLUG表达水平;(c)与黑色素产生有关基因TYR、TYRP1和SILV表达水平。Fig. 5 The effect of carbon exposure on melanocyte gene expressionNote: (a) the expression of melanocyte marker genes MITF, MITF-M and c-KIT; (b) the upstream gene expression of melanocyte markers PAX3 and SLUG; (c) the gene expression related to melanin production TYR, TYRP1 and SILV.
3 讨论(Discussion)
本文使用一种商业化的超细碳颗粒物模拟了大气中的超细颗粒物,研究了其潜在的皮肤毒性。在日常生活中,该超细碳颗粒物也常被用作轮胎和其他橡胶制品中的增强剂,以及各种油漆、油墨等染色材料[25]。根据国际癌症研究机构(IARC)发布的研究报告,超细碳颗粒物被列为2B类致癌物,对人体可能具有潜在的致癌风险[26]。虽然,目前关于超细碳颗粒物的研究还不是很多,但已有流行病学研究表明,超细碳颗粒物暴露会影响人体健康。例如,通过调查报纸印刷行业工作人员的健康状况,发现此类人群中肺癌风险与在打印板房工作时间正相关[27],同时总就业时间越长肾癌发病风险也越高[28],并且橡胶行业从业人员有更高的心血管疾病、呼吸系统疾病以及高血压发病率[29]。与其他纳米材料相同,超细碳颗粒物暴露同样也会导致细胞内出现ROS,同时高表达某些炎症相关因子,最终导致机体呼吸系统、心血管系统以及免疫系统受损[25]。本研究发现,超细碳颗粒物的暴露会对促进人体黑色素细胞相关功能基因的表达,这说明超细碳颗粒物以及大气细颗粒物可能具有潜在的皮肤毒性。
表皮作为皮肤的最外层,构成了人体的外部屏障,能保护人体不受外界的危害[30]。角质形成细胞是构成表皮的主要细胞,占表皮细胞的90%以上;黑色素细胞虽然只占表皮细胞的6%,但是能分泌黑色素,保护人体免受紫外线的影响。因此,以角质形成细胞和黑色素细胞为基础的皮肤模型,能在一定程度上反映外界污染物对皮肤的毒性效应。本课题组前期实验已经证实,超细碳颗粒物的暴露会导致角质形成细胞发育异常,并伴随着发育分化过程中炎症反应的出现。同时,考虑目前已有若干基于原代角质形成细胞的毒性数据,所以此实验中重点关注了超细颗粒物对黑色素细胞的影响。但是,基于人体皮肤同时分离原代角质形成细胞和黑色素细胞的实验方法,在未来能为污染物皮肤毒性评价,提供新的思路。
本研究发现超细碳颗粒物的暴露会促进黑色素功能基因MITF、MITF-M、TYR、TYRP1、SILV、SLUG、PAX3以及c-KIT的高表达。MITF和MITF-M作为黑色素细胞最重要的转录因子,调节着黑色素细胞的发育和黑色素生成酶基因的表达[31-32]。作为TYR、TYRP1和SILV的上游调控基因,MITF能通过与DNA上的特异性启动子结合,控制黑色素形成过程中酪氨酸酶(TYR)和酪氨酸酶相关蛋白1(TYRP1)的转录,从而影响着黑色素的生成[33-34],而SILV与黑色素细胞中黑色素小体上的跨膜蛋白形成有关[35]。此外,MITF的表达会受到其上游调控基因PAX3[36]和SLUG[37]的影响,如PAX3和SOX10通过协同作用以反式作用元件的方式激活MITF启动子,进一步促进MITF的表达[36]。在此实验中,我们证实超细碳颗粒物暴露会通过高表达以MITF为核心的功能性基因网络,促进黑色素细胞的功能。目前已有研究表明,PM2.5浓度的上升以及碳黑颗粒物的暴露会导致皮肤中黑色素的过量产生以及累积,并伴随着人群中皮肤色素沉积增多和患老年雀斑比例的增加[6-7,11]甚至是黑色素瘤的出现[38],这与我们通过原代黑色素细胞暴露所获得的结果是相吻合的。因此,我们的研究结果及模型对于评价大气污染的潜在皮肤毒性,特别是颗粒物对皮肤色素产生的影响,具有十分重要的借鉴意义。

