3种淡水微藻相互间化感作用的实验研究
尹思成,马逸驰,王先云,尚光霞,王丽卿,3,张玮,3,4,*
1. 上海海洋大学农业部鱼类营养与环境生态研究中心,上海 201306 2. 上海城市水资源开发利用国家工程中心有限公司,上海 200082 3. 上海海洋大学水产种质资源发掘与利用教育部重点实验室,上海 201306 4. 上海海洋大学水产动物遗传育种中心上海市协同创新中心,上海 201306
种间竞争是决定物种进化模式的重要因素,也是影响生物群落结构重组的主要因素;通常可分为利用性竞争和干扰性竞争两大类[1]。利用性竞争为生物竞争利用有限的环境资源,而环境资源的下降会对所有生物的生存产生影响,比如:在水生态系统中,满江红等漂浮植物通过遮阴效果,影响沉水植物的生长,从而更容易占据优势地位[2];大型海藻可以通过竞争营养盐对浮游藻类产生营养胁迫,从而抑制藻类生长[3]。干扰性竞争是物种通过生物行为对其他物种产生影响,其形式机理多种多样[1]。化感作用是一种常见的干扰性竞争,其形式是生物通过向周围环境中释放一些化学物质,从而对自身和其他生物的生长代谢产生影响[4-6],比如:大型沉水植物穗花狐尾藻植株中的酚酸类和脂肪酸类化合物,能够显著抑制铜绿微囊藻等蓝藻的生长[7];沉水植物金鱼藻合成和释放的一些生物碱则能够对小球藻和鱼腥藻等浮游植物产生生长抑制[8]。
浮游植物在水体中广泛存在,它们不但受水生和陆生高等植物产生的化感物质的影响,同时不同藻类之间也普遍存在化感竞争[9]。各国研究人员使用滤液培养法对藻类种间的化感作用和化感物质成分开展了不少研究[10],例如:Carey和Karin[11]研究发现,群体性丝状固氮蓝藻胶刺藻的滤液能够显著抑制鱼腥藻、微囊藻和束丝藻等的生长;Irfanullah和Moss[12]发现水绵培养滤液会影响栅藻和微芒藻等的生长速率;另有研究表明,浮游蓝藻的化感作用能增加其在水环境中的竞争能力[13],是蓝藻水华产生和维持的主要因素之一[14]。此外,最近有研究表明,化感竞争作用可能在一些水华蓝藻的全球性入侵和扩张中起到了重要的作用[15]。
卵孢金孢藻(Chrysosporumovalisporum(Forti) Zapomelová et al.)原名卵孢束丝藻(AphanizomenonovalisporumForti),是丝状固氮蓝藻,原分布于土耳其[16]、以色列[17]和澳大利亚[18]的水库和湖泊中,并经常导致水华暴发。该藻能够产生拟柱孢藻毒素(cylindrospermopsin, CYN),可对水生生物和水体生态产生较为严重的负面影响[17]。近年来,该藻呈现向多地区入侵的现象,在我国的上海地区也出现了卵孢金孢藻的水华[19]。由于我国水体中暴发的蓝藻水华大多以微囊藻类群为主[20],微囊藻水华几乎一度成为我国蓝藻水华的代名词,而对卵孢金孢藻这类新型水华蓝藻的研究,总体偏少。Bar-Yosef等[21]通过对欧洲水域分离的卵孢金孢藻藻株的研究发现,它们能够通过产生的CYN刺激其他浮游植物产生胞外碱性磷酸酶(APA)以增加水体中可利用的磷酸盐含量,从而自己“渔翁得利”。近期,Zhang等[22]研究发现,高温时节,卵孢金孢藻能抑制同一水体中片状微囊藻的光合作用和生长,干扰后者的生理代谢,从而在竞争中取胜。目前,虽然对该藻生理生态学已经开展了一些研究,但对于化感作用在其分布区域扩张和种间竞争中所起的作用方面,相关研究仍鲜有报道。
本研究以卵孢金孢藻和2种常见浮游植物铜绿微囊藻、四尾栅藻为实验对象,通过滤液培养方式,探究卵孢金孢藻和2种微藻间的化感作用。以期为进一步了解卵孢金孢藻与不同浮游植物物种的化感竞争,阐明其扩散与暴发机制,并为我国新型水华蓝藻的防控提供理论基础。
1 材料与方法(Materials and methods)
1.1 藻种的培养
实验所用卵孢金孢藻(CFWA01007)和铜绿微囊藻(CFWA0100)为本实验室分别于上海滴水湖、太湖中分离获得;四尾栅藻(FACHB-1471)购自中国科学院淡水藻种库。根据Sarchizian和Ardelean[23]的方法,向BG11培养基中添加10 mg·L-1安美汀(Augmentin)和20 mg·L-1放线菌酮(actidione),以消除异养细菌和真核微生物的影响;采用MGC-300H型恒温光照培养箱培养,培养条件:(25±1) ℃,光照强度3 000 lx,光暗比(L∶D) 12 h∶12 h。4 000 r·min-1离心8 min收集对数生长期的藻细胞,用于本实验接种。
1.2 实验设计
将卵孢金孢藻、铜绿微囊藻和四尾栅藻在BG11培养基中培养15 d后,通过离心(4 000 r·min-1、8 min)和抽滤(0.45 μm混合纤维素脂膜,玻璃砂芯过滤器)获得不含藻细胞的滤液。利用过硫酸钾氧化-紫外分光光度法和过硫酸钾消解-钼锑抗分光光度法[24]检测各滤液中的总氮(TN)和总磷(TP)浓度,添加一定量NaNO3溶液和K2HPO4溶液使滤液中TN、TP浓度与BG11培养基中的水平一致。实验处理组设置:(1)Chr in Mic为卵孢金孢藻培养于铜绿微囊藻滤液;(2)Chr in Sce为卵孢金孢藻培养于四尾栅藻滤液;(3)Mic in Chr为铜绿微囊藻培养于卵孢金孢藻滤液;(4)Sce in Chr为四尾栅藻培养于卵孢金孢藻滤液。培养体积为200 mL,每组设3个平行,实验条件同培养条件。在0、2、4、6、8和10 d时分别取样测定微藻的生物量、比生长率、叶绿素a含量和叶绿素荧光参数等指标,另以3种微藻培养于BG11培养基作为对照,分析卵孢金孢藻和2种微藻间的化感作用。
1.3 指标测定
1.3.1 生物量及比生长率测定
用BG11培养基将藻液稀释成不同的浓度梯度,利用UV-2800型紫外分光光度计在680 nm波长下测量OD值,同时用Sedgwick-Rafter计数框,在Olympus BX53显微镜(400×)下进行计数,获得细胞密度,以OD680值为X轴、密度为Y轴作图,得出细胞密度与吸光度的标准曲线,实验中每2 d测定一次OD680值。
比生长率(μ)根据以下公式计算:
μ= (lnCt2-lnCt1)/(t2-t1),
式中:Ct2和Ct1分别是卵孢金孢藻在时间t2和t1的细胞密度。根据体积法,以1 mm3生物体积相当于1 mg细胞鲜重计算卵孢金孢藻的生物量。
1.3.2 叶绿素荧光参数的测定
每2 d测量一次光合荧光参数。取混匀藻液3 mL于测量杯中,暗处理3 min后使用Phyto-PAM型浮游植物荧光仪(德国Walz公司)测定卵孢金孢藻、铜绿微囊藻和四尾栅藻光合系统Ⅱ(PS Ⅱ)潜在最大光合效率(Fv/Fm)、实际光合效率(Yield)和叶绿素a浓度(Chl-a),实验第0天和第10天测量光合曲线初始斜率(α)、最大电子传递速率(ETRmax)和半饱和光强(Ik)。
1.3.3 可溶性无机磷酸盐(dissolved inorganic phosphate, DIP)的测定
实验第0天和第10天测定培养基中DIP浓度,测定方法参照《水和废水监测分析方法(第四版)》[24]。混匀藻液经0.45 μm混合纤维素脂膜过滤后,取2 mL滤液,定容至25 mL,加入0.5 mL抗坏血酸溶液(体积分数为10%)和1 mL钼酸盐溶液,放置5 min后,利用UV-2800型紫外分光光度计在700 nm波长下测量OD值,比对标准曲线得出DIP浓度。
1.4 数据分析
用单因素方差分析(ANOVA)对生物量、叶绿素a含量和叶绿素荧光参数等进行比较,分析前将数据进行方差齐性检验和正态性检验,P<0.05被认为具有显著性差异。使用SPSS 23.0进行统计分析,使用Origin 2017制作折线图和柱形图。
2 结果(Results)
2.1 滤液培养对藻类生物量的影响
如图1(a)所示,铜绿微囊藻滤液中卵孢金孢藻在实验前4 d生长受到显著抑制(P<0.01),之后生长加速,实验结束时生物量达到(152.85±15.83) mg·L-1,与对照组无显著差异(P>0.05)。如图1(b)所示,卵孢金孢藻滤液则在实验前期对铜绿微囊藻有一定促进作用,在第4天生物量达到对照组的1.41倍(P<0.01),6 d后至实验结束,生物量与对照组无显著差异(P>0.05);如图2(b)所示,4 d后铜绿微囊藻的比生长率迅速下降,显著低于对照组(P<0.05)。

图1 滤液培养对卵孢金孢藻、铜绿微囊藻和四尾栅藻生物量的影响注:*、**表示与对照组相比,双侧水平上具有显著性差异(P<0.05、P<0.01);Chr in Mic为卵孢金孢藻培养于铜绿微囊藻滤液,Chr in Sce为卵孢金孢藻培养于四尾栅藻滤液,Mic in Chr为铜绿微囊藻培养于卵孢金孢藻滤液,Sce in Chr为四尾栅藻培养于卵孢金孢藻滤液;下同。Fig. 1 The biomass dynamics of C. ovalisporum, M. aeruginosa and S. quadricauda in the other algal filtrateNote: *, ** indicate significant differences on both sides (P<0.05, P<0.01), compared with the control; Chr in Mic mean C. ovalisporum cultured in M. aeruginosa filtrate; Chr in Sce mean C. ovalisporum cultured in S. quadricauda filtrate; Mic in Chr mean M. aeruginosa cultured in C. ovalisporum filtrate; Sce in Chr mean S. quadricauda cultured in C. ovalisporum filtrate; the same below.
如图1(a)和图2(a)所示,四尾栅藻滤液中卵孢金孢藻生物量在2 d后保持稳定,比生长率降低到-0.11~0.06,在整个实验中后期显著低于对照组(P<0.01),实验结束时其生物量仅占对照组的18.95%。如图1(c)和图2(c)所示,卵孢金孢藻滤液对四尾栅藻的生物量和比生长率影响不显著(P>0.05)。

图2 滤液培养对卵孢金孢藻、铜绿微囊藻和四尾栅藻比生长率的影响Fig. 2 The specific growth rate variations of C. ovalisporum, M. aeruginosa and S. quadricauda in the other algal filtrate
2.2 滤液培养对藻类叶绿素a含量的影响
铜绿微囊藻滤液中卵孢金孢藻的叶绿素a含量在0~6 d升高速率低于对照组;6 d后叶绿素a含量上升速率加快,实验结束时叶绿素a含量与对照组无明显差异(P>0.05)。如图3(b)所示,卵孢金孢藻滤液在实验初期对铜绿微囊藻的叶绿素a含量有一定的促进作用,第4天时显著高于对照组(P<0.05);在4~8 d快速下降后趋于稳定,至培养结束时叶绿素a含量显著低于对照组(P<0.05)。
如图3(a)所示,四尾栅藻滤液中卵孢金孢藻叶绿素a含量在2 d后呈不断下降趋势,至培养结束时,叶绿素a含量为(16.1±3.78) μg·L-1,显著低于对照组卵孢金孢藻叶绿素a含量(P<0.01)。如图3(c)所示,卵孢金孢藻滤液中四尾栅藻叶绿素a含量在前8 d升高后降低,整个实验过程中与对照组无显著性差异(P>0.05)。

图3 滤液培养对卵孢金孢藻、铜绿微囊藻、四尾栅藻叶绿素a(Chl-a)含量的影响Fig. 3 Effects of filtrate culture on chlorophyll-a (Chl-a) of C. ovalisporum, M. aeruginosa and S. quadricauda
2.3 滤液培养对藻类光合荧光参数的影响
如图4(a)所示,实验前中期,2种微藻滤液对卵孢金孢藻PS Ⅱ的Fv/Fm均有一定抑制作用,在2~8 d均显著低于对照组(P<0.01);实验结束时Fv/Fm上升,分别达到0.25±0.06和0.24±0.06,与对照组0.23±0.04无显著差异(P>0.05)。如图4(b)所示,卵孢金孢藻滤液培养的铜绿微囊藻Fv/Fm在实验前期升高,第4天达到0.46±0.01,显著高于对照组(P<0.05);随后下降,至培养结束时与对照组无显著性差异(P>0.05)。如图4(c)所示,卵孢金孢藻滤液培养的四尾栅藻Fv/Fm在前4 d下降后趋于稳定,在整个实验过程中,与对照组无显著性差异(P>0.05)。

图4 滤液培养对卵孢金孢藻、铜绿微囊藻和四尾栅藻潜在最大光合效率(Fv/Fm)的影响Fig. 4 Effects of filtrate culture on the maximum photosynthetic efficiency (Fv/Fm) of C. ovalisporum, M. aeruginosa and S. quadricauda
如图5(a)所示,卵孢金孢藻在2种浮游植物滤液中,Yield均表现为先下降后上升的趋势。铜绿微囊藻滤液培养中的卵孢金孢藻Yield在第6天下降至最低,达到(0.10±0.01) μmol photons·m-2·s-1;后上升至(0.19±0.02) μmol photons·m-2·s-1,在整个实验过程中均显著低于对照组(P<0.05)。四尾栅藻滤液培养卵孢金孢藻Yield在第4天下降至最低,而后上升;在0~8 d均显著低于对照组(P<0.01),实验结束时上升至(0.34±0.04) μmol photons·m-2·s-1,与对照组无显著差异(P>0.05)。如图5(b)所示,卵孢金孢藻滤液中铜绿微囊藻Yield在前4 d稳定,之后下降,第6天为(0.22±0.02) μmol photons·m-2·s-1,显著低于对照组(0.29±0.01) μmol photons·m-2·s-1(P<0.01);8 d后Yield回升,实验结束时达到(0.32±0.03) μmol photons·m-2·s-1,显著高于对照组(P<0.01)。如图5(c)所示,实验初始时卵孢金孢藻滤液和对照组中四尾栅藻Yield保持稳定;4 d后卵孢金孢藻滤液中四尾栅藻Yield不断降低,在整个实验过程中与对照组无明显差异(P>0.05)。

图5 滤液培养对卵孢金孢藻、铜绿微囊藻和四尾栅藻实际光合效率(Yield)的影响Fig. 5 Effects of filtrate culture on the PS Ⅱ actual photosynthetic efficiency (Yield) of C. ovalisporum, M. aeruginosa and S. quadricauda
如图6(a)所示,实验结束时,2种微藻滤液培养中卵孢金孢藻的α均有所上升,但与对照组无明显差异(P>0.05)。卵孢金孢藻滤液中铜绿微囊藻的α在实验结束时为0.16±0.01,高于对照组0.12±0.02,但差异并不显著(P>0.05)。在实验结束时卵孢金孢藻滤液和对照组中四尾栅藻的α与实验初始相比均有所下降,但二者无显著差异(P>0.05)。
如图6(b)所示,实验初始,2种微藻滤液中卵孢金孢藻的ETRmax均显著低于对照组(P<0.01);实验结束时,分别升高至(538.90±72.27) μmol photons·m-2·s-1和(282.1±64.46) μmol photons·m-2·s-1,与对照组无显著差异(P>0.05)。实验结束时,卵孢金孢藻滤液中铜绿微囊藻的ETRmax相比实验初始时有所上升,与对照组无显著差异(P>0.05)。卵孢金孢藻滤液中四尾栅藻的ETRmax实验初期显著高于对照组(P<0.05),实验结束时下降至与对照组无显著差异(P>0.05)。
如图6(c)所示,实验初始时,2种微藻滤液中卵孢金孢藻的Ik均低于对照组,其中,四尾栅藻滤液中卵孢金孢藻的Ik显著低于对照组(P<0.05);实验结束时,2种微藻滤液中卵孢金孢藻的Ik均有所升高,与对照组无显著差异(P>0.05)。实验结束时,卵孢金孢藻滤液中铜绿微囊藻的Ik相比实验初始有所升高,与对照组无显著差异(P>0.05)。实验初期,卵孢金孢藻滤液中四尾栅藻的Ik值显著高于对照组,实验结束时,降低至与对照组无显著差异(P>0.05)。
2.4 实验首末滤液中DIP的变化
实验初始和结束时DIP浓度的变化情况如表1所示,各培养基中DIP浓度的下降量可以视为藻细胞对DIP的净摄取量。实验初始时各滤液中DIP浓度均低于BG11培养基中DIP浓度。铜绿微囊藻滤液中卵孢金孢藻在实验结束时对DIP的吸收利用量为2.11 mg·L-1,低于BG11培养基中2.32 mg·L-1。卵孢金孢藻在四尾栅藻滤液中,其DIP浓度上升了1.14 mg·L-1,说明卵孢金孢藻向滤液中释放了一定量的DIP。铜绿微囊藻在卵孢金孢藻滤液中培养至实验结束时,DIP的吸收利用量为0.85 mg·L-1,低于BG11培养基中1.68 mg·L-1。四尾栅藻在卵孢金孢藻滤液中培养至实验结束时,DIP的吸收利用净摄取量为2.42 mg·L-1,高于BG11培养基中1.98 mg·L-1。
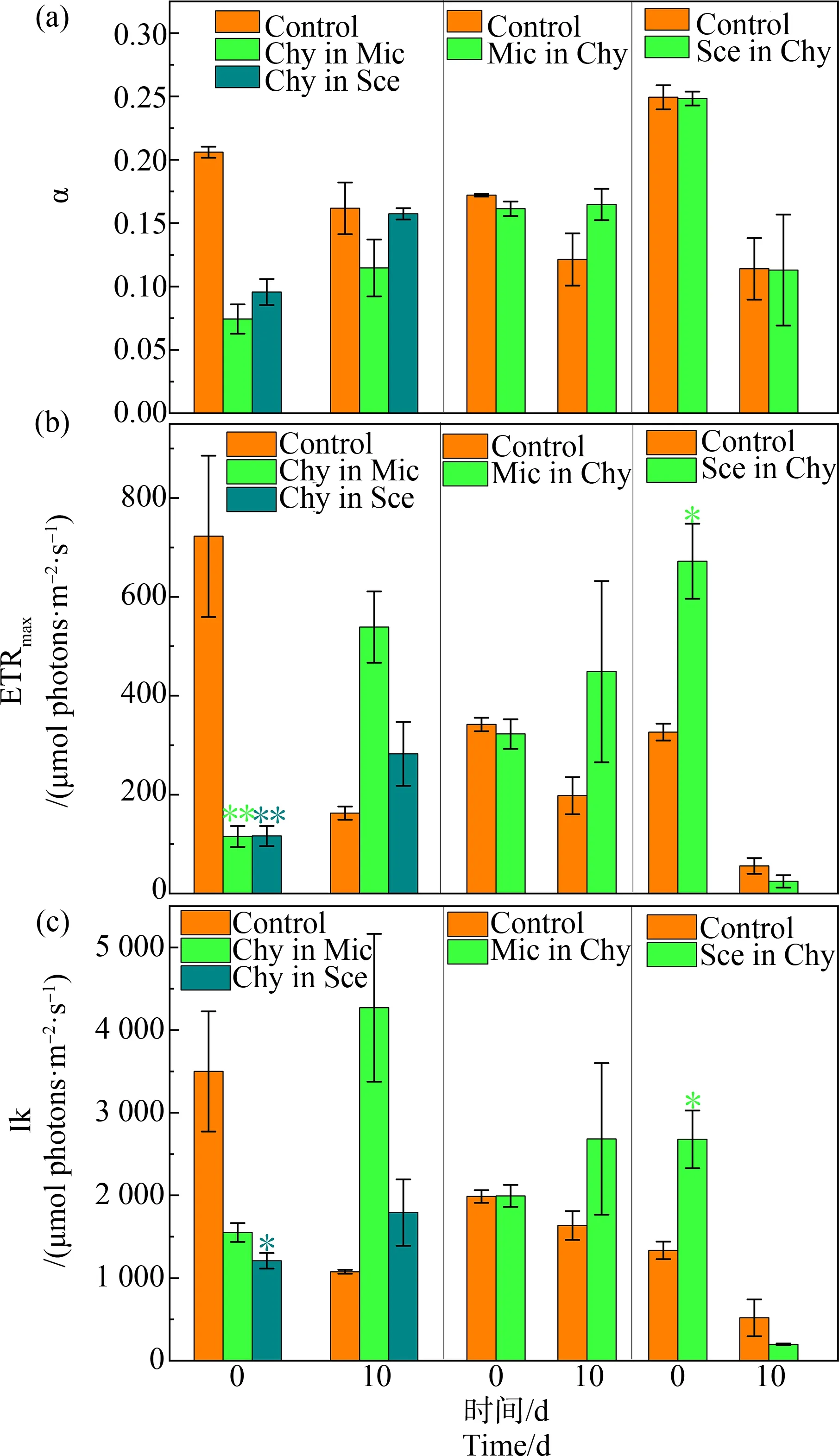
图6 滤液培养初始和结束时卵孢金孢藻、铜绿微囊藻和四尾栅藻的光曲线初始斜率(α)、最大电子传递速率(ETRmax)和半饱和光强(Ik)Fig. 6 The initial slope (α), the maximum electron transport rate (ETRmax) and the half saturated light intensity (Ik) of light curve of C. ovalisporum, M. aeruginosa and S. quadricauda at the beginning and the end of the filtrate incubation
3 讨论(Discussion)
3.1 卵孢金孢藻与铜绿微囊藻间的化感作用
光合作用是藻类最基本的物质和能量代谢途径,其活性强弱与藻类的生长密切相关。杨王庭等[25]发现,铜绿微囊藻可通过改变代谢产物的种类和数量,影响莱茵衣藻的叶绿素含量和光合活性。在本研究中,实验前期铜绿微囊藻滤液中,卵孢金孢藻的生物量和叶绿素含量均显著低于对照组(表2),表明铜绿微囊藻代谢产物在初期对卵孢金孢藻产生了胁迫抑制[26]。实验后期,卵孢金孢藻恢复生长,可能是卵孢金孢藻对铜绿微囊藻滤液的中化感物质产生了适应性,或可能由于铜绿微囊藻相关代谢产物在卵孢金孢藻培养体系中发生了降解[27]。铜绿微囊藻滤液中卵孢金孢藻的Fv/Fm和Yield先降后升,此外实验结束时,卵孢金孢藻的α、ETRmax和Ik相比实验开始时均有所升高,表明卵孢金孢藻通过提高了PSⅡ中的电子传递效率等恢复了一定的光合活性[28]。有研究发现,铜绿微囊藻分泌的微囊藻毒素(microcystin, MC)能够刺激其他藻类改变其光合色素组成[29-30]。杜彩丽等[31]的研究表明,卵孢金孢藻的藻胆蛋白具有比叶绿素a更高的胁迫耐受能力。因此,本文推测在实验后期,卵孢金孢藻有可能通过提高藻胆蛋白等其他光合色素的含量,从而在叶绿素a含量受抑制的情况下维持光合活性。
在本研究中,卵孢金孢藻滤液对铜绿微囊藻的生长和叶绿素含量表现出明显的“先促后抑”的趋势。铜绿微囊藻在滤液培养初期的促进作用,可视为一种“毒性兴奋效应”;在实验后期,铜绿微囊藻叶绿素a含量显著减少,表明铜绿微囊藻的叶绿素a是卵孢金孢藻代谢产物主要靶目标。叶绿素a是藻细胞捕光系统中起主要作用的光合色素,对于化感物质比较敏感,也可能是许多化感物质的作用靶点[9]。研究表明,N-苯基-2-萘胺[32]、阿魏酸[33]和芦荟大黄素[34]等多种物质都会引起铜绿微囊藻细胞中叶绿素a含量降低。此外,藻细胞受到化感物质胁迫时,会产生较多的活性氧,从而对细胞产生氧化损伤[4],过量的活性氧也会促进叶绿素a的降解[35]。在实验结束时,铜绿微囊藻的α、ETRmax和Ik均与对照组无显著差异,而在Zhang等[22]的实验中,卵孢金孢藻滤液不仅对片状微囊藻的生长产生显著抑制,对其PSⅡ也产生了显著抑制。卵孢金孢藻对2种微囊藻光合系统的影响并不一致,可能是由于不同微囊藻的生物特性不同,对前者代谢产物耐受力也有差异[36]。另外,Rzymski等[37]的研究表明,CYN能强烈影响同一水体中其他浮游植物碱性磷酸酶的释放量,并且对于其他非产CYN的蓝藻(如铜绿微囊藻)的刺激作用更为明显;Zhang等[22]的研究表明,化感作用有助于水体优势种由片状微囊藻转变为卵孢金孢藻。结合本文研究结果,这可能说明产CYN的蓝藻的主要化感抑制的靶目标可能是同一水体中的其他蓝藻。

表1 实验首末滤液中可溶性无机磷酸盐(DIP)的浓度变化Table 1 The changes of dissolved inorganic phosphate (DIP) concentration at the beginning and the end of the filtrate incubation
3.2 卵孢金孢藻与四尾栅藻间的化感作用
本实验中,四尾栅藻滤液培养下的卵孢金孢藻的生长和叶绿素a含量在2 d后明显下降,受到明显的抑制作用。实验结束时培养基中DIP浓度有所上升,可能由于大量藻细胞死亡裂解将其内含物释放所导致。Qiu等[38]研究发现,四尾栅藻的培养滤液能够抑制水华微囊藻分泌胞外聚合物,并证实其代谢产物4-叔丁基邻苯二酚(TBC)能够通过干扰蛋白质和多糖的合成和分泌,抑制叶绿素合成,从而抑制了水华微囊藻的生长。滤液培养下卵孢金孢藻的Fv/Fm和Yield表现出先降后升的趋势,推测其在实验后期也有与铜绿微囊藻滤液培养下类似的适应性变化。
在本研究中,卵孢金孢藻滤液对四尾栅藻的影响并不明显,仅在实验后期能够提高其生物量,除此之外叶绿素a含量、叶绿素荧光参数等与对照组均无显著差异。Kovács等[39]的实验表明,拉氏拟柱孢藻、颤藻等丝状固氮蓝藻培养滤液会对四尾栅藻的光合活性起显著的抑制作用,但在本实验中,卵孢金孢藻滤液未表现出对四尾栅藻光合活性的抑制作用。郭沛涌等[40]研究发现,不同质量浓度的合果芋叶浸提液对四尾栅藻的抑制作用有所差异,抑制作用随质量浓度增加而增强,表明化感抑制作用强度与化感物质的浓度密切相关。由于本实验未对培养滤液中的化感成分/浓度进行测定,卵孢金孢藻滤液未对四尾栅藻表现出明显的化感作用,可能是滤液中有效化感物质浓度过低的原因。因此,有关卵孢金孢藻产生化感物质的分离测定有待进一步研究。
在本研究中,四尾栅藻对卵孢金孢藻表现出明显的化感抑制作用,而卵孢金孢藻未对四尾栅藻表现出抑制作用(表2),这可能表明,在室内培养条件下,化感作用能够使四尾栅藻更易获得竞争优势。但在自然生境中,四尾栅藻的优势度往往不及其他蓝藻,与室内实验的结果有所不同。因为蓝藻和绿藻对营养盐的偏好有所不同,绿藻在营养盐质量高的水体(超富营养水体)中更易占优势[41]。本实验培养基为BG11培养基,营养盐充足,而自然水体中藻类往往受到不同程度的营养盐胁迫。因此,在自然水体中,卵孢金孢藻与绿藻间的化感作用可能会受到营养盐水平的影响。Granéli等[42]的研究表明,若化感物质的产生者和目标藻类具有不同的营养偏好,在水环境中处于不同的营养限制状态时,可能会由于产生的化感物质较少导致化感作用不太明显。此外,这可能也在某种程度上,解释了在一些重度富营养化水体中,绿藻能对蓝藻产生明显化感抑制作用的现象[43]。

表2 滤液培养对微藻的抑制情况Table 2 The inhibition of filtrate culture on microalgae

