紫杉醇脂质体治疗进展期胃癌的疗效及安全性研究
许晓东,徐志英,谢君
(1.苏州大学附属张家港医院 药学部,江苏 张家港 215600;2.张家港市中医医院药学部,江苏 张家港 215600)
进展期胃癌的病情持续性进展,能够导致患者总体生存时间的下降,进而增加患者的病死风险[1]。部分地区的流行病学研究发现,进展期胃癌的发病率可超过384~595/万[2]。在进展期胃癌的治疗过程中,可以发现以紫杉醇(Paclitaxel,PTX)或者氟尿嘧啶类药物为基础的相关治疗方式,能够通过促进胃癌细胞的坏死吸收,促进癌细胞的凋亡,抑制胃癌细胞的持续性复制过程,进而改善胃癌的整体临床预后。但长期的临床随访观察研究发现,PTX 注射液治疗后,进展期胃癌患者的副反应发生率较高,其胃肠道反应、骨髓抑制、皮肤黏膜损伤的表现较为严重[3]。而PTX 脂质体是囊泡包裹缓慢释放的制剂,其能够在发挥PTX 抗肿瘤活性的基础上,提高药物的有效作用时间,延长药物的消除相半衰期,并能够提高药物的清除率[4]。本研究探讨PTX 脂质体联合氟尿嘧啶衍生物(S-1)化疗的临床效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年6月苏州大学附属张家港医院和张家港市中医医院治疗的进展期胃癌患者97 例作为研究对象。纳入标准:①无法手术切除的局部进展、复发或Ⅲb、Ⅳ期;②KPS 评分>60分;③预计生存时间>3 个月;④具有客观测量的病灶;⑤患者及家属知情同意。排除标准:①接受过其他化疗后≤6 个月出现疾病进展或接受过紫杉类和氟尿嘧啶类药物后≤1年出现疾病进展;②合并有心、肺、肝、肾等其他重要脏器疾病;③有其他恶性肿瘤者。根据患者最终选取的治疗方案分为观察组(n=47)和对照组(n=50),两组患者性别、年龄等一般资料比较,差异无统计学意义(P>0.05)。见表1。
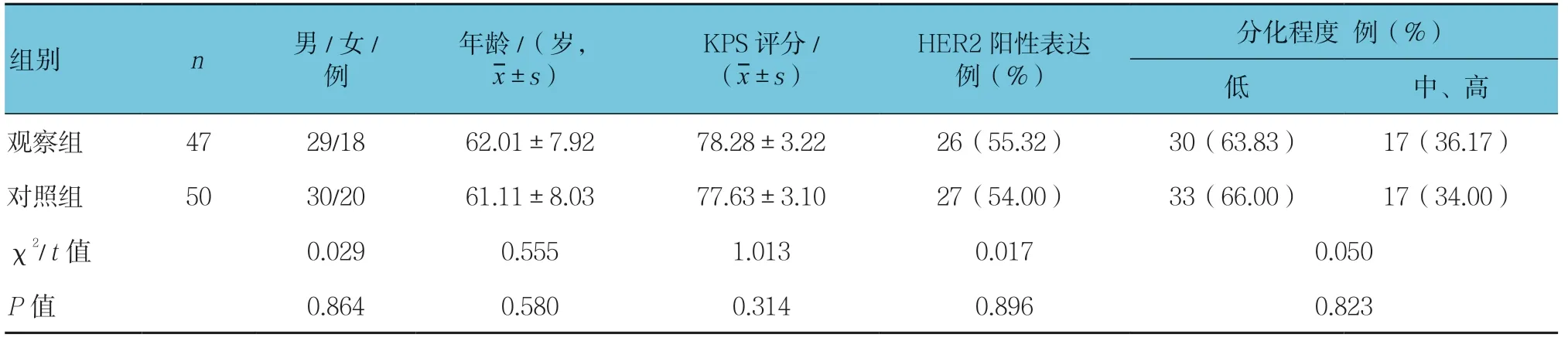
表1 两组一般资料比较
1.2 治疗方法
对照组:PTX 注射液(国药准字:H20053001,扬子江药业集团),135mg/m2,静脉滴注3h,第1 天,餐后口服S-1(山东新时代药业有限公司,国药准字:H20080802),80mg/(m2·d),早晚分2 次口服,第1~14 天;观察组:采用紫杉醇脂质体(国药准字:H20030357,南京绿叶制药有限公司),135mg/m2,静脉 滴注3h,第1 天,餐后口服S-1,80 mg/(m2·d),早晚分2 次口服,第1~14 天,21 d 为1 个周期,连续化疗 6 个周期。化疗前的预处理:使用紫杉醇脂质体前30 min 内,采用地塞米松5 mg 静脉注射,采用异丙嗪25 mg 肌内注射,预防紫杉醇过敏,化疗的过程中同时予以护胃、止吐、保肝等对症治疗,并维持每日补液量2 500~3 000 ml。
1.3 判断标准
①参照RECIST 实体瘤疗效评价标准[5]分为:完全缓解(CR):病灶完全消失;部分缓解(PR):肿瘤 最大直径及最大垂直直径的乘积缩小>50%;疾病稳定(SD):肿瘤最大直径及最大垂直直径的乘积缩小<50%,或增大<25%;疾病进展(PD):肿瘤最大直径及最大垂直直径的乘积增大≥25%。有效=CR+ PR。②不良反应采用WHO 推荐的抗癌药物不良反应分级标准分为0~Ⅳ度[6],分级越高,不良反应越严重。
1.4 统计学方法
数据分析采用SPSS 19.0 统计软件,计量资料以均数±标准差(±s)表示,组间比较用t检验;计数资料以例(%)表示,比较使用χ2检验;等级资料采用秩和检验,采用Kaplan-Meier 绘制生存曲线,比较采用Two-stage 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组近期疗效比较
两组近期疗效比较,差异无统计学意义(P> 0.05)。见表2。
2.2 两组中位无进展生存时间比较
观察组和对照组中位无进展生存时间分别为 7 个月(95% CI:6.57,7.43)和6 个月(95% CI:5.67,6.33),两组比较,差异无统计学意义(χ2=2.011,P=0.322)。见图1。
2.3 两组不良反应比较
观察组骨髓抑制、脱发及关节肌肉疼痛较对照组轻(P<0.05);观察组和对照组恶心呕吐、肝功能受损及外周神经不良反应比较差异无统计学意义(P> 0.05)。见表3。
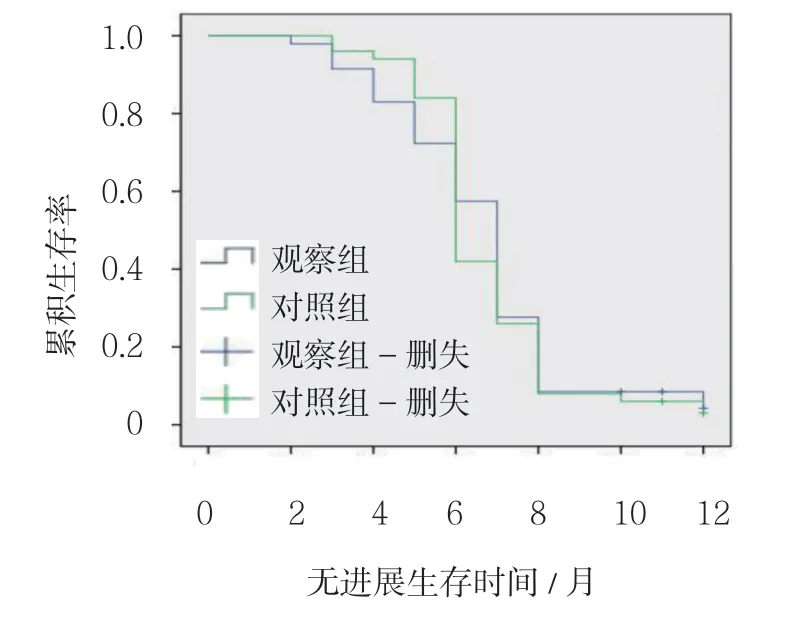
图1 生存曲线
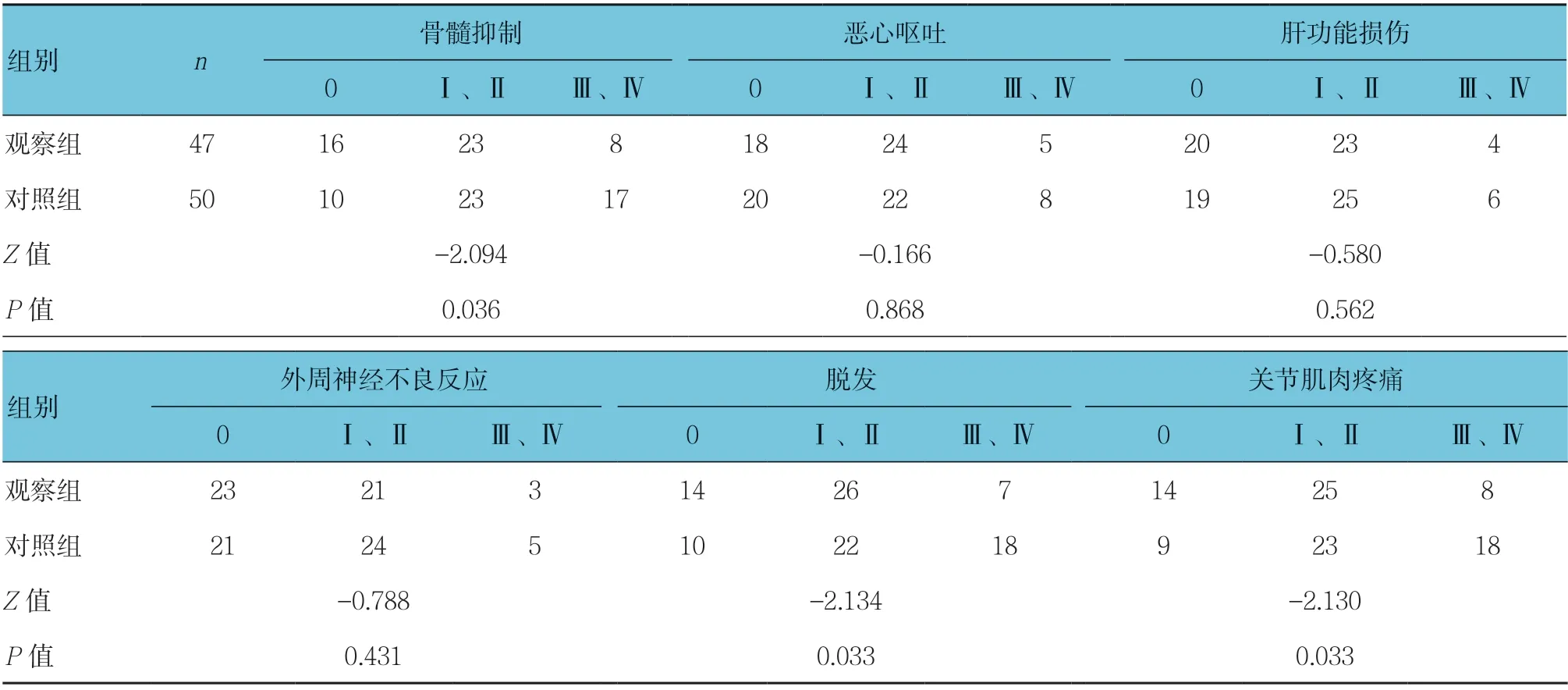
表3 两组不良反应比较 例
3 讨论
早期恶性肿瘤筛查水平的不足,能够增加进展期胃癌患者的患病比例,特别是在经济欠发达或者部分高危流行病区,进展期胃癌的发病率可进一步上调[7]。临床观察发现,进展期胃癌的3 或者5年的病死率可超过25%以上,同时在癌细胞分化程度较差或者发生淋巴结转移的患者中,进展期胃癌的生存预后的恶化更为明显[8]。静脉化疗药物能够在胃癌的中晚期治疗过程中发挥重要的作用,其能够抑制肿瘤的病情进展,改善患者短期内的高肿瘤负荷表现,并能够延长患者的总体生存时间[10]。
PTX 脂质体能够通过卵磷脂的包裹实现对PTX的缓慢释放,同时PTX 脂质体能够通过其双层分子囊状结构,进而延长药物的作用半衰期,并改善PTX 的表观药物分布容积。相关研究还认为,PTX 脂质体能够在体内的停留时间更长,在病灶组织内部的凝集浓度更高,进而更好发挥其对纺锤体分裂的阻断和细胞周期的调控作用,进一步促进胃癌上皮细胞的凋亡[10]。部分研究者探讨PTX 脂质体辅助治疗进展期胃癌的临床效果,认为PTX 脂质体能够提高短期内疾病的治疗总体有效率[11],但对治疗后的脱发、关节肌肉疼痛、消化道反应等的分析不足。
本研究发现,采用PTX 脂质体化疗后的观察组和对照组比较,近期疗效并无差异,其治疗后的病情完全缓解率或者部分缓解率并无明显的上升,提示PTX 脂质体并不能改善患者的近期治疗效果。但部分研究者认为PTX 脂质体治疗,能够提高进展期胃癌的部分缓解率,与本研究的结论有差异,考虑可能与PTX 脂质体化疗周期的不同或者化疗剂量的不同等因素有关。治疗后两组患者的疾病无进展生存期无差异,提示PTX 脂质体能够达到相似的远期预后治疗效果,但并不能进一步延长患者的无进展生存时间,这主要由于无进展生存时间的不同与患者的临床分期、癌细胞分化程度或者组织学分级等因素有关,而与不同药物加工形式或者药物剂型并无密切的关系。本研究重点探讨PTX 脂质体治疗后患者不良反应的发生情况,可以发现观察组患者化疗后,其骨髓抑制、脱发及肌肉关节疼痛的发生率均下降,低于对照组,提示PTX 脂质体对患者不良反应的改善有作用。其原因主要考虑与PTX 脂质体的下列几个方面的药物作用优势有关[12]:①PTX 脂质体具有较高的组织相容性和细胞亲和性,能够提高局部肿瘤病灶组织内的有效弥散浓度,降低对正常组织细胞的损伤;②PTX 脂质体的药物消除半衰期是普通紫杉醇注射液的2 倍,进而避免药物浓度对组织器官的损伤,提高PTX 脂质体的药物安全性。杨凌玲等[13]研究也发现,PTX 脂质体治疗后,患者骨髓抑制的发生率可平均下降5%以上,特别是4 度骨髓抑制或者严重肝肾损伤的风险也明显地下降。
综上所述,PTX 脂质体能够有效辅助治疗进展期胃癌,药物安全性更高,其骨髓抑制、关节肌肉疼痛或者脱发等不良反应程度较非脂质体轻。

