3D及2D腔镜甲状腺全切术治疗分化型甲状腺癌的疗效比较
黄 钰 赵冬夏 李长江
甲状腺癌属于恶性内分泌肿瘤,大多数起源于滤泡上皮细胞,发病原因与碘缺乏引起甲状腺激素减少、促甲状腺激素(thyroid stimulating hormone,TSH)水平升高、放射线、家族因素及其他甲状腺疾病有关[1]。甲状腺癌中90%以上为分化型甲状腺癌,目前甲状腺癌治疗仍以手术治疗为主[2]。目前,腔镜手术广泛应用于外科治疗,且随着外科技术以及腔镜技术不断改进,3D腹腔镜应运而生。有研究[3]将3D腔镜应用于甲状腺切除术中,发现其能还原真实视觉中的手术视野,较2D腔镜手术更为精确。甲状腺激素水平可有效反映甲状腺功能[4],外周血循环肿瘤细胞(circulating tumor cell,CTC)可反映治疗效果[5],本研究通过监测甲状腺激素水平、CTC变化来进一步分析比较3D腔镜和2D腔镜甲状腺全切术对分化型甲状腺癌患者效果的差异。现报道如下。
1 资料与方法
1.1 一般资料 选取2016年1月至2019年1月河南省直第三人民医院收治的分化型甲状腺癌患者64例为研究对象,根据随机数字表法将患者分为3D组和2D组,每组各32例。纳入标准:①年龄≤80岁;②经病理证实为分化型甲状腺癌;③结节直径≤6 cm;④多癌灶或合并对侧甲状腺结节,行甲状腺全切术;⑤患者对本研究充分知情。排除标准:①伴有颈区转移;②具有颈部手术史者;③具有手术禁忌证者;④不配合研究者。其中3D组男性7例,女性25例,年龄41~75岁,平均(55.27±6.34)岁,病程1~6年,平均(4.13±1.56)年,结节直径0.8~5.4 cm,平均(3.21±0.68) cm。2D组男性10例,女性22例,年龄40~77岁,平均(56.81±7.10)岁,病程1~8年,平均(4.92±1.78)年,结节直径0.5~5.3 cm,平均(3.05±0.74) cm。两组患者性别、年龄、病程和结节直径比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准同意。
1.2 治疗方法 腔镜甲状腺全切术步骤:全麻成功后,取患者平卧位,肩部垫高,消毒铺巾后,在患者一侧乳晕边缘行10 mm弧形切口,向颈部通过长注射器注射膨胀液,通过套管针穿刺至胸壁与颈部交界处,置入腔镜镜头,同时连入CO2并维持气腹压在6 mmHg(1 mmHg≈0.133 kPa)。采用超声刀将皮瓣游离(从切口处开始游离,上至甲状软骨,左右至胸锁乳突肌中外侧,下至甲状腺腺体),建立手术操作空间。切开颈白线暴露甲状腺腺体,在甲状腺真假包膜间解剖甲状腺组织,先沿气管将峡部切开,游离甲状腺上极,然后游离甲状腺下极,下极血管切断后,向内牵拉腺体,使甲状腺上极血管离断。为避免伤及喉返神经,需在甲状腺下极处显露喉返神经后,方可将含有肿瘤的甲状腺腺体切除,并取出送病理科检查。待病理确诊甲状腺癌后,使喉返神经全部显露,待切断Berry's韧带后,将肿瘤侧残余甲状腺组织及对侧甲状腺组织一同完整切除。手术全程注意保护甲状旁腺及喉返神经。手术创面采用生理盐水冲洗,确认无出血后,进行负压引流,采用可吸收线缝合颈白线。
3D组和2D组手术方法相同,3D组采用Olympus 3D高清腔镜系统,2D组采用Olympus 2D高清腔镜系统。
1.3 观察指标
1.3.1 围手术期指标 记录两组患者手术时间、术中出血量、术后引流时间及住院时间。
1.3.2 甲状腺激素相关指标检测 采集患者入院第2天及术后第7天晨起空腹静脉血,室外静置20 min,低温3 000 r/min离心10 min,取上清,待检测。采用电化学发光免疫分析法检测血清三碘甲状腺原氨酸(triiodothyronine,T3)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、甲状腺激素(thyroxine,T4)、游离甲状腺激素(free thyroxine,FT4)、TSH水平。
1.3.3 CTC水平检测 术前、术后第3天采集患者晨起空腹静脉血10 mL,采用FACS Calibur流式细胞仪(美国BD公司)CellSearch方法检测CTC计数。
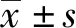
2 结果
2.1 两组患者围手术期指标比较 两组患者术后引流时间、住院时间差异均无统计学意义(P>0.05),3D组手术时间短于2D组,术中出血量少于2D组,差异均有统计学意义(P<0.05)。见表1。

表1 两组患者围手术期指标比较
2.2 两组手术前后甲状腺激素相关指标水平比较 两组患者手术前后T3、T4、FT3及FT4差值比较,差异均无统计学意义(P>0.05)。见表2。

表2 两组患者手术前后甲状腺激素相关指标水平变化比较
注:与术前比较,*P<0.05;T3为三碘甲状腺原氨酸,T4为甲状腺激素,FT3为游离三碘甲状腺原氨酸,FT4为游离甲状腺激素,TSH为促甲状腺激素
2.3 两组患者手术前后CTC水平比较 术前两组患者CTC水平差异无统计学意义(P>0.05),3D组CTC水平手术前后差值小于2D组,差异有统计学意义(P<0.05)。见表3。
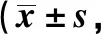
表3 两组手术前后CTC水平比较个/10mL)
3 讨论
外科手术是甲状腺癌治疗的最主要方式,术中采用Kocher切口为早期甲状腺癌常用方式,但术后会在颈部留下瘢痕,影响美观。腔镜甲状腺切除术切口小,且切口位于隐蔽部位(如腋窝、胸部、乳晕等处),易于被患者接受[6-7]。
本研究采用3D腔镜和2D腔镜甲状腺全切术治疗分化型甲状腺癌患者,结果显示,3D组手术时间显著短于2D组,术中出血量显著少于2D组,说明3D腔镜手术能有效缩短手术时间,减少术中出血量,与柳学文等[8]的研究结果一致。分析原因,2D腔镜无法提供立体视野,缺乏对组织深度及层次的感知,操作时会出现手眼不协调现象[9]。3D腔镜解决了影像透射问题,并将镜头进一步缩小以扩大手术操作空间,相对于2D腔镜具有以下优势:①3D腔镜还原了真实解剖视野,改善医师对组织深度及层次的感知,手术操作中能准确定位,清晰区分各血管、神经走向,大大减少组织解剖、分离、抓取、缝合等操作时间。②3D腔镜系统具有较轻的烟雾效应,可减少医师手术过程中镜头擦拭次数,从而提高手术效率[10-13]。
甲状腺由峡部连接左右两叶,是重要的内分泌器官,主要合成分泌甲状腺激素,参与机体内环境稳态调节。甲状腺全切除术后,因甲状腺体组织缺失,会引起甲状腺激素水平降低,需介入TSH抑制治疗[14]。甲状腺激素包括与甲状腺球蛋白结合的T3和T4,及具有生理活性的FT3、FT4。TSH是垂体受促甲状腺激素释放激素刺激后产生的激素,能促进甲状腺激素合成分泌,而甲状腺激素又可通过反馈调节,抑制促甲状腺激素释放激素水平,维持甲状腺激素水平稳定[15]。本研究结果显示,3D组和2D组术后T3、FT3、T4及FT4均明显降低,TSH均明显升高,说明腔镜甲状腺全切术后甲状腺激素降低,无法起到负反馈调节作用,从而导致TSH水平升高,需要长期进行TSH抑制治疗。两组术前术后甲状腺相关激素水平差值比较无明显差异,说明3D腔镜和2D腔镜全切除术治疗甲状腺癌的对甲状腺功能的影响相当。
CTC是指血液循环中来自于肿瘤原发灶或转移灶的肿瘤细胞。有研究[16]显示,与术前比较,食管癌患者术中及术后CTC水平均明显增加,认为术中对肿瘤挤压可促进肿瘤细胞进入血液循环。本研究在进行甲状腺全切术时,操作仔细小心,尽量减少术中对肿瘤的挤压,结果显示,3D组CTC手术前后差值小于2D组,提示相对于2D腔镜术,3D腔镜术能更有效控制CTC水平。原因可能与3D腔镜术中对肿瘤挤压较少,且操作副损伤较少有关。
综上所述,与2D腔镜甲状腺全切除术相比,3D腔镜甲状腺全切除术治疗甲状腺癌对甲状腺功能影响相当,但后者更具优化手术指标、减少血液循环肿瘤细胞负荷的优势。

