卵形鲳鲹组织蛋白酶B基因的克隆及表达分析
朱 鹏 胡 舒 乔瑞峰 廖永岩 王姝懿 彭金霞 陆专灵 韦友传
(1. 北部湾大学海洋学院, 广西北部湾海洋生物多样性养护重点实验室, 钦州 535011; 2. 广西大学动物科学技术学院,南宁 530004; 3. 广西水产科学研究院广西水产遗传育种与健康养殖重点实验室, 南宁 530021)
组织蛋白酶B(Cathepsin B, CatB)属于组织蛋白酶家族的半胱氨酸蛋白酶, 以酶活性中心具有Cys-His双氨基酸基团为主要分子特征[1,2]。机体中的树突状细胞、B淋巴细胞和巨噬细胞表面的主要组织相容性复合体Ⅱ(Major Histocompatibility Complex, MHCⅡ)通过抗原递呈作用, 将抗原信息传递给B细胞, 从而产生特异性抗体, 发挥免疫功能。CatB可降解MHCⅡ恒定链(Invariant chain), 促进MHCⅡ成熟, 调节抗原递呈作用[3]。此外,CatB还参与抗原降解[4]、细胞凋亡[5]、肿瘤的发生与转移[6]等多种生理活动。成熟的CatB由无活性的前体酶原(Preprocathepsin)水解产生, 空间结构包含L型域和R型域, 两者向内延伸形成V型活性中心[7]。与其他组织蛋白酶比较, CatB缺乏高度保守的ERFNIN基序[8], 且CatB具有双切酶特性, 在正常生理情况下CatB在溶酶体内参与蛋白质的降解过程, 其活性位点是闭合环状结构, 表现活性为外切酶活性[9];在病理条件下, CatB参与的生理过程位于溶酶体外, 闭合环状打开后表现为内切酶活性[10]。
目前,CatB基因已在人(Homo sapiens)[11]、小鼠(Mus musculus)[12]等哺乳动物和鱼类的斜带石斑鱼(Epinephelus coioides)[13]、条石鲷(Oplegnathusfasciatus)[14]、牙鲆(Paralichthys olivaceus)[15]、建鲤(Cyprinus Carpiovar Jian)[16]、斑点叉尾鮰(Ictalurus punctatus)[17]、大菱鲆(Scophthalmus maximus)[18]、大黄鱼(Pseudosciaena crocea)[3]中得到克隆鉴定, 这些成果为卵形鲳鲹(Trachinotus ovatus)CatB(TroCatB)研究提供科学参考。卵形鲳鲹是我国华南沿海地区重要的海水养殖经济鱼类。随着养殖规模的扩大, 由溶藻弧菌等病原感染引起的传染性疾病不时发生, 给广西沿海地区卵形鲳鲹的养殖业造成严重危害, 造成巨大的经济损失[19—21]。因此, 有必要开展卵形鲳鲹免疫相关基因的研究, 以期为卵形鲳鲹的病害防控提供理论支撑。迄今, 未见关于TroCatB基因的研究报道。本实验室在完成TroCatL的研究基础上[22], 本次研究应用RT-PCR和RACE技术克隆TroCatB基因全长cDNA, 利用生物信息学方法进行分子结构和进化分析, 建立实时荧光定量PCR(Realtime quantitative PCR, qPCR)方法, 检测TroCatB基因在健康组织中的表达情况以及溶藻弧菌(Vibrio alginolyticus)感染后其mRNA的表达变化, 为进一步研究TroCatB在免疫过程中的功能以及其对病原的抗病机理奠定基础。
1 材料与方法
1.1 实验动物处理与菌株
实验所用的卵形鲳鲹[体重(225.47±15.28) g],共55尾, 来源于北海市铁山港区石头埠丰顺养殖有限公司, 挑选健康活力强的个体暂养于实验室循环海水水族箱内, 盐度20‰—30‰, 水温25—27℃、pH 7—8.1, 溶解氧5 mg/L以上, 24h连续充气。实验前暂养7d, 每天投喂卵形鲳鲹商品饲料1次。感染用溶藻弧菌菌株由本实验室从患病卵形鲳鲹中分离鉴定, 回归感染确定具有致病性。
1.2 TroCatB基因cDNA全长克隆与序列分析
总RNA的提取和RT-PCR根据TRIzol®Reagents(Invitrogen, USA)试剂产品使用手册提取卵形鲳鲹脾脏的总RNA。参照RT-PCR试剂盒说明书, 合成卵形鲳鲹cDNA第一链: 反应体系为20 μL,总RNA模板为2 μg, 所得cDNA放入-80℃冰箱中保存备用。参照NCBI网站上已知的深裂眶锯雀鲷(Stegastes partitus; GenBank: XM008300468)、斜带石斑鱼(GenBank: KC832926)和大黄鱼(GenBank:XM010732314)的CatB基因氨基酸序列比对结果,进而设计出TroCatB的巢式PCR兼并引物(表 1), 引物由上海生工生物有限公司合成。

表 1 本文所用引物的核苷酸序列Tab. 1 Nucleotide sequences of primers used in this paper
TroCatB基因cDNA中间片段扩增cDNA第一链作为模板, 运用巢氏PCR技术获取TroCatBcDNA的中间片段, PCR反应体系及程序为: 第一轮PCR反应体系: cDNA模板1 μL, 10 ×buffer 2.5 μL,dNTP mix(10 mmol/L)0.25 μL, 上下游引物各1 μL(表 1, 上游为TroCatBF1/下游为TroCatBR1),Taq酶1 μL, 加ddH2O至终体积25 μL。第二轮PCR反应以第一轮PCR产物稀释50倍后作为模板,反应体系中仅把模板和引物替换, 分别为TroCatBF2/R2(表 1), 以同样的反应程序进行PCR扩增。程序都为: 94℃ 4min; 94℃ 30s, 65℃ 30s, 72℃ 60s(5 cycles); 94℃ 30s, 63℃ 30s, 72℃ 60s(5cycles); 94℃30s, 61℃ 30s, 72℃ 60s(20 cycles); 72℃延伸10min。PCR产物纯化后与pMD-18T载体(TaKaRa)连接,转化大肠杆菌TOP10, 阳性克隆送上海生工公司测序。
TroCatB基因cDNA末端扩增根据中间片段测序结果, 设计RACE-PCR引物(表 1)。参照SMART RACE cDNA Amplification Kit试剂盒说明书, 制备卵形鲳鲹5′和3′ SMART cDNA第一链。获取5′末端的反应体系中, 第一轮PCR反应以卵形鲳鲹5′ SMART cDNA 1 μL为模板, 加入5′末端外引物TroCatB-5R1、UPM(表 1)各1 μL,Taq酶1 μL, 加水至终体积25 μL。PCR反应条件同中间片段的扩增条件。第二轮PCR反应以第一轮PCR产物稀释50倍后作为模板, 引物为TroCatB5R2和NUP(表 1),其他同第一轮。同理, 获取TroCatB基因的3′末端。5′和3′ RACE第二轮扩增产物的处理与中间片段相同。
TroCatB基因cDNA序列生物信息学分析采用SeqMan软件拼接TroCatB基因cDNA全长序列;ExPASy网站(http://expasy.org/tool)的在线软件分析TroCatB基因的开放阅读框(Open Reading Frame,ORF)、蛋白分子量及其推导的氨基酸序列; 使用MegAlign、Signal4.1、SWISS-MODEL、MEGA5.0等软件分别进行TroCatB蛋白的同源性分析、信号肽预测、蛋白三级结构预测及构建N-J系统发育树(Neighbor-Joining tree)(设定bootstraps为1000)。
1.3 卵形鲳鲹的细菌感染处理及qPCR检测
实验用健康卵形鲳鲹饲养7d后, 取5尾麻醉, 分离脑、鳃、胃、肠、头肾、肝脏、心脏、脾脏、肌肉组织样品, 用于检测TroCatB在健康鱼体各组织的表达分布, 另外50尾卵形鲳鲹平均分为实验组和对照组。实验组每条腹腔注射0.1 mL浓度为1×107cfu/mL溶藻弧菌, 对照组注射等量灭菌的PBS。于注射后不同时间点(0、6h、12h、24h、48h)每次麻醉5条, 分别采集头肾、脾脏样品。所采集的样品放入液氮中冻存, 用于分析溶藻弧菌感染与TroCatB基因表达的关联性。
根据TroCatB基因全长序列设计qPCR引物, 以β-actin为内参, 引物分别标记为QCatB-F1/QCatBR1和β-actinF1/β-actinR1(表 1)。使用LightCycler®96(Roche)进行实时荧光定量PCR反应, PCR反应体系(20 μL)包含2 μL cDNA模板, 7.4 μL的H2O, 10 μL SYBR®Green PreMix ExTaqTMⅡ(TaKaRa), 上下游引物各0.3 μL。反应条件: 95℃ 3min; 94℃ 30s,64℃ 20s, 72℃ 20s(40 cycles), 每次延伸后荧光读板;72℃延伸3min。每个样品均重复3次。相对定量计算方法参照Pfaffl法[23]。
2 结果
2.1 TroCatB基因cDNA全长序列特征分析
测序结果显示, 5′端、中间片段和3′端的长度分别为961、591和783 bp。用SeqMan软件拼接得TroCatB基因cDNA全长为2181 bp(GenBank登录号:MK140677), 包括993 bp的ORF, 5′端和3′端非编码区(UTR)分别为391和797 bp, 3′端有poly(A)尾。TroCatB蛋白信号肽预测显示, 其信号肽序列位于氨基酸序列的的第1—18位, 序列为MWRAAFLL LAAGLSVSLA。氨基酸序列分析表明,TroCatB基因推定编码330个氨基酸残基, 理论等电点(pI)为5.73, 预测分子质量为36.37 kD, 存在半胱氨酸蛋白酶家族均有的前体结构域propeptide-C1(图 1,25—64 aa)、成熟肽区(79—328 aa)。还发现1个谷氨酰胺氧阴离子洞(101Gln)和半胱氨酸(107Cys)、组氨酸(277His)、天冬氨酸(297Asn)3个蛋白酶催化位点(图 1)以及三个蛋白酶活性区域: Cys活性区域(QGSCGSCWAFGA), His活性区(GGHAIKVLGWG),Asn活性区域(YWLCANSWNTDWGDNGYFKI)。两个N-糖基化结合位点(NTTW、NGSR)和决定CatB外切酶活性的闭合环状结构179Pro-199Glu)也被鉴定存在其中。
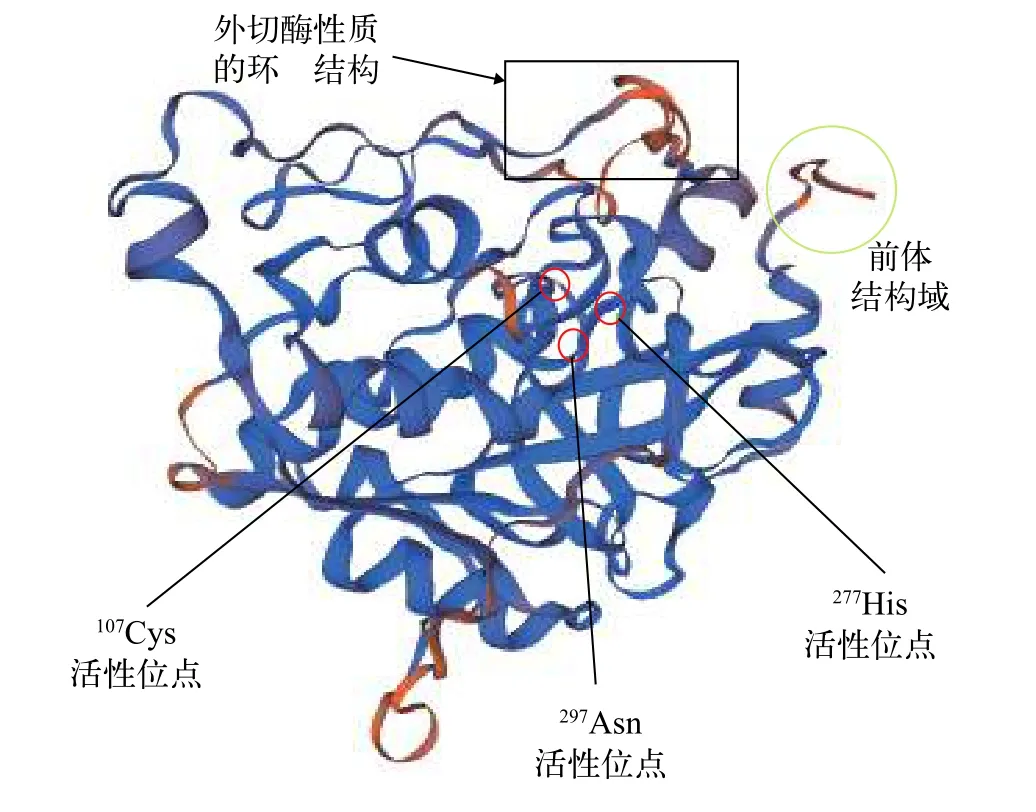
图 1 TroCatB蛋白三级结构预测Fig. 1 SWISS-MODEL tertiary structure simulation of TroCatB protein
2.2 TroCatB氨基酸序列的同源性及进化分析
将TroCatB与其他30个物种的同源基因的氨基酸序列进行同源性比对, 结果显示:TroCatB基因氨基酸序列与哺乳类的同源性在68.8%—72.2%, 与鸟类的同源性为69.4%—72.5%, 与爬行类的同源性最高为68.6%, 最低为67%, 与两栖类中的热带爪蟾的同源性为69.2%。与其他鱼类的同源性在78.8%—90.9%, 其中同源性最高的是髙体(Seriola dumerili, 90.9%), 最低的是北极红点鲑(Salvelinus alpinus,78.8%)。数据显示, 不同物种的peptidase-C1A-cathapsinB结构域(成熟肽区)的同源性普遍都在70%以上;TroCatB与其他鱼类的peptidase-C1A-cathapsinB结构域的同源性在80.0%—92.4%, 且与高体的同源性最高。邻近法构建NJ系统发育树发现(图 2), 进化树共分为哺乳类、鸟类、爬行类、两栖类和鱼类五枝, 其中卵形鲳鲹与其他鱼类聚为一枝, 并与鲈形目的高体距离最近, 表明卵形鲳鲹与其他鱼类的聚类, 并具有很高Bootstrap值。
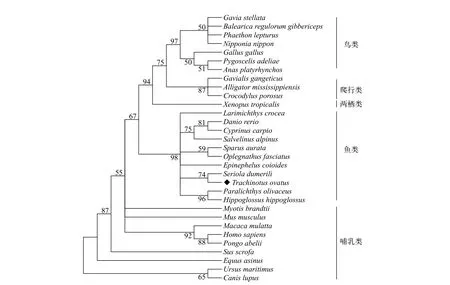
图 2 基于CatB氨基酸序列构建的系统发育进化树Fig. 2 Phylogenetic analysis of CatB amino acid sequence between Trachinotus ovatus and other species
2.3 TroCatB基因mRNA的组织表达水平分析结果
qPCR技术检测TroCatB基因mRNA在正常卵形鲳鲹各组织的表达水平(图 3)。结果显示,TroCatB基因在健康卵形鲳鲹的9个组织中均有表达, 且呈组成型分布。其中TroCatB在免疫器官脾脏中表达水平最高, 头肾、鳃、肠相对较高, 肌肉和脑组织中相对较低, 在心脏组织中表达水平最低。相对定量数据以心脏组织表达水平(设定为1)作为参照进行计算。
2.4 溶藻弧菌刺激后TroCatB基因mRNA的表达规律
溶藻弧菌刺激处理0、6h、12h、24h、48h后,实验组和对照组qPCR检测结果显示: 实验组TroCatBmRNA在脾脏、头肾组织中的表达水平较对照组均显著上调(*P<0.05, **P<0.01), 脾脏中的mRNA表达水平于6h达到最高值100.94倍, 头肾中mRNA表达量在刺激后12h达到最高水平。此后,相对于最高水平出现下降趋势, 但表达仍高于0时的正常表达水平(图 4)。
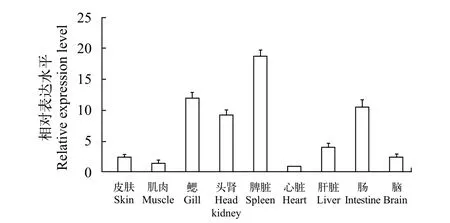
图 3 TroCatB基因mRNA在健康卵形鲳鲹各组织的相对表达水平Fig. 3 The relative expression of TroCatB mRNA in different tissues of healthy Trachinotus ovatus

图 4 溶藻弧菌刺激后TroCatB基因mRNA的表达变化Fig. 4 The TroCatB mRNA level post Vibrio anguillarum infection
3 讨论
3.1 CatB基因cDNA全长的克隆及生物信息学分析
CatB是半胱氨酸蛋白酶家族的典型代表, 在机体的免疫系统中发挥着重要作用。本研究克隆获得了TroCatB基因cDNA全长序列, 为2181 bp, 预测编码330个氨基酸的前体蛋白酶原, 其中含有18个氨基酸残基的信号肽、40个氨基酸残基的前体肽和249个氨基酸残基的成熟肽, 这些结果与已知的凡纳滨对虾(Litopenaeus vannamei)[24]、太平洋鲍(Haliotis discus hannai)[25]、大菱鲆[18]等CatB基因的研究结果类似。此外,TroCatB具有半胱氨酸蛋白酶家族共有的三个蛋白酶催化活性位点, 分别为半胱氨酸(107Cys)、组氨酸(277His)、天冬氨酸(297Asn),这与之前报道吻合[24]; 它们在催化位点的形成、稳定和蛋白酶三级结构的构建中起关键的作用[26,27],同样的结果在斑点叉尾鮰[17]、大菱鲆[18]、太平洋鲍[25]等的研究中也有出现, 但其氨基酸的序列位置不尽相同, 这可能是不同物种间的差异所致。CatB的三维结构较其他组织蛋白酶多含一个具有外切酶的活性的闭合环状结构, 这是CatB的典型特征; 此次研究中,TroCatB中也存在这样的结构, 这与之前关于大菱鲆[18]、大黄鱼[3]CatB的报道相似;不仅鱼类如此, 淡水贻贝(Cristaria plicata)[28]、太平洋鲍[26]等贝类的CatB结构中也含有此结构, 表明此结构在物种进化过程中相当保守, 是CatB的一个重要的功能结构域。
同源性及进化分析显示,TroCatB推定的氨基酸序列与其他鱼类的CatB氨基酸序列有较高的同源性(78.8%—90.9%), 表明TroCatB基因与条石鲷[14]等鱼类的CatB基因相似度高。将TroCatB的成熟肽与其他脊椎动物的成熟肽(peptidase-C1A-cathapsinB)之间进行比较发现, 各物种之间成熟肽的同源性普遍都在70%以上, 表明其在进化过程中高度保守。在系统发育树中, 卵形鲳鲹与其他鱼类聚类, 而哺乳类、两栖类、鸟类、爬行类则分别各自聚类, 并具有很高的Bootstrap值, 表明TroCatB与其他鱼类的CatB亲缘关系近, 暗示CatB基因在脊椎动物进化过程中相对保守, 这与它们的系统进化地位相适应。
3.2 CatB基因在不同组织中的表达分析
前人研究表明,CatB在机体抵御外源微生物入侵的过程中扮演着重要的角色。检测TroCatB基因的mRNA在健康卵形鲳鲹各组织的表达分布发现,TroCatB主要表达于卵形鲳鲹的脾脏、鳃和肠中,这与牙鲆[15]和大菱鲆[18]的CatB基因在正常组织中的表达分布研究结果相类似, 与大黄鱼[3]主要表达于脾脏、肝脏和肠相差异;TroCatB在脾脏组织中表达量最高, 这与条石鲷[14]主要在肝脏中表达相差异, 与斑点叉尾鮰[17]在后肾组织中主要表达相差异。以上结果表明,CatB在健康鱼类的免疫器官或免疫组织中具有高水平表达, 暗示着CatB基因在鱼类先天性免疫防御中发挥重要作用;TroCatB在脾脏组织中表达量最高, 暗示着CatB基因参与卵形鲳鲹的先天性免疫防御; 而不同鱼类的CatB基因在组织中的表达分布差异, 可能与个体的种类、生活环境的差异、遗传差异及生理状态有关。
3.3 溶藻弧菌刺激对卵形鲳鲹脾脏和头肾TroCatB mRNA水平的影响
经溶藻弧菌感染处理0—48h后,TroCatB基因在脾脏、头肾组织中均有明显表达变化, mRNA表达水平较对照组均显著上调, 脾脏组织中的表达量在刺激6h后显著上调约100.94倍, 头肾组织中的表达量在刺激12h后显著上调约86倍。此结果与斑点叉尾鮰经鮰爱德华菌(Edwardsiella ictaluri)免疫刺激[17]、牙鲆经脂多糖(LPS)刺激[15]、大菱鲆经迟缓爱德华氏菌(Edwardsiella tarda)刺激后[18], 其CatB基因的表达量均显著上调的结果类似。这些结果都揭示了鱼类CatB基因参与了机体抗细菌免疫反应的相关活动。
本结果为进一步研究CatB基因的在卵形鲳鲹免疫系统中的重要地位及其功能奠定基础和提供参考, 也对卵形鲳鲹养殖业的发展具有促进意义。
——奇妙的蛋

