miR-148a通过靶向调节己糖激酶2基因抑制乳腺癌细胞糖酵解和细胞增殖能力
张海涛, 张宇新
华北理工大学基础医学院,河北省慢性疾病基础医学重点实验室,河北 唐山 063210
乳腺癌是一种常见的恶性肿瘤,也是全球范围内女性罹患最多的恶性肿瘤之一,每年全球会新增270万患者[1]。目前,乳腺癌的临床治疗方法主要包括手术治疗、化疗、放射治疗等[2-3]。但手术治疗对于已经发生淋巴结转移的患者治疗效果较差,预后不良;化疗联合放射治疗主要用于中晚期或者已经发生远端转移的乳腺癌患者,毒副作用大,患者生存质量差。因此,有效提高乳腺癌患者的治疗效果、寻找潜在的分子靶点、提高患者的生存质量和预后、延缓肿瘤进程、降低恶性肿瘤的死亡率显得尤为重要。
微小RNA(microRNA,miRNA)是一类调控基因转录和表达水平的非编码小分子RNA,可通过靶向结合mRNA,直接降解或者抑制靶mRNA翻译,参与细胞生长、增殖等调控过程。miRNA在不同肿瘤组织和细胞中的表达量具有显著差异,并通过调节肿瘤细胞的增殖、侵袭等相关基因的表达,最终影响肿瘤细胞的生长、转移和血管生成等。研究发现,miRNA表达谱在正常乳腺组织和乳腺癌组织中的表达量具有明显差异,提示miRNA与乳腺癌的发生、发展密切相关[4-5]。其中,miR-148a在乳腺癌组织中的表达量较正常组织显著降低,并对乳腺癌的恶性演进过程具有一定的抑制作用[6-7]。恶性肿瘤细胞具有高水平有氧糖酵解的代谢特点,有氧糖酵解代替正常细胞的氧化磷酸化过程成为肿瘤细胞主要的糖代谢途径[8-9]。乳腺癌组织比正常组织生长迅速,不仅需要更多的能量,还需要生长过程所需的生物大分子,而糖酵解过程产生的中间产物可被肿瘤细胞用于合成生长过程中所需的蛋白质、核苷酸等物质[9]。糖酵解代谢作为乳腺癌细胞的主要代谢特征之一,其分子调控机制尚不清楚,且miR-148a对乳腺癌细胞糖代谢功能的影响也尚未见报道。
己糖激酶2(hexokinase 2,HK2)是糖酵解途径的首要关键酶,直接决定进入糖酵解的葡萄糖量。研究表明,虽然HK2在正常组织中的表达量较低,但在包括乳腺癌在内的大多数恶性肿瘤细胞中的表达量显著增加[10-11],且当乳腺癌组织发生转移时,HK2的表达量进一步升高[12]。提示HK2在乳腺癌细胞增殖、凋亡、侵袭、放化疗敏感性中发挥着重要作用。
为了探讨miR-148a是否通过靶向调控HK2来抑制乳腺癌细胞糖酵解代谢,本实验拟通过检测多种乳腺癌细胞系中miR-148a的表达量,从中筛选miR-148a表达量相对较低的乳腺癌细胞系作为研究对象。再通过观察miR-148a表达量的变化对乳腺癌细胞葡萄糖摄取量、乳酸生成量和细胞增殖指标的影响,以探究miR-148a对乳腺癌细胞糖代谢能力的影响。随后,通过TargetScan在线数据库预测miR-148a和HK2基因的靶向关系,再通过双荧光素酶报告实验、Western免疫印迹以及基因回复实验进行验证,以进一步明确miR-148a和HK2在乳腺癌细胞的糖酵解代谢途径中的作用机制,以期初步阐明miR-148a调控乳腺癌细胞糖酵解功能的分子机制。
1 材料与方法
1.1 材料与仪器
RPMI 1640培养基、胎牛血清购于美国Gibco公司;RIPA蛋白裂解液、BCA蛋白浓度检测试剂盒、辣根过氧化物酶标记的二抗、青-链霉素购于上海碧云天生物公司;NC膜、ECL发光试剂盒购于美国Milipore公司;SDS、Tris-base、丙烯酰胺购于美国BioSharp公司;miR-148a mimics(miR-148a过表达载体)、anti-miR-148a(miR-148a抑制载体)、miR-negative control(阴性对照)、pcDNA-HK2(HK2基因过表达载体)、HK2-MUT和HK2-WT荧光素酶报告基因载体购于上海吉玛生物制药有限公司;Opti-MEM培养基、Lipofectamine TM2000购于美国Invitrogen公司;反转录试剂盒、实时荧光定量PCR试剂盒购于北京康为试剂有限公司;双荧光素酶报告基因检测试剂盒购于北京威格拉斯公司;葡萄糖检测试剂盒购于上海荣盛生物药业有限公司;乳酸检测试剂盒购于美国Biovision公司;兔抗HK2、兔抗GAPDH购于美国Proteintech公司。
酶标仪(美国Bio-Rad公司);PCR仪(美国ABI公司);WB显影仪(美国ProteinSample公司)。
1.2 细胞培养及转染
人正常乳腺细胞Hs 578Bst和人乳腺癌细胞MCF-7、SK-BR-3、MDA-MB231分别采用含10%胎牛血清的RPMI 1640培养基在37 ℃、5%CO2培养箱中培养。
以对数生长期的细胞为转染对象,根据Lipofectamine TM2000转染试剂说明书将不同基因表达载体转染其中。6 h后,观察细胞状态并更换培养基。筛选miR-148a表达量相对较低的乳腺癌细胞实验所用的细胞不需要进行事先转染。
1.3 qRT-PCR检测乳腺细胞和不同乳腺癌细胞中miR-148a mRNA的表达情况
收集人正常乳腺细胞Hs 578Bst和人乳腺癌细胞MCF-7、SK-BR-3、MDA-MB231提取总RNA,逆转录为cDNA。以GAPDH为内参,采用qRT-PCR试剂盒通过PCR仪扩增检测,最终数据使用2-ΔΔCt方法分析。引物序列见表1。逆转录和qRT-PCR相应的反应体系和反应程序均按照试剂盒说明书操作。选择miR-148a表达量相对较低的乳腺癌细胞系作为后续研究对象。

表1 qRT-PCR所用引物Table 1 Primers used for qRT-PCR
1.4 miR-148a对乳腺癌细胞糖代谢能力的影响
分别转染miR-148a mimics、anti-miR-148a和miR-negative control至1.3筛选出的乳腺癌细胞系中,以未转染细胞作为空白对照,并检测相关指标(具体如下),以探究miR-148a对乳腺癌细胞糖代谢能力的影响。
1.4.1qRT-PCR检测miR-148a不同表达载体在乳腺癌细胞系中的表达情况 转染48 h后,收集乳腺癌细胞提取总RNA,逆转录为cDNA后进行qRT-PCR,具体操作同1.3。
1.4.2测定细胞葡萄糖摄取量 将乳腺癌细胞以每孔1×105个加入6孔板中,更换为无血清培养基,培养24 h后,收集细胞培养液,室温1 000 r·min-1, 离心5 min,去除沉淀杂质,即为上清液。
采用葡萄糖检测试剂盒进行测定,操作步骤如下:①工作液的配制:R1试剂∶R2试剂=1∶1,混合均匀后使用;②空白管、校准管、样本管的配置:工作液1 000 μL,分别加蒸馏水、校准液、上清液10 μL;③加样后用涡旋振荡器充分混匀,置于 37 ℃ 恒温水浴锅中水浴反应10 min;④使用酶标仪,波长500 nm,以空白管调零,读取校准管和样本管的吸光度;⑤按照试剂盒说明书计算上清液中葡萄糖水平,即为细胞的葡萄糖摄取量。
1.4.3测定细胞乳酸生成量 用乳酸盐标准品建立标准曲线;按照1.4.2中的方法获得上清液,吸取20 μL上清液、26 μL缓冲液、2 μL乳酸酶混合物混合均匀,室温下静置30 min,置于酶标仪中检测其在570 nm波长下的吸光度,根据标准曲线计算上清液中乳酸水平,即为细胞的乳酸生成量。
1.4.4BrdU法检测细胞增殖能力 将乳腺癌细胞接种于96孔板中,并调整细胞密度为1×104个·孔-1,置于培养箱中培养48 h。用PBS缓冲液将1 000×BrdU稀释为10×BrdU,再加入细胞培养基调整为1×BrdU,继续培养6 h。弃去原培养基,每孔加入200 μL FixDenat液,37 ℃孵育30 min;弃去FixDenat液,每孔加入100 μL anti-BrdU-POD溶液,37 ℃孵育90 min;弃去anti-BrdU-POD溶液,用PBS缓冲液清洗2次,每孔加入100 μL终止液,置于酶标仪中检测细胞在370 nm下的吸光值。存储分析数据。
1.5 miR-148a和HK2对乳腺癌细胞的糖酵解功能的影响
首先,通过TargetScan在线数据库(http://www.targetscan.org/vert_71/)预测miR-148a与HK2基因的靶向关系,再通过双荧光素酶报告实验、Western免疫印迹以及基因回复实验进行验证。
1.5.1双荧光素酶报告实验 将含有miR-148a结合位点的HK2的3′-UTR片段插入PGL3荧光素酶报告基因载体,构建野生型HK2(HK2-WT)和突变型HK2(HK2-MUT)的3′-UTR荧光素酶报告载体(上海吉玛生物制药有限公司),并分别共转染miR-148a mimics和anti-miR-148a至1.3筛选出的乳腺癌细胞系中,37 ℃、5%CO2培养48 h,收集细胞,测定双荧光素酶的活性,以未转染细胞作为对照,具体按照试剂盒说明书操作。
1.5.2Western免疫印记检测HK2蛋白的表达情况 将miR-148a mimics、anti-miR-148a和miR-negative control转染至1.3筛选出的乳腺癌细胞系中,37 ℃、5%CO2培养48 h后,收集细胞,以未转染细胞作为空白对照,提取总蛋白。使用10%的SDS-PAGE胶进行电泳分离,使用NC膜转膜后用含5%牛血清白蛋白的TBST溶液室温封闭2 h,在4 ℃冰箱内摇床孵育HK2(1∶1 000稀释)、GAPDH(1∶3 000稀释)一抗过夜,再于室温下摇床孵育二抗(1∶5 000稀释)2 h。使用化学发光法使条带显影。
1.5.3基因回复实验 分别将pcDNA-HK2和pcDNA-HK2+miR-148a mimics转染至1.3筛选出的乳腺癌细胞系中,以未转染细胞作为对照,再按照1.4.2~1.4.4所述步骤,测定miR-148a和HK2表达量的变化对乳腺癌细胞葡萄糖摄取量、乳酸生成量和细胞增殖指标的影响。
1.6 数据分析
用Prism 6软件作图、分析,实验均进行3次重复,两组之间比较采用Student’st检验。以P<0.05认为差异具有统计学意义。
2 结果与分析
2.1 miR-148a在不同乳腺癌细胞系中的表达情况
为了观察多种不同乳腺癌细胞系中miR-148a的表达情况,通过qRT-PCR检测MCF-7、SK-BR-3、MDA-MB231 3种乳腺癌细胞系中miR-148a mRNA表达水平。与人正常乳腺细胞Hs 578Bst相比,miR-148a在乳腺癌细胞系(MCF-7、SK-BR-3、MDA-MB231)中的表达量均明显降低,分别降低了1.8、2.2、3.1倍,尤其是在乳腺癌细胞系MDA-MB231中表达量显著降低(P<0.000 1)(图1)。为了便于研究miR-148a的功能,选择miR-148a表达量相对较低的乳腺癌细胞MDA-MB231作为后续研究的对象。
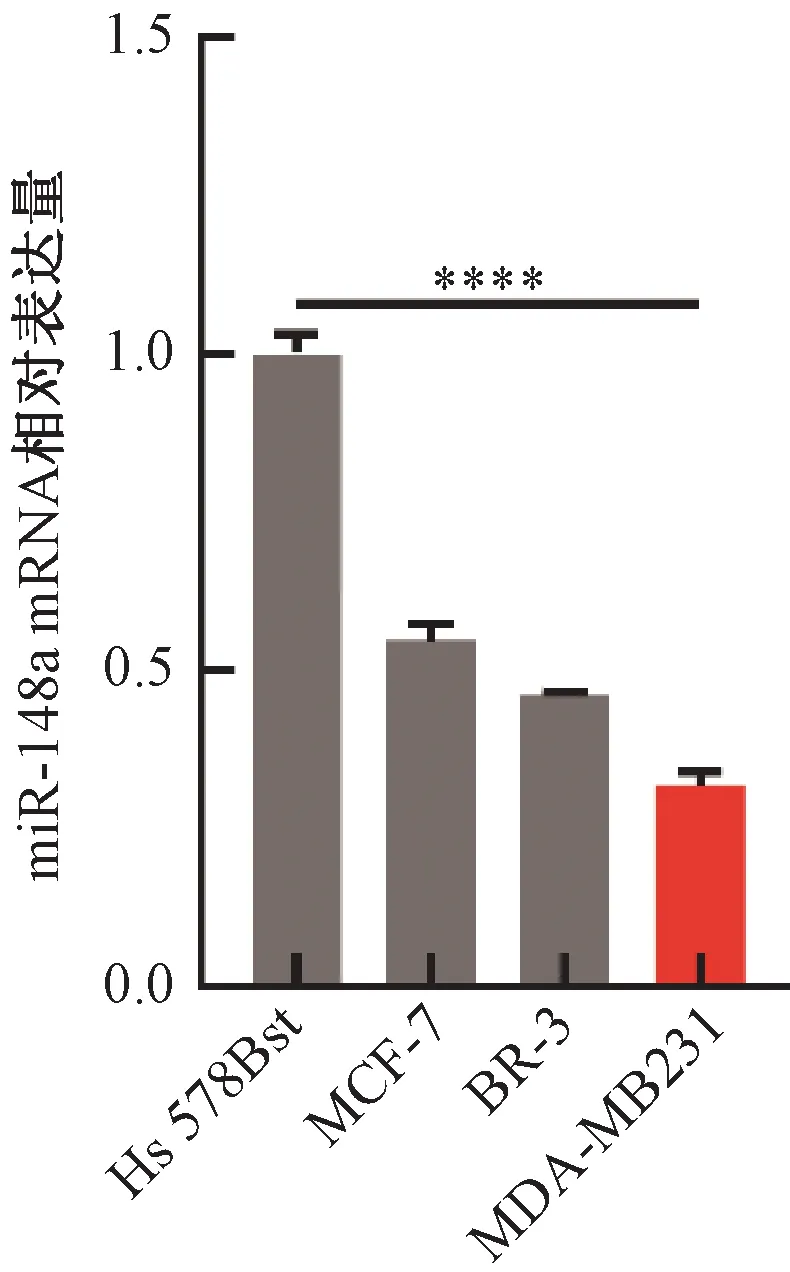
注:****表示miR-148a在MDA-MB231和Hs 578Bst中的相对表达量的差异在P<0.000 1水平上具有统计学意义。
2.2 miR-148a对乳腺癌细胞糖代谢能力的影响
2.2.1过表达miR-148a对MDA-MB231细胞的影响 MDA-MB231细胞培养至汇合率大于80%,分别将miR-negative control(阴性对照)和miR-148a mimics转染其中,以未转染细胞作为空白对照。为了检测miR-148a在MDA-MB231细胞中的转染效率,48 h后通过qRT-PCR检测miR-148a mRNA表达水平,发现与空白对照组相比,miR-148a在MDA-MB231中表达量上升2.3倍(P<0.001)(图2A)。按照公式计算检测过表达miR-148a后MDA-MB231细胞葡萄糖摄取量的变化,结果显示,与空白对照组相比,MDA-MB231细胞葡萄糖摄取量下降了1.8倍(P<0.01)(图2B)。通过建立乳酸标准曲线检测过表达miR-148a后MDA-MB231细胞乳酸生成量的变化,发现与空白对照组相比,MDA-MB231细胞乳酸生成量下降了2.4倍(P<0.001)(图2C)。通过BrdU法检测过表达miR-148a后对MDA-MB231细胞增殖的变化,结果显示,与空白对照组相比,MDA-MB231细胞增殖指标下降了2.2倍(P<0.001)(图2D)。
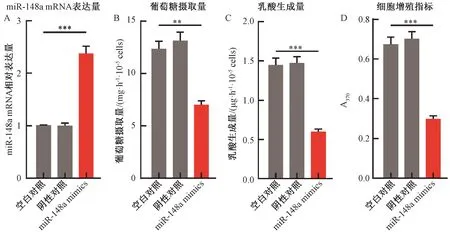
注:**和***分别表示miR-148a mimics组与空白对照组在同一指标上的差异在P<0.01和P<0.001水平上具有统计学意义。
2.2.2抑制miR-148a表达对MDA-MB231细胞的影响 MDA-MB231细胞培养至汇合率大于80%,分别转染miR-negative control和anti-miR-148a到MDA-MB231细胞中,以未转染细胞作为空白对照。为了检测miR-148a在MDA-MB231中的转染效率,48 h后通过qRT-PCR检测miR-148a mRNA表达水平,发现与空白对照组细胞相比,miR-148a在MDA-MB231中表达量下降10.0倍(P<0.000 1)(图3A)。通过公式计算抑制miR-148a表达后MDA-MB231细胞葡萄糖摄取量的变化,结果显示,与空白对照组相比,MDA-MB231细胞葡萄糖摄取量上升了1.6倍(P<0.01)(图3B)。通过建立乳酸标准曲线检测抑制miR-148a表达后MDA-MB231细胞乳酸生成量的变化,发现与空白对照组相比,MDA-MB231细胞乳酸生成量上升了1.7倍(P<0.01)(图3C)。通过BrdU法检测抑制miR-148a表达后对MDA-MB231细胞增殖的变化,结果显示,与空白对照组相比,MDA-MB231细胞增殖指标上升了1.6倍(P<0.01)(图3D)。
2.3 miR-148a和HK2对乳腺癌细胞的糖酵解代谢功能的影响
2.3.1miR-148a与HK2靶向关系预测 为了探究HK2是否为miR-148a的直接靶分子,采用TargetScan在线数据库(http://www.targetscan.org/vert_71/)进行预测,发现miR-148a与HK2基因3′-UTR区具有部分结合位点(图4A)。
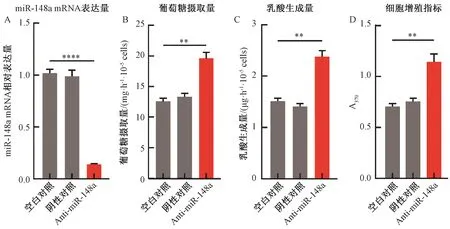
注:**和****分别表示Anti-miR-148a组和空白对照组在同一指标上的差异在P<0.01和P<0.000 1水平上具有统计学意义。

注:*、**和****分别表示处理组和对照组在同一指标上的差异在P<0.05、P<0.01和P<0.000 1水平上具有统计学意义;NS表示差异不具有统计学意义(P>0.05)。
2.3.2双荧光素酶报告实验 为了明确miR-148a与HK2的靶向关系,将miR-148a与HK2基因3′-UTR结合的区域进行突变,并分别构建含有PGL3荧光素酶报告基因的野生型HK2(HK2-WT)和突变型HK2(HK2-MUT)3′-UTR载体。将miR-148a mimics分别与HK2-WT和HK2-MUT共转染到MDA-MB231细胞中,48 h后,通过双荧光素酶报告实验观察miR-148a与野生型(HK2-WT)和突变型(HK2-MUT)mRNA结合的程度。结果显示,HK2-WT组双荧光素酶的活性下降2.8倍(P<0.000 1),而HK2-MUT组双荧光素酶的活性无明显改变(图4B)。将anti-miR-148a分别与HK2-WT和HK2-MUT共转染到MDA-MB231细胞中,结果发现HK2-WT组双荧光素酶的活性上升2.2倍(P<0.01),而HK2-MUT组双荧光素酶的活性无明显改变(图4C)。说明,miR-148a与野生型HK23′-UTR荧光素酶报告载体结合,不与突变型HK23′-UTR结合。
2.3.3Western免疫印迹检测 为了进一步验证miR-148a对HK2的调控作用,通过Western免疫印迹检测过表达和抑制miR-148a表达后MDA-MB231细胞中的HK2蛋白水平,结果显示,与空白对照组相比,过表达miR-148a组MDA-MB231乳腺癌细胞中的HK2蛋白表达量下降2.4倍(P<0.000 1),抑制miR-148a表达组MDA-MB231乳腺癌细胞中的HK2蛋白表达量上升1.2倍(P<0.05)(图4D、E)。
2.3.4miR-148a可逆转HK2过表达所致促葡萄糖摄取效应 为了观察HK2基因对MDA-MB231细胞葡萄糖摄取量的作用,把HK2基因过表达载体pcDNA-HK2转染到MDA-MB231细胞中,48 h后,通过公式计算检测过表达HK2基因后MDA-MB231细胞葡萄糖摄取量的变化,结果显示,与空白对照组相比,HK2过表达可使MDA-MB231细胞葡萄糖摄取量上升1.6倍(P<0.01)(图5A)。
为了探究miR-148a调控HK2基因的表达对MDA-MB231细胞葡萄糖摄取量的作用,将pcDNA-HK2与miR-148a mimics共转染MDA-MB231细胞中,结果发现 MDA-MB231细胞葡萄糖摄取量上升1.2倍,但无统计学意义(P>0.05)(图5A)。
2.3.5miR-148a可逆转HK2过表达所致促乳酸生成效应 为了观察HK2基因对MDA-MB231细胞乳酸生成量的作用,把pcDNA-HK2转染到MDA-MB231细胞中,48 h后,通过建立乳酸标准曲线检测过表达HK2基因后MDA-MB231细胞乳酸生成量的变化,结果显示,与空白对照组相比,MDA-MB231细胞乳酸的生成量上升1.5倍(P<0.01)(图5B)。
为了探究miR-148a调控HK2基因的表达对MDA-MB231细胞乳酸生成量的作用,将pcDNA-HK2与miR-148a mimics共转染MDA-MB231细胞,结果显示,MDA-MB231细胞乳酸生成量没有明显变化(P>0.05)(图5B)。
2.3.6miR-148a可逆转HK2过表达所致促细胞增殖效应 为了观察HK2基因对MDA-MB231细胞增殖作用的影响,把pcDNA-HK2转染到MDA-MB231细胞中,48 h后,通过BrdU法检测过表达HK2基因后MDA-MB231细胞增殖的变化,结果显示,与空白对照组相比,MDA-MB231细胞增殖指标上升1.7倍(P<0.01)(图5C)。
为了探究miR-148a调控HK2基因的表达对MDA-MB231细胞增殖的影响,pcDNA-HK2与miR-148a mimics共转染MDA-MB231细胞,结果显示,MDA-MB231细胞增殖没有出现明显的变化(P>0.05)(图5C)。
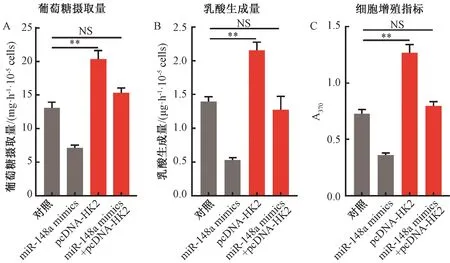
注:**表示pcDNA-HK2组与对照组在同一指标上的差异在P<0.01水平上具有统计学意义;NS表示差异不具有统计学意义(P>0.05)。
3 讨论
几乎所有的肿瘤中均出现miRNA的异常表达,并与肿瘤细胞的恶性生物学行为(如侵袭、增殖、转移等)密切相关[13-14]。已发现miR-320、miR-770、miR-421、miR-1246、miR-27a等miRNA可通过抑制癌基因的表达负向调控乳腺癌细胞的增殖或迁移、侵袭[15-19]。本研究中,miR-148a在MCF-7、SK-BR-3、MDA-MB231 3种乳腺癌细胞系中mRNA表达水平均明显下降,提示miR-148a与乳腺癌的发生、发展存在一定关系。为了便于研究miR-148a的功能,本研究选择miR-148a表达量相对较低的乳腺癌细胞MDA-MB231作为研究对象。
与正常组织细胞相比,糖酵解过程在恶性肿瘤组织中明显增强,而且即使在有氧环境中,恶性肿瘤细胞仍以糖酵解为主要的葡萄糖代谢途径,而不是产生更多ATP的氧化磷酸化途径[20]。本研究结果显示,在MDA-MB231细胞中过表达miR-148a可使细胞葡萄糖摄取量降低、乳酸生成量下降,并抑制细胞增殖;而抑制miR-148a表达,则增加葡萄糖摄取量和乳酸生成量,促进细胞增殖,提示miR-148a可抑制乳腺癌细胞的糖酵解能力和细胞增殖能力。
HK2作为糖酵解过程中重要的限速酶,通过催化葡萄糖分解为6-磷酸葡萄糖成为糖酵解发生的第一步关键调控酶,其在正常组织中的表达量较少但在肿瘤组织中的表达量异常[10-11],是导致肿瘤细胞糖酵解过程增强的重要原因之一。研究显示,多种miRNA可靶向调控HK2的表达进而调控肿瘤的糖酵解代谢途径[21-22]。本研究通过TargetScan在线数据库的预测结果,选取糖酵解限速酶HK2作为miR-148a的靶向抑制对象。双荧光素酶报告实验发现,miR-148a靶向HK2的3′-UTR,而突变位点未与miR-148a靶向结合,因此推测miR-148a可以靶向结合HK2mRNA的3′-UTR,抑制其蛋白质翻译过程。Western免疫印迹结果显示,过表达或抑制miR-148a的表达可以分别抑制或促进HK2基因表达,提示miR-148a能够靶向抑制HK2表达。为了进一步验证miR-148a可通过靶向抑制HK2来调控乳腺癌细胞的糖酵解能力,本实验通过转染过表达HK2载体,发现HK2基因过表达,可显著增加细胞葡萄糖摄取量、乳酸生成量,并促进细胞增殖;将过表达miR-148a载体与过表达HK2载体共转染MDA-MB231细胞,miR-148a则可逆转HK2所致的葡萄糖摄取量增加和乳酸生成量上升,并抑制细胞增殖,提示miR-148a可抑制乳腺癌细胞MDA-MB231的糖酵解和促细胞增殖能力。
综上所述,过表达miR-148a可以靶向抑制HK2基因的表达,导致乳腺癌细胞的葡萄糖摄取量下降、乳酸生成减少、细胞增殖降低,可为乳腺癌靶向治疗提供新靶点。但本研究仅进行了体外细胞实验,还需进行体内实验及临床实验研究,以期为乳腺癌诊断及评估患者预后提供分子标志物。

