氯化氢催化氧化制氯气在无梯度反应器上的反应行为考察
富岱奇,赵基钢,程丽华,宋楠,袁向前
(1.绿色能源化工国际联合研究中心 华东理工大学,上海 200237;2.广东省石油化工腐蚀与安全工程技术研究中心 广东石油化工学院,广东 茂名 525000)
氯气是生产含氯产品的基础原料之一[1-4],但在工业合成过程中其原子利用率不高,同时副产大量氯化氢。开发氯化氢催化氧化制氯气工艺,能够实现高效氯循环,成为当前的研究热点[5-8]。但该工艺存在反应温度高、热效应大、催化剂易失活等问题[9-11],多数研究者采用固定床反应器考察其反应行为[12-14],以期优化其工艺条件[15-18]。由于该物料体系的特殊性,采用无梯度反应器进行的反应行为考察较少有研究者涉及[19-21]。
本文采用浸渍法制备以γ-Al2O3为载体的铜基复合催化剂,在无梯度反应器上研究氯化氢催化氧化制氯气的反应行为,优化工艺条件,为实现氯元素的高效循环利用提供技术依据[22-23]。
1 实验部分
1.1 原料与仪器
氯化氢气体(纯度>99.9%),上海加杰特种气体有限公司;氧气(纯度>99.5%),上海申中气体有限公司;CuCl2、CeCl2、KI、NaOH均为分析纯;氢氧化钠标准溶液(0.102 4 mol/L),上海氯碱化工股份有限公司;硫代硫酸钠标准溶液(0.103 7 mol/L),上海氯碱化工股份有限公司。
BSI-2A无梯度反应器;D08-1F HCl质量流量计;MT-52 O2质量流量计。
1.2 催化剂制备
催化剂采用浸渍法制备[24-26]。分别称取一定量CuCl2和CeCl3用去离子水配制成溶液,质量分数分别为10%和5%,使用一定量的γ-Al2O3载体浸渍12 h 后除去过量溶液,在130 ℃下干燥3~5 h,然后在400~600 ℃下煅烧2~3 h,制得以γ-Al2O3为载体的铜基复合催化剂,催化剂平均粒径为2 mm。
1.3 工艺流程
本实验工艺流程见图1。实验中设置无梯度反应器温度T=360~400 ℃,设定无梯度反应器转速n=2 400 r/min,控制原料气摩尔比nHCl∶nO2=1~4,HCl空速FHCl0/W=1~40 h-1,向无梯度反应器内通入原料气,在常压条件下发生反应。待反应稳定后,在取样口用100 mL 0.2 mol/L的KI溶液吸收反应产物,取样时间为30 s,尾气经NaOH溶液吸收后排入大气。

图1 实验装置工艺流程图
1.4 性能评价指标
对KI吸收液先后用0.103 7 mol/L硫代硫酸钠标准溶液和0.102 4 mol/L氢氧化钠标准溶液进行滴定分析,分别测定产物的Cl2摩尔含量nCl2与HCl摩尔含量nHCl,转化率和反应速率分别通过式(1)和式(2)计算得到。
(1)
(2)
2 结果与讨论
2.1 反应温度的影响
2.1.1 与HCl转化率的关系 HCl转化率和反应温度的关系见图2。
由图2可知,反应温度对HCl转化率的影响十分显著,400 ℃时HCl转化率几乎是380 ℃时HCl转化率的1.5倍。在反应气体摩尔配比和反应空速均相同的条件下,反应温度越高,HCl转化率也越高。这也意味着,为了达到一定的HCl转化率,较低的反应温度需要更小的反应空速使HCl转化率达到要求,即需要更长的停留时间用于反应,因此适当地提高反应温度有利于HCl转化率的提高[27-28]。




图2 反应温度和HCl空速对HCl转化率的影响
2.1.2 与HCl反应速率的关系 HCl反应速率和反应温度的关系见图3。
由图3可知,在nHCl/nO2=1~4这4种实验条件下均存在这样的规律,即在气体摩尔配比和反应空速相同的情况下,温度越高,HCl的反应速率越大,并且反应速率随温度的变化趋势非常显著,其中400 ℃时HCl反应速率几乎是380 ℃时HCl反应速率的2倍。与此同时,为了达到相同的HCl反应速率,在反应温度较高的情况下,所需要达到的反应空速是较小的。因此,提高反应温度有利于加快HCl反应速率。



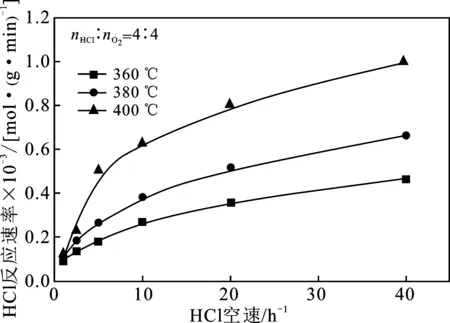
图3 反应温度和HCl空速对HCl反应速率的影响
2.2 反应气体摩尔配比的影响
2.2.1 与HCl转化率的关系 HCl转化率和反应气体摩尔配比的关系见图4。
由图4可知,随着反应气体摩尔配比nHCl/nO2的降低,达到相同HCl转化率时所需的HCl空速逐渐上升,即意味着反应需要更短的停留时间;另一方面,如果保持反应温度和HCl空速不变,那么随着反应气体摩尔配比nHCl/nO2的降低,HCl转化率是逐步上升的。这种现象说明适当降低反应气体摩尔配比nHCl/nO2有利于HCl转化率的提高,也意味着提高O2分压可以显著提高化学反应速率,有助于HCl氧化反应的发生[29]。
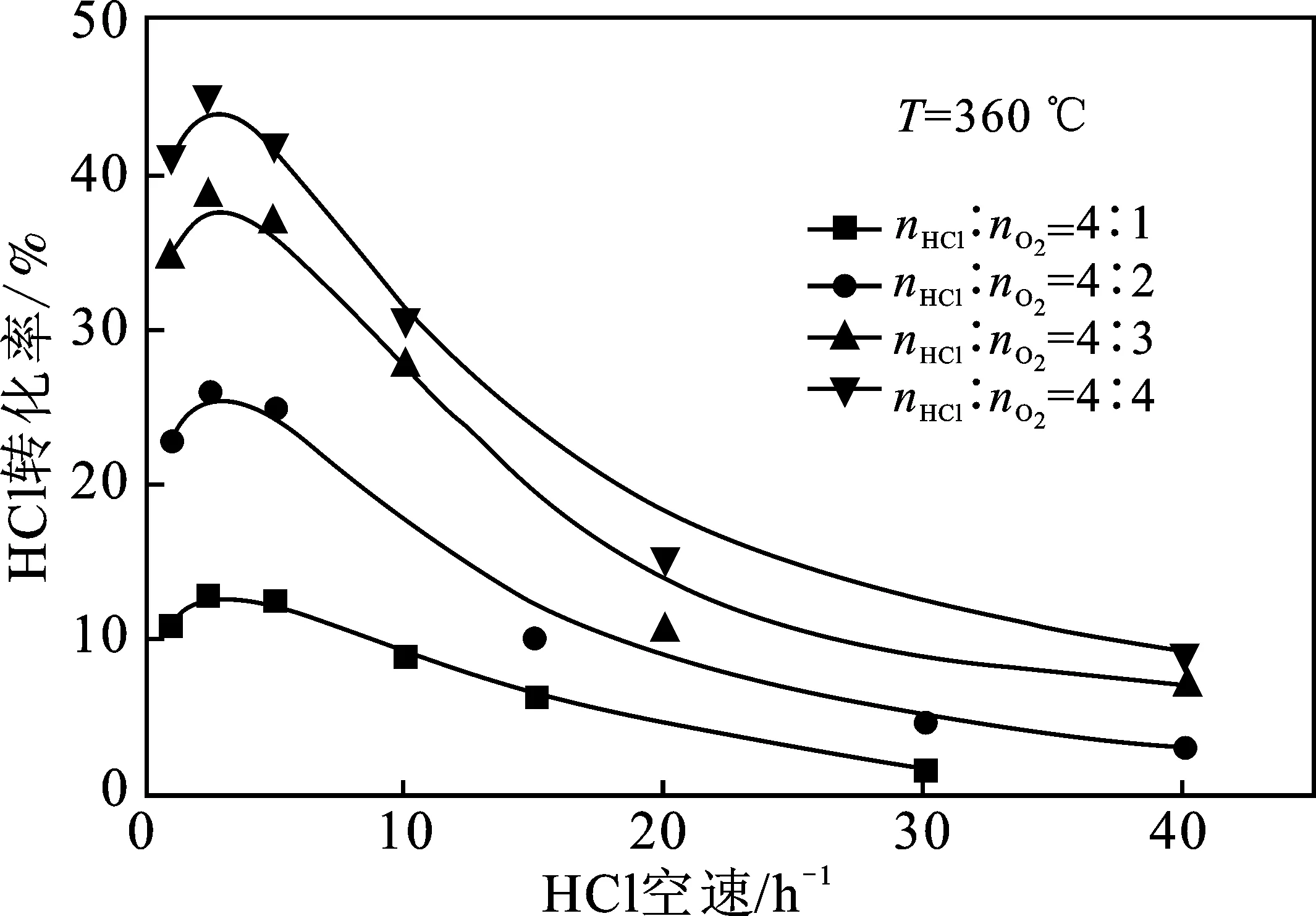

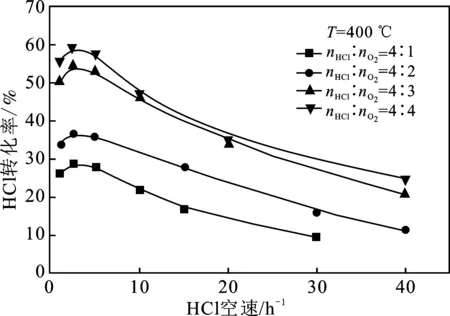
图4 反应气体摩尔配比和HCl空速对HCl转化率的影响
2.2.2 与HCl反应速率的关系 HCl反应速率和反应气体摩尔配比的关系见图5。
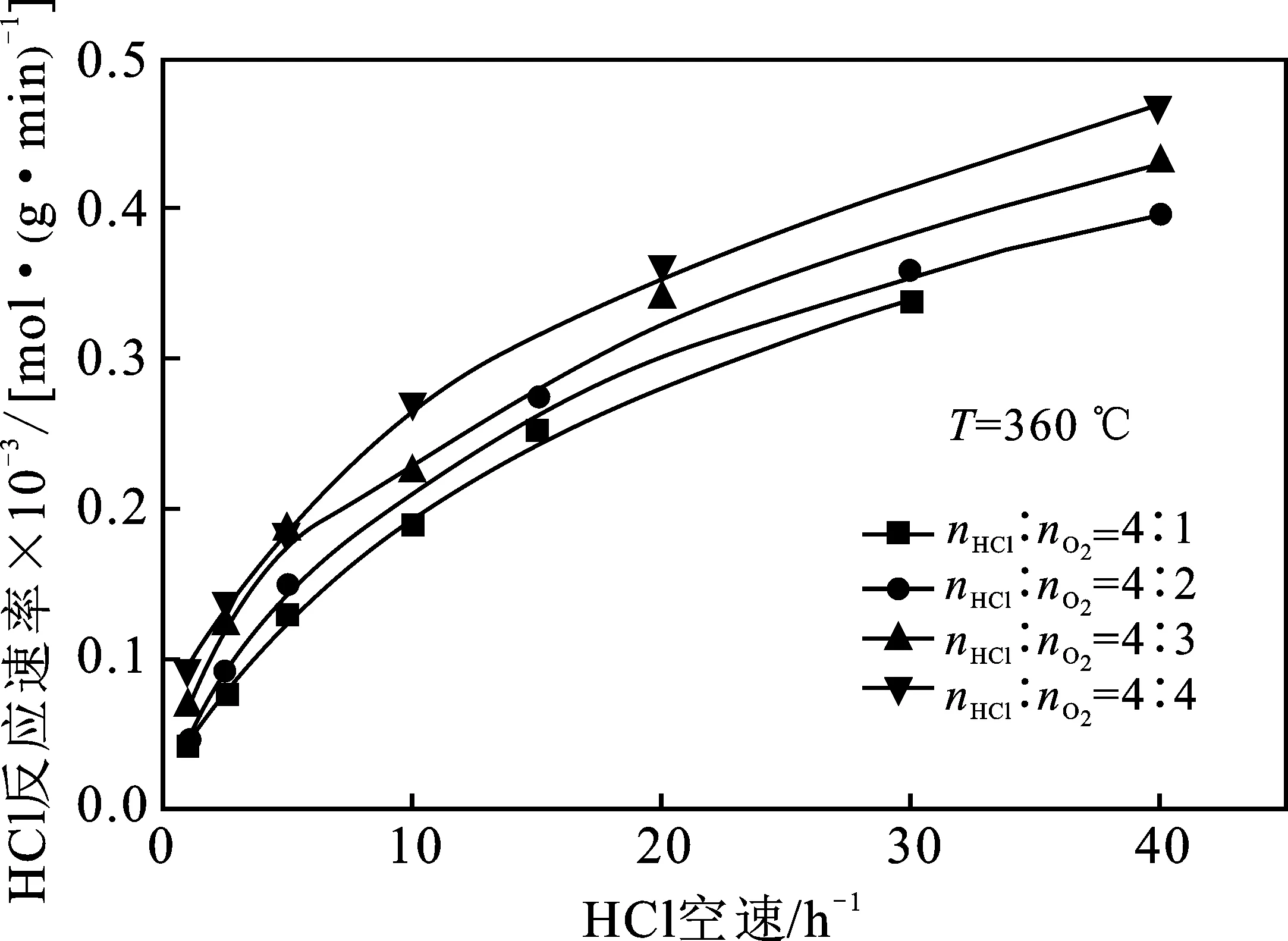

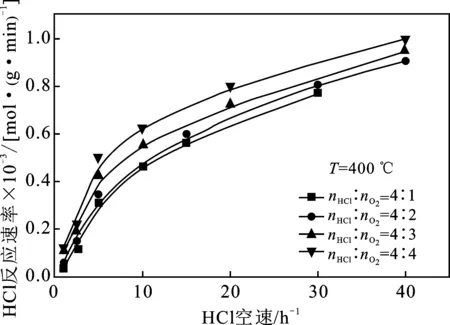
图5 反应气体摩尔配比和HCl空速对HCl反应速率的影响
由图5可知,在反应气体摩尔配比nHCl/nO2=1~4实验条件下均存在这样的规律,即在反应温度和HCl空速均相同的情况下,反应气体摩尔配比nHCl/nO2越小,HCl的反应速率越大,但是变化趋势不如反应速率随温度的变化趋势来得明显。与此同时,为了达到相同的HCl反应速率,在较小的反应气体摩尔配比nHCl/nO2条件下,所需要达到的反应空速是较小的。因此,适当降低反应气体摩尔配比nHCl/nO2有利于加快HCl反应速率。
2.3 反应空速的影响
2.3.1 与HCl转化率的关系 HCl转化率和反应空速的关系同样可以在图2和图4中得到。
由图可知,在反应空速>5 h-1条件下,HCl转化率随HCl空速的减小而上升,这是由于反应空速减小,反应物在反应器内的停留时间增加,导致转化程度上升,使转化率有所提高,因此适当减小反应空速有利于提高HCl转化率。然而当反应空速<5 h-1时,HCl转化率随HCl空速的减小转而呈现出一种下降的趋势。一般情况下,当反应达到化学平衡状态时会出现这样的趋势。但是根据文献[30]的研究可知,氯化氢催化氧化反应中的HCl转化率可达80%以上,而在本文的研究中HCl转化率最高仅达到60%左右,显然尚未达到化学平衡状态。
分析产生这种现象的原因可能是,由于无梯度反应器的反应空间小,虽然对于反应空间内的原料气可以很快达到定态,但在连续化的反应过程中,由于无梯度反应器内高度的返混状态,反应后达到定态的气体与刚进入反应器的原料快速混合,这样观察到的表观转化率就会小于实际的反应转化率,虽然两者的差距随稳定时间的增加会逐渐缩小,但这样一来就会增加实验所需的时间。在本实验体系中,无梯度反应器内催化剂槽最多只能装填4 g催化剂,因此在反应温度和反应气体摩尔配比均相同的情况下,提高HCl转化率只能通过降低反应原料气流量,以增加其停留时间来实现,这会导致反应速率的下降,从而大大延长反应达到定态的时间。
2.3.2 与HCl反应速率的关系 HCl反应速率和反应空速的关系同样可以在图3和图5中得到。
由图可知,反应空速对HCl反应速率影响存在这样的规律,即在反应温度和反应气体摩尔配比均相同的情况下,HCl空速越大,HCl的反应速率越大,但是HCl反应速率随空速的变化趋势是逐渐减小的,因此推测存在一个反应速率的最大值,即在HCl空速趋于无限大时的最大反应速率。因此,适当增加反应空速有利于加快HCl反应速率。结合反应空速对HCl转化率的影响可知,反应空速对两者的影响是相反的,因此工程上存在反应空速的优化问题,使反应速率和转化率均保持在较高的水平,再提高生产效率节约原料成本。
在本文中,HCl转化率在反应空速为5 h-1条件下达到最大值,故可选取5 h-1作为最优空速。与此同时,由于HCl转化率和反应速率均随着反应温度T的升高,以及反应气体摩尔配比nHCl/nO2的降低而升高,因此在本论文研究范围内的最优工艺条件为:反应温度T=400 ℃,原料气摩尔比nHCl∶nO2=4∶4,HCl空速FHCl0/W=5 h-1,此时的HCl转化率接近60%,且HCl反应速率在0.5×10-3mol/(g·min)左右。
3 结论与展望
(1)在HCl催化氧化制氯气反应中,在所考察的反应条件中,随着反应温度的升高与反应气体摩尔配比nHCl/nO2的降低,HCl转化率和反应速率均升高;随着反应空速FHCl0/W的降低,HCl转化率先升高后降低,在HCl空速为5 h-1时达到最大,而HCl反应速率却逐渐降低。
(2)优化的反应工艺条件为:反应温度T=400 ℃,原料气摩尔比nHCl∶nO2=4∶4,HCl空速FHCl0/W=5 h-1。此时HCl转化率接近60%,且HCl反应速率在0.5×10-3mol/(g·min)左右。
(3)值得注意的是,使用无梯度反应器进行的反应行为考察是反应远未达到化学平衡状态时的反应行为,虽然考察结果可以揭示未达化学平衡时的反应行为,但对于达到化学反应平衡后的反应行为尚未涉及,还需进一步考察。

