羧基碳纳米管钛网电极去除工业废水中Cu2+研究
柯雄,李淑娟,陈佳辉,陈日耀,3,刘耀兴,3
(1.福建师范大学 环境科学与工程学院,福建 福州 350007;2.山东商业职业技术学院 电子信息学院,山东 济南 250000;3.福建省污染控制与资源循环利用重点实验室,福建 福州 350007)
目前,含铜废水处理法有化学沉淀法[1]、离子交换法[2]、吸附法[3]、湿法还原法[4]、铁碳微电解法[5]、膜分离法[6]、植物修复法[7]、电化学法[8]等。其中电化学法具有灵敏度高、反应速率快、可控、无二次污染等特点,常被用于去除水体重金属和有机物[9]。碳纳米管(CNTs)具有优越的机械力学性能、导热导电性能以及易被修饰等特点,在复合材料[10]、航天航空[11]、电子通信[12]、化学医药[13]等领域得到了广泛应用。钛网(Ti-mesh)因具有物理强度高、化学性以及导电性强等特点,常被用作电极载体[14]。本研究制备了羧基单壁碳纳米管的钛网电极(SWCNTs-COOH@Ti-mesh),利用其去除废水中的Cu2+。考察应用电压、电解质浓度、溶液 pH、Cu2+初始浓度等参数对Cu2+去除的影响。
1 实验部分
1.1 材料与仪器
硝酸钠、硝酸、硫酸、硝酸铜、丙酮、N,N-二甲基甲酰胺(DMF)均为分析纯;SWCNTs(比表面积大于380 m2/g,长度5~30 μm,孔径1~2 nm)、纤维素微孔滤膜(孔径为450 nm)、40目钛网均为工业品;实验用水为蒸馏水和超纯水。
CHI630E电化学工作站;DF1720SB5A型直流稳压电源;ESCALAB 250Xi X射线光电子能谱仪;85-2型数显恒温磁力搅拌器;PinAAcle 900F原子吸收分光光度计;SU8000冷场发射扫描电子显微镜;DHG-9146A鼓风干燥箱;电解槽(有机玻璃),自制。
1.2 电极的制备
1.2.1 Ti-mesh的预处理 将钛网剪成面积6 cm×4 cm的Ti-mesh,放入浓度0.50 mol/L HNO3中超声浸洗20 min,去除其表面氧化物。再用丙酮、蒸馏水分别超声20 min,取出,放置阴凉处晾干,备用。
1.2.2 SWCNTs的氧化处理及电极制备 称取0.5 g 的 SWCNTs于150 mL三口烧瓶中,加入45 mL H2SO4、15 mL HNO3,在恒温加热磁力搅拌器中70 ℃回流反应24 h。用纤维素微孔滤膜过滤,用蒸馏水淋洗至中性。于60 ℃鼓风干燥箱干燥15 h,即可得到SWCNTs-COOH[15]。称取400.00 mg SWCNTs-COOH 超声分散于200 mL的DMF中,振荡形成2.00 mg/L的SWCNTs-COOH-DMF悬浮液。将两片Ti-mesh作为阴阳极平行插入SWCNTs-COOH-DMF溶液中,施加40 V的直流电压。由于SWCNTs-COOH在氧化处理后携带羟基、羧基和磺酸基等负电荷官能团,其在电场力作用下向阳极移动,并沉积在Ti-mesh表面。沉积5~20 s后取出,置于鼓风干燥箱中(120 ℃)去除有机溶剂,即可得到SWCNTs-COOH@Ti-mesh电极。
1.3 Cu2+去除实验
实验装置如图1所示,采用直流电源提供电压。Ti-mesh为阳极,SWCNTs-COOH@Ti-mesh为阴极,电极间距2.5 cm。磁力搅拌,保持溶液均匀,防止发生浓差极化现象。含Cu2+废水溶液由Cu(NO3)2配制而成,以NaNO3为电解质。
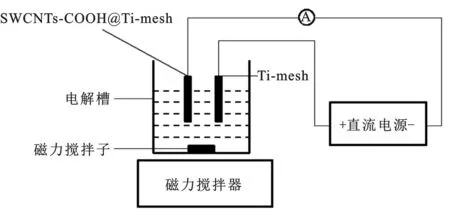
图1 铜去除实验装置图
通过原子吸收分光光度计测定每个取样时间点的样品中Cu2+浓度。计算Cu2+去除率。
式中C0——Cu2+初始浓度,mg/L;
Ct——Cu2+在t时刻浓度,mg/L。
2 结果与讨论
2.1 SWCNTs-COOH对Cu2+的静态吸附
在pH为6.0,NaNO3浓度为6 g/L,Cu2+初始浓度为52.48 mg/L,SWCNTs-COOH@Ti-mesh电极表面SWCNTs-COOH的量为(2.89±0.05)mg条件下,磁力搅拌吸附4 h,考察SWCNTs-COOH对Cu2+的静态吸附作用,结果见图2。

图2 SWCNTs-COOH对Cu2+的吸附量
由图2可知,经120 min后,Cu2+浓度从52.48 mg/L 缓慢下降到49.90 mg/L,之后趋于稳定。由此可知,SWCNTs-COOH@Ti-mesh电极上的SWCNTs-COOH对Cu2+有吸附作用,吸附量为 0.13 mg/mg。
2.2 电解质浓度对Cu2+去除影响
在pH为6.0,应用电压为2.5 V,Cu2+初始浓度为52.31 mg/L,SWCNTs-COOH@Ti-mesh电极表面SWCNTs-COOH的量为(2.58±0.05)mg的条件下,考察电解质NaNO3浓度对Cu2+去除的影响,结果见图3。
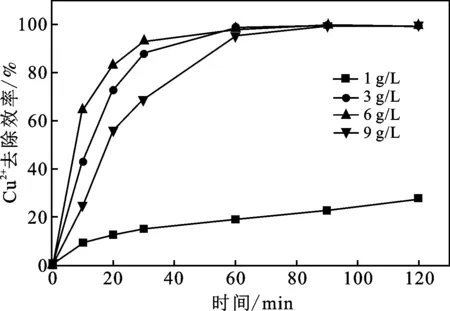
图3 NaNO3浓度对Cu2+去除率的影响
由图3可知,Cu2+去除率均随去除时间的增加而增加。NaNO3浓度为1 g/L时,Cu2+去除率仅为27%。NaNO3浓度≥3 g/L时,Cu2+去除率均可达99%以上。这主要因为随NaNO3浓度的增加,溶液的导电率也会随之升高,导致Cu2+由溶液迁移到SWCNTs-COOH@Ti-mesh电极表面的速率增加,从而使Cu2+在阴极表面被还原去除,因此Cu2+的去除率随NaNO3浓度的增加而升高。
2.3 应用电压对Cu2+去除率的影响
在pH为6.0,NaNO3浓度为6 g/L,Cu2+初始浓度为49.56 mg/L,SWCNTs-COOH@Ti-mesh电极表面SWCNTs的量为(2.56±0.05)mg的条件下,考察应用电压对Cu2+去除的影响,结果见图4。

图4 应用电压对Cu2+去除率的影响
由图4可知,Cu2+去除率随应用电压的增加而升高。当应用电压为2.5 V时,Cu2+去除率高达99%。因为随着应用电压的增加,Cu2+离子受到的电驱动力作用也会增大,迁移至SWCNTs-COOH@Ti-mesh电极表面的Cu2+量增加,使得阴极表面更多的Cu2+还原为铜原子,提高了Cu2+的去除率。
2.4 pH对Cu2+去除率的影响
在应用电压为2.5 V,NaNO3浓度为6 g/L,Cu2+初始浓度为51.16 mg/L,SWCNTs-COOH@Ti-mesh表面SWCNTs-COOH的量为(3.05±0.05)mg的条件下,考察pH对Cu2+去除率的影响,结果见图5。

图5 pH对Cu2+去除率的影响
由图5可知,前60 min反应时间内,各pH条件下的Cu2+去除速率快。60 min后,各pH溶液中的Cu2+去除率为89%~98%。处理120 min后,各pH条件下的Cu2+去除率均达到100%。理论上pH越高,越有利于Cu2+的去除。这是因为pH越高,溶液中阻碍Cu2+迁移到阴极表面的H+浓度会越低,就会使越多的Cu2+在阴极被还原去除。
2.5 Cu2+初始浓度对Cu2+去除率的影响
在pH为6.0,应用电压为2.5 V,NaNO3浓度为6 g/L,SWCNTs-COOH@Ti-mesh电极表面SWCNTs-COOH的量为(3.25±0.05)mg条件下,考察Cu2+初始浓度对Cu2+去除率的影响,结果见图6。
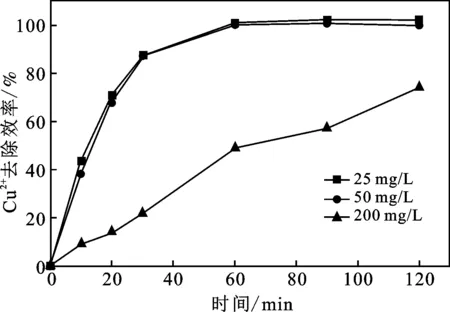
图6 Cu2+初始浓度对Cu2+去除率的影响
由图6可知,在25 mg/L及50 mg/L的初始浓度条件下,Cu2+最终去除率均可达100%。当Cu2+初始浓度为200 mg/L时,在120 min的处理时间内,Cu2+去除率仅为74%。这是因为当Cu2+初始浓度较高时,由于阴极表面上SWCNTs-COOH的还原点位数量一定,在相同的处理时间内,就会有部分的Cu2+无法得到电子被去除,从而导致Cu2+去除率随Cu2+初始浓度的增加而降低。
2.6 SWCNTs-COOH@Ti-mesh表征
2.6.1 XPS分析 为考察SWCNTs-COOH@Ti-mesh表面Cu2+的价态,对反应后电极进行XPS分析,结果见图7。

图7 SWCNTs-COOH@Ti-mesh电极表面Cu2+XPS能谱图
由图7可知,阴极上呈现一明显结合能峰,表明Cu2+在阴极表面被去除。该峰出现在932.5 eV附近,经过与标准结合能谱对比,发现是Cu2p3/2峰,表明SWCNTs-COOH@Ti-mesh上的铜为零价。同时发现,在电化学处理铜后,阴极表面形成一层紫红色镀层。由XPS分析可知,电化学处理Cu2+时,Cu2+还原为铜原子并沉积在阴极表面被去除。由于阴极表面沉积有SWCNTs-COOH,电极的真实比表面积增大,这就使Cu2+在电极表面更容易结合电子从而被还原。同时SWCNTs-COOH为铜原子沉积在阴极表面提供了更多的沉积点位,最终使Cu2+的去除率升高。
2.6.2 CV分析 为进一步验证Cu2+在阴极被还原,以SWCNTs-COOH@Ti-mesh电极为工作电极,铂片为对电极,Ag/AgCl为参比电极,在扫描速率50 mV/s,电解质NaNO36 g/L条件下,对50 mg/L含Cu2+溶液进行CV分析,结果见图8。

图8 正向扫描循环伏安曲线
由图8可见一明显的Cu2+氧化电流峰,说明电化学处理过程中阴极表面有Cu2+还原并沉积。因此,正向扫描CV的实验结果中有Cu2+的氧化电流峰出现,其反应方程参照如下。
Cu2++2e-→Cu
Cu-2e-→Cu2+
CV分析结果与XPS分析结果相符合,说明Cu2+是在阴极表面还原成铜原子,并沉积在SWCNTs上被去除。
2.7 电极再生
为了评估电极在实际应用中的可行性和探究Cu2+在阴极表面的去除机理,在pH为6,应用电压为2.5 V,NaNO3浓度为6 g/L,Cu2+浓度为63.58 mg/L,SWCNTs-COOH@Ti-mesh电极表面SWCNTs-COOH的量为(2.96±0.05)mg条件下,电迁移120 min后,对电极进行施加反向电压、撤除应用电压和酸浸3种方式再生处理,结果见图9。
由图9可知,施加反向电压,Cu2+浓度出现先增加后减小的趋势,这是因为被双电层吸附在阴极表面的Cu2+重新回到溶液中,使溶液中Cu2+的浓度升高,然后在新电场力作用下,在新的阴极上被去除。所以,该方法不能使电极再生。
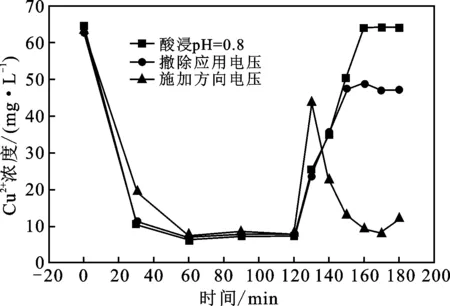
图9 SWCNTs-COOH@Ti-mesh电极再生过程中Cu2+浓度的变化
撤除应用电压,Cu2+浓度缓慢增加后趋于平稳,最终浓度为47.20 mg/L。这主要是因为此方法使被双电层吸附在阴极表面的Cu2+返回至溶液中,却无法使阴极上的铜原子从电极上脱除。因此,这种方法无法使电极完全再生。
将溶液pH用浓HNO3调至0.8,发现在40 min之后,溶液中Cu2+浓度基本就可以达到其原始浓度。60 min再生后,溶液中Cu2+浓度为63.41 mg/L。这说明铜原子可溶解于强酸性条件下,说明这种方法可以简单使处理铜后的电极再生。
3 结论
利用电泳沉积法制备SWCNTs-COOH@Ti-mesh电极,并用其为电极对废水中的Cu2+离子进行去除。由Cu2+的去除机理可知,Cu2+的去除是在SWCNTs-COOH@Ti-mesh电极表面形成吸附双电层及还原成铜原子而被去除。相比于Ti-mesh,SWCNTs-COOH@Ti-mesh对废水中的Cu2+离子去除效果更好。Cu2+去除的最佳条件为:当应用电压为2.5 V,溶液pH为6.0,NaNO3浓度为6 g/L。使用过的SWCNTs-COOH@Ti-mesh电极通过酸浸的方式可进行再生。

