纳米二氧化钛粒子的制备研究
龚之宝,李朋洲,孙伟振,李青松
(中国石油大学(华东)重质油国家重点实验室,山东 青岛 266580)
现代经济发展所导致的环境污染给生产生活带来了严重的困扰,污染治理一直是头号难题,近年来,光催化技术作为一种理想的环境污染治理方法正得到广泛的关注[1-2]。TiO2自身的抗污染性能及其清洁性能也被广泛应用于有机纤维素杂化膜和无机膜的制备当中[3]。尽管半导体材料TiO2的应用正在扩大,但是二氧化钛粒子的高效经济且符合使用条件的粒子制备技术却依然存在着成本高、粒径分布难以控制、形态不规整等问题,这在一定程度上制约着二氧化钛产业的发展。
自1846年Ebelmen J J开创了溶胶凝胶法(Sol-Gel)以来,该方法便被陆续用于纳米粒子以及膜材料制备。本文以钛酸四丁酯(TBOT)为原料,利用溶胶凝胶法制备纳米二氧化钛粒子,并对实验条件进行了改进和对影响粒子粒径的因素进行了探究,同时对实验结果和实验现象进行了完整分析。
1 实验部分
1.1 材料与仪器
TBOT(≥98.0%)、无水乙醇(≥99.7%)、硝酸(65%~68%)、冰醋酸(≥99.8%)均为化学纯;去离子水。
W-O电热恒温油浴锅;DHG-9053A电热恒温鼓风干燥箱;Zetasizer Nano Series激光纳米粒度仪。
1.2 实验方法
反应在三口烧瓶中进行。将反应原料分为两个部分,一部分是TBOT和无水乙醇的混合液,置于三口烧瓶中,另一部分是无水乙醇、去离子水和酸液(冰醋酸或硝酸)的混合液,置于恒压滴液漏斗中。将恒压滴液漏斗中的液体滴加到三口烧瓶中来完成反应,并取样进行分析,过程中通过改变反应的条件以对反应进行探究。
1.3 反应原理
该反应过程分为水解和缩聚两步进行[4],其水解缩聚反应过程如下:
≡Ti—OC4H9+H2O→≡Ti—OH+C4H9OH
(1)
≡Ti (OC4H9)4+2H2O→TiO2+4C4H9OH
(2)
≡Ti—OC4H9+≡Ti—OH→
≡Ti—O—Ti≡+C4H9OH (3)
≡Ti—OH+≡Ti—OH→
≡Ti—O—Ti≡+H2O (4)
其中式(1)和式(2)为TBOT水解反应式,式(3)和(4)为生成丁醇和二氧化钛的缩聚反应式。
在滴加反应结束后三口烧瓶中为含有纳米TiO2的溶胶,再经过陈化干燥以及焙烧之后可得到白色二氧化钛固体颗粒。
1.4 粒子粒径的测量
粒径测量所使用的仪器是激光纳米粒度仪(Zetasizer Nano Series,英国马尔文仪器有限公司)。该仪器通过对溶胶中的粒子所进行的布朗运动轨迹进行捕捉,过程的实质是通过粒径仪内置的紫外光照射,介质中的微粒会反射部分光线,粒径仪对反射的光斑进行捕捉,因为粒子大小不一且不断运动,所以光斑大小和位置会不断变化,但有重合的区域,这就是计算粒径分布的方法。将布朗运动与粒子粒径进行关联并计算得出粒径大小。
测量结果为三组数据的平均值,每组会测13~16次而给出该组粒径数据。所测结果均为粒子平均粒径;PDI为粒子分散性指数,其值越小粒子分散性越优良。
2 结果与讨论
2.1 反应液滴加的时间对粒径的影响
当把反应液一次性加入到三口瓶中时生成的粒子会迅速团聚,溶胶变白形成奶胶状液体,并最终变成凝胶,粒径变大。故实验中反应液加入到原料液中采取滴加的方式。
根据文献[5]将反应过程中控制水钛比为7.5,TBOT的浓度为0.4 mol/L,油浴锅温度设定在35 ℃,滴加反应的时间分别控制在1,2,3,4,5 h和6 h,反应结束后取样测定粒径,结果见图1。
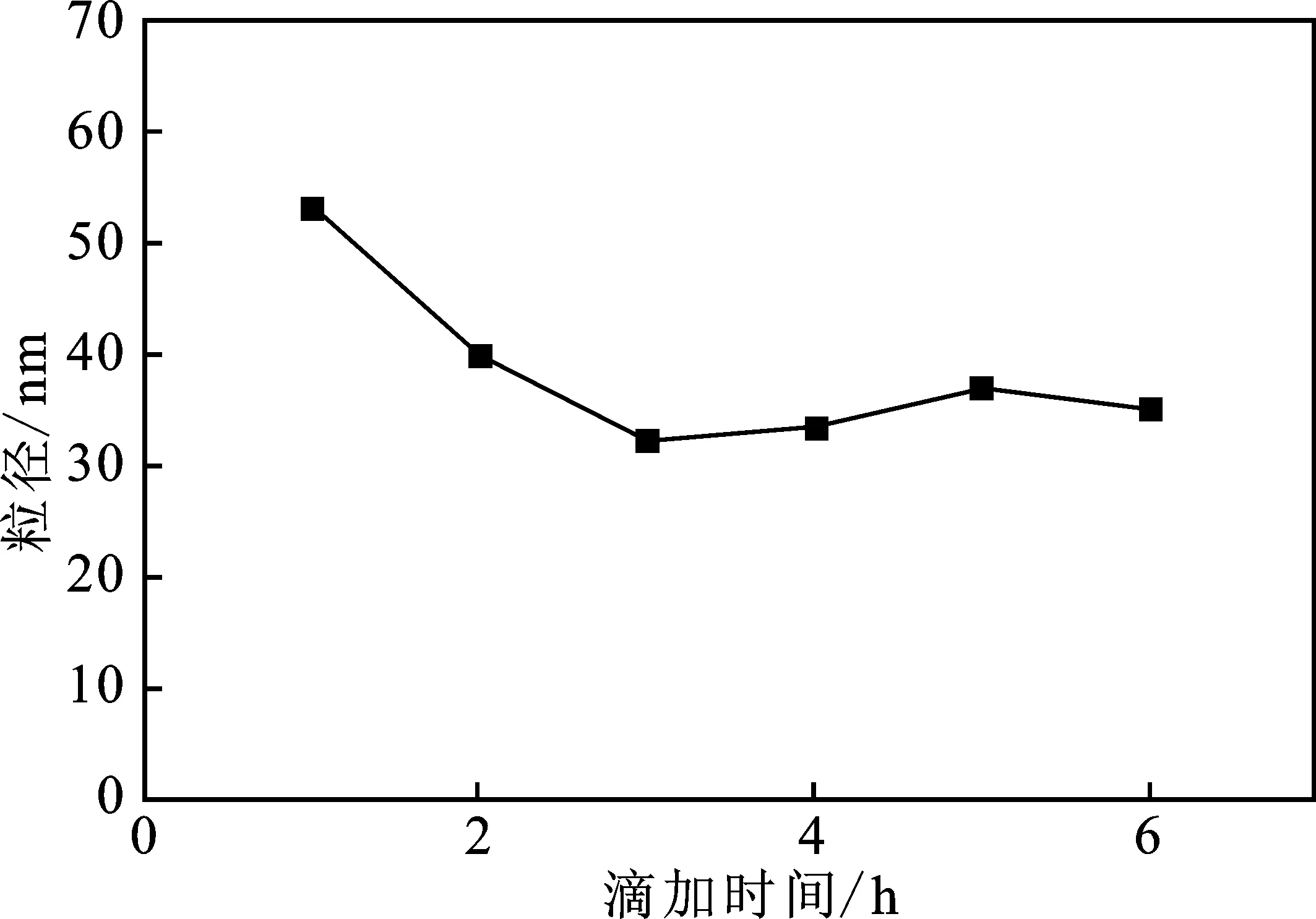
图1 反应液滴加时间对粒子粒径的影响
由图1可知,在滴加时间为1~3 h时粒子粒径由接近70 nm降低至30 nm的范围,在滴加时间多于3 h之后,粒径在30 nm附近起伏,其变化不大,在综合时间成本的考虑下其滴加时间应选择在3 h。之所以呈现出如此的规律主要和TBOT的反应过程和产物性质有关。按照水钛比为7.5的比例进行实验时,其水量一定的情况下,若在短时间内将其全部加入到烧瓶中,单位时间内加入的反应物即水的量会增大,从而导致反应过快,迅速生成大量TiO2溶胶粒子,由于静电力和范德华力使得粒子发生软团聚[4],从而增大了粒径;同时生成的产物Ti(OH)4因未能被酸中和而充当了电解质降低了溶胶粒子的Stern层电势,增加了团聚。如果将时间延长则单位时间内的反应物量会减少,生成的少量纳米粒子会迅速分散在溶液中,少量的OH-产物也会被酸中和[5],从而形成粒径均一产物稳定的溶胶。
2.2 反应温度对粒径和分散性的影响
在溶胶凝胶法的反应过程中,探究反应过程的温度对该反应过程的影响是必要的,因为TBOT的水解和缩合反应本身是与温度有关的,比如中间产物H4TiO4在受热时会分解,分解的程度以及两性化合物H4TiO4和Ti(OH)4之间的转化都在一定程度上受温度的影响进而影响粒子的粒径和产物的分散性[6]。
反应过程中各组的滴加时间为3 h、水钛比为7.5等条件均不变,但各组的油浴锅设定温度分别设定在25,30,35,40,45,50,60 ℃,图2和图3为粒径随温度变化图和PDI随温度变化图。

图2 反应温度对粒子粒径的影响
由图2可以清楚的看出,温度区间在25~45 ℃时粒子粒径在20~30 nm之前上下浮动,但当温度处于45 ℃以上时,粒子粒径开始上升,并随着温度的升高而升高,在温度高于60 ℃时仅通过HNO3作为抑制剂时已经不能形成稳定的溶胶,溶胶颜色开始发白,若持续保温,溶胶颜色会从淡白色到纯白的奶状溶胶,并最终失去流动性形成凝胶。温度在该反应中主要影响生成的粒子的布朗运动程度,尽管TBOT的水解反应是吸热反应,但因为其吸热量较低,同时TBOT极易水解,即使是在常温以及低温下仍旧可以进行快速的水解反应,故温度对其反应影响不大,只是存在分散剂CH3OH和H+抑制剂的条件下,其反应会减速和产物会更加均匀[7],当温度在25~45 ℃内时该水解聚合反应速率会在一定程度上变大,并快速生成TiO2粒子,因为生成的TiO2纳米粒子较多且温度较大时其布朗运动程度变大,导致粒子碰撞增多,形成以范德华力和静电力为主的软团聚,因为布朗运动主要是无规则的热运动[8],以至于在团聚时的程度并不均一,从而使得高温下的PDI变大。温度进一步升高,则团聚程度加大,并最终形成凝胶。

图3 反应温度对PDI的影响
2.3 添加剂对粒子粒径的影响
反应过程中的添加剂选择为CH3OH作为分散剂,HNO3作为反应抑制剂,但过程中存在粒径不均和溶胶易团聚发白等现象,于是探究了添加剂对溶胶稳定性和粒子粒径的影响,此过程中选取了另外两种抑制剂冰醋酸和乙酰丙酮配合硝酸使用,下图5为只有硝酸以及添加了冰醋酸和乙酰丙酮混合使用时溶胶稳定时间和粒子随滴加时间的变化图。
由图5可知,在三口烧瓶的反应液中加入一定量的冰醋酸和C5H8O2,而在滴加液中依然添加硝酸时,得到的粒子粒径大小明显要低于只添加硝酸时的粒径。从图中可以看出,只添加硝酸时,当滴加时间在1~2 h内变化时其粒径变化相对较大,在60~30 nm内进行波动,并且在实际测定的过程中,因为滴加速度的原因也会导致粒径测量报告中出现粒径分布不均的情况。同样,在反应液中添加冰醋酸和乙酰丙酮后的粒径变化相对较小,尽管滴加时间较短使其粒径略微偏高,但二者皆低于20 nm甚至更小,之后随着滴加时间的延长,其波动基本都在5~15 nm的范围内,考虑到粒度仪测量数据是水性参数,其实际大小会比测量值更小。

图4 添加剂对粒子粒径的影响
出现上述差距的主要原因是在只添加硝酸时其作用分为两种:一是硝酸在滴加到TBOT中与其发生反应从而抑制钛酸四丁酯的水解反应,另一方面水解得到的H+会附着在溶胶粒子的表面从而使抑制了溶胶的团聚。但因为硝酸仅仅存在滴加液中,当其随着滴加液加入反应液中时其对水解反应的抑制效果较小,因为水解反应过快,硝酸来不及和钛酸四丁酯反应,水解反应就已经开始,但是因为硝酸的电离度很大,电离出的大量H+吸附在溶胶粒子表面,很好的抑制了生成的溶胶粒子的团聚,不至于溶胶迅速团聚。但若用CH3COOH取代HNO3则会发现溶胶迅速发白并失去流动性,其原因就是醋酸的电离度很小,无法得到大量游离的氢离子从而无法抑制溶胶粒子的团聚。但是若将冰醋酸和乙酰丙酮提前加入反应液中并进行充分的搅拌,则作为配合物的两者会和钛酸四丁酯的酯丁基发生亲电取代生成螯合物并形成螯合环[9],大大抑制了水解反应速率,控制了粒子的粒径。
2.4 粒子转化率的影响因素探究
实验过程中转化率的计算是通过反应方程式计算得到,其总反应过程如下:
TBOT+2H2O=TiO2+4C4H9OH
转化率的计算是通过加入的钛酸四丁酯的量计算得到理论生成的二氧化钛粒子的质量,之后用实际得到的二氧化钛的质量除以理论值即为TiO2的的转化率。为了排除干燥升温时溶胶中反应仍继续的可能,采用气象色谱法测定溶胶中水的含量,从而计算出产物的量。四氢呋喃(THF)为内标物。
本探究对温度以及添加剂对反应过程中TiO2纳米粒子的转化率的影响做了探究,其实验结果见图5和图6。
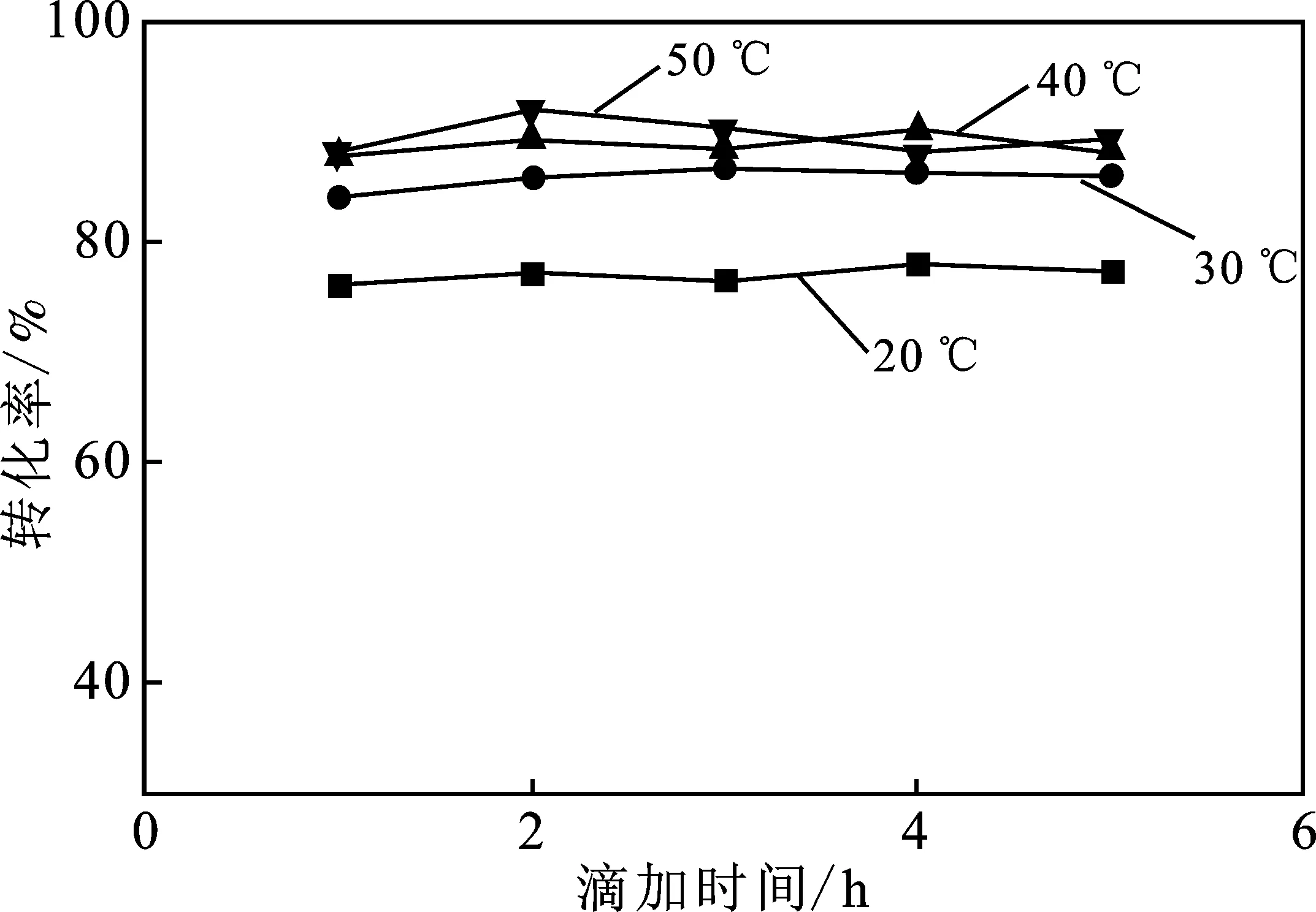
图5 温度对粒子转化率的影响

图6 添加剂对粒子转化率的影响
由图6可知,在温度一定时随着滴加时间的增加,二氧化钛粒子的转化率并没有出现较大的波动,基本稳定在80%以上,同时随着温度的增加转化率略微有所上升,20 ℃时低于80%,而在30,40,50 ℃时各转化率曲线在数值上区分度不大,均处于84%左右。出现该现象的主要原因是低温抑制中间产物的继续水解反应,尽管该反应极为迅速但同样存在反应限度问题,且其为吸热反应,一定程度的升温会使反应平衡向右移动,同时会使得反应中的缩聚反应一定程度上加速。而在温度达到30 ℃以上后转化率并没有出现较大的波动,主要是因为在该温度以上其反应已经基本完全,即使再度升温也不会出现明显变化。
反应液中的乙醇会发生酯醇解反应,H+的质子化也会阻碍TBOT的水解缩聚反应,即使在30 ℃,转化率也在85%左右,因为中间产物的水解需要一定的时间,低温使得这一过程进一步减缓,但当时间持续延长时,检测到的转化率依然会升到90%以上。滴加结束后继续延长保温时间,转化率依然没有达到100%(最高97.4%),除去内标法产生的误差,原料的纯度,烧瓶壁的残留都是产生这一结果的原因。
图6的反应温度为30 ℃,是不同添加剂在不同滴加时间时其反应转化率变化图,根据上图可知,同种添加剂在不同滴加时间时,转化率略微波动,但变化不大,不同种添加剂之间的对比同样没有明显的变化,这印证了添加剂对粒子的粒径有着一定的影响,但对反应过程最终的结果没有明显的效果。
2.5 氢离子浓度对粒径的影响
在保证转化率的前提下,对氢离子浓度对粒径的影响进行探究,反应过程中通过加入HNO3改变氢离子浓度,选取硝酸和乙酰丙酮作为添加剂,水钛比7.5,反应温度30 ℃,控制滴加时间为1 h,待滴加结束后,取少量溶胶稀释,置于石英比色皿中进行粒径的测量,结果见表1。
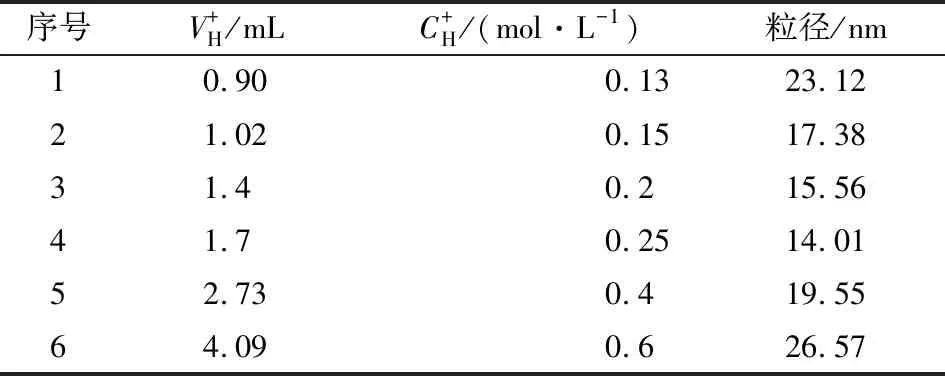
表1 不同氢离子浓度对应的粒子粒径
由表1可知,尽管随氢离子浓度的增大粒径变化不大明显,但总体呈现出了先下降后上升的趋势,结合前文所述,这种趋势并非偶然。
氢离子的作用主要有两个:①抑制钛酸四丁酯水解速率(丁氧基质子化);②抑制溶胶粒子团聚。在胶粒成核及生长过程中,氢离子吸附于胶体粒子表面,使得粒子之间产生斥力,从而避免胶体粒子的团聚。但较多的氢离子反而会破坏稳定的胶团结构,挤压Stern层,降低Stern层电势,反而降低了分子间的斥力,增加了粒子的团聚而增大了粒径。这个结论可以通过实验验证,如果对滴加时间为2 h的反应液中变化氢离子浓度,粒径并未继续减小,但持续增加H+浓度,粒径会变大。这是因为滴加时间的延长,形成的一次和二次粒子处于最稳定状态,增加H+浓度粒径也不会再发生变化,但当持续增大时,破坏了稳定结构,导致了团聚的发生。
3 结论
(1)反应过程中在抑制剂仅为硝酸时滴加液的滴加时间对粒子粒径有一定的影响,滴加速度越快其粒径相对越大,最佳滴加时间为2~3 h。
(2)温度对纳米粒子的粒径和粒子的分散性均有影响,当温度升高时会加速粒子团聚粒径快速增大,同时粒径范围波动增大,粒子分散性变差,最佳反应温度应控制在25~35 ℃。
(3)不同添加剂以及添加方式对粒径有着明显的影响,应将抑制剂放置于反应液中而非滴加液中,且乙酰丙酮配合硝酸的抑制效果明显,在使用冰醋酸配合硝酸抑制反应过程时硝酸不可缺少,没有大量H+的参与会导致团聚发生迅速。
(4)温度和添加剂对反应转化率的影响中硝酸、冰醋酸以及乙酰丙酮对结果都没有明显的影响,但应避免低温反应,故在反应前应对反应液进行一定程度的加热,结合粒径变化和节能等因素,温度在30~40 ℃即可。
(5)氢离子浓度在粒子粒径有一定的影响,实验最佳范围可控制在1.0~1.7 mol/L。

