吸水链霉菌LP-93菌丝体中洋橄榄叶素衍生物的分离与结构鉴定*
刘玉凤 王保国 赖帝轩 张 震 崔晓秋 杨兆勇
(1济宁医学院药学院,日照 276826;2中国医学科学院 北京协和医学院 医药生物技术研究所,北京 100050)
目前,随着“超级细菌”的不断出现,细菌耐药已严重威胁人类健康,对新型抗耐药菌抗生素的需求日益迫切。微生物是新抗生素的重要来源。吸水链霉菌(Streptomyceshygroscopicus)是一类抗菌谱广、遗传性状稳定的放线菌[1],可产生尼日利亚菌素类[2]、洋橄榄叶素类[3]、格尔德霉素类[4-6]、雷帕霉素类[7]等多种类型代谢产物,具有抗菌、抗肿瘤、免疫抑制等多种生物活性[1]。在寻找新抗生素的过程中,曾从吸水链霉菌LP-93(StreptomyceshygroscopicusLP-93)中分离到两个36元多羟基大环内脂类抗生素——波拉霉素A和B[8-9],它们对酵母样真菌、丝状真菌以及引起植物病害的真菌均有很好的抑制活性,对革兰氏阳性细菌也有一定活性,具有抗菌活性强、抗菌谱广的特点,为了进一步开发利用此菌,我们对其代谢产物进行了更深入研究,从其菌丝体中分离到一个洋橄榄叶素衍生物,本文将报道此化合物的提取分离、结构鉴定与抗结核杆菌活性。
1 材料与方法
1.1 试剂与仪器
甲醇(色谱纯,国药集团化学试剂有限公司),娃哈哈纯净水(杭州娃哈哈集团有限公司),其它溶剂均为分析纯。柱层析用硅胶(200~300目,青岛海洋化工厂)。LP-93发酵菌丝体风干物由中国医学科学院医药生物技术研究所杨兆勇老师课题组提供。SB25-12DTD型数控超声波清洗机(宁波新艺超声波设备有限公司),RE 2000B旋转蒸发器(上海远怀化工科技有限公司),安捷伦1260高效液相色谱仪(Agilent Technologies Inc.America),Bruker-600 核磁共振仪(Bruker Corp.Switzerland),美国Agilent HP1100 HPLC/MSD 高效液相色谱质谱仪(Agilent Technologies Inc.America),岛津UV-2450型紫外分光光度计(Shimadzu Corp.Japan)。
1.2 方法
1.2.1化合物的分离纯化 LP-93发酵菌丝体风干物(248.1g)打成粉,加入95%乙醇2000ml,超声提取2h,提取3次,合并提取液减压浓缩得浸膏44.4g。向总浸膏中加入适量乙酸乙酯,充分搅拌,过滤,得乙酸乙酯可溶部分(F1,12.8g)和不溶部分(F2,30.0g)。F2部分经硅胶柱色谱分离(450g硅胶),以二氯甲烷-甲醇(50∶1~1∶1)梯度洗脱,得21个组分(F2-1~ F2-21)。组分F2-12中析出白色沉淀,过滤后用高效液相色谱法分离,分离条件为:流动相95%甲醇水溶液,流速2.0ml/min,检测波长254nm,Cosmosil C18-MS-Ⅱ色谱柱(10mm × 250mm,5μm)。
1.2.2化合物的结构鉴定 将化合物1配成1.0mg/ml的样品溶液,经适当稀释后在紫外分光光度计上测定紫外吸收光谱(200~400nm);取化合物1的甲醇溶液在高效液相色谱-质谱联用上测定化合物的电喷雾质谱(ESI-MS);将化合物1减压抽干,加入1.0ml氘代氯仿,装于核磁管中,在600MHz核磁共振仪上测定一维和二维核磁共振谱。通过综合分析各种波谱数据,并与文献数据比较鉴定化合物1的结构。
1.2.3活性测定 根据文献[10],采用微量二倍稀释法测定化合物1的抗结核分支杆菌(H37Rv标准菌株)MIC值,异烟肼和利福平为阳性对照药物。
2 结果与讨论
2.1 分离结果
经高效液相色谱分离,在保留时间22.0min处收集色谱峰,减压蒸馏回收溶剂后,得化合物1 (20.3mg),为无色胶状物,可溶于甲醇、乙醇、氯仿等溶剂。
2.2 化合物1的结构解析
化合物1 ESI-MS 给出准分子离子峰 m/z 1062 [M+Na]+,为基峰,提示其分子量为1039;1H NMR 谱(图1)显示其结构中存在一组对称的共轭反式双键 [δH 5.66 (d,J=15.6Hz,H-2,H-2′), 6.97 (dd,J=15.6,11.4Hz,H-3,H-3′),6.09 (dd,J=15.0,11.4Hz,H-4,H-4′),5.65 (dd,J=15.0,11.4Hz,H-5,H-5′)],两个糖的端基氢 [δH 5.03 (m)],两个甲氧基[δH 3.04 (s)],12个高场区甲基信号,以及多个连氧次甲基、连碳次甲基及亚甲基信号;13C NMR谱显示40个碳信号, DEPT谱(图2)显示它们分别为1个羰基碳信号(C 169.6)和两个季碳信号(δC 103.4,103.5),4个烯碳次甲基,12个连氧次甲基, 6个连碳次甲基,5个亚甲基,1个甲氧基以及11个甲基信号,综合以上信息,推测该化合物为一部分对称的化合物。结合核磁共振信号特点,分子量信息及紫外光谱特征(λmax 252nm),经查阅文献[11-12]得知,化合物1应为洋橄榄叶素(elaiophylin)类似物。与洋橄榄叶素的结构相比,本化合物只有5个亚甲基,说明其中一个乙基被甲基取代,而且,两个季碳信号均向低场位移(δC 103.4,103.5),说明化合物的C-11,C-11羟基被甲基化,因此,推测化合物1的结构为11,11′-O-二甲基-14′-去乙基-14′-甲基-洋橄榄叶素,分子式为C55H90O18。
为了验证化合物的结构及进行核磁信号的准确归属,我们测定了化合物1的二维核磁共振图谱。通过HSQC图谱(图3),对化合物中直接相连的C,H信号进行了准确的对应归属。在1H-1H COSY 谱(图4)中,一个双峰甲基质子[δH 0.90 (d,J=6.6Hz,H3-20′)]与H-14′[δH 1.26(m)]相关,同时,在HMBC 谱(图5)中,观察到它与C-13′、C-14′、C-15′的两键或三键异核远程相关信号,进一步确证了化合物1的结构。由于C-14′的甲基取代了洋橄榄叶素中的乙基,造成了结构的不对称性,C-13′、C-14′、C-15′受影响较大,它们对应的碳氢信号均不重叠,其它位置信号受影响较小,其核磁数据(表1)与文献[11]报道的11,11′-O-dimethyl-14′-deethyl-14′-methyl-elaiophylin数据基本吻合,其具体的1H-1H COSY和HMBC相关关系见图6。

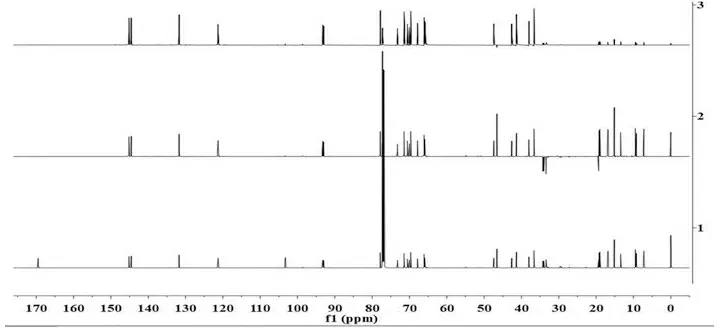
图1 化合物1的1H NMR谱(CDCl3,600MHz)

图2 化合物1的DEPT谱(CDCl3,150MHz)
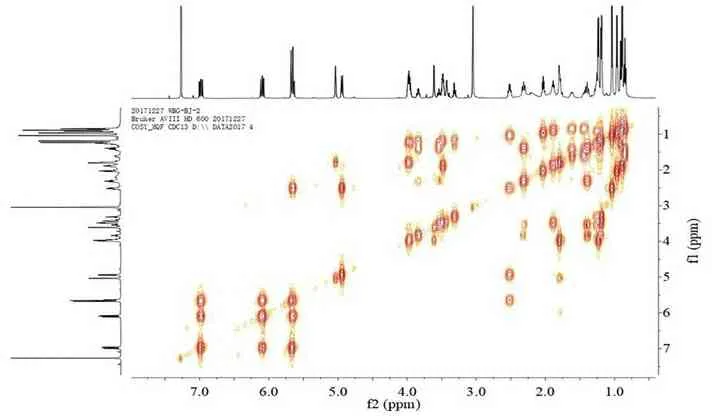
图3 化合物1的HSQC谱(CDCl3,600MHz)
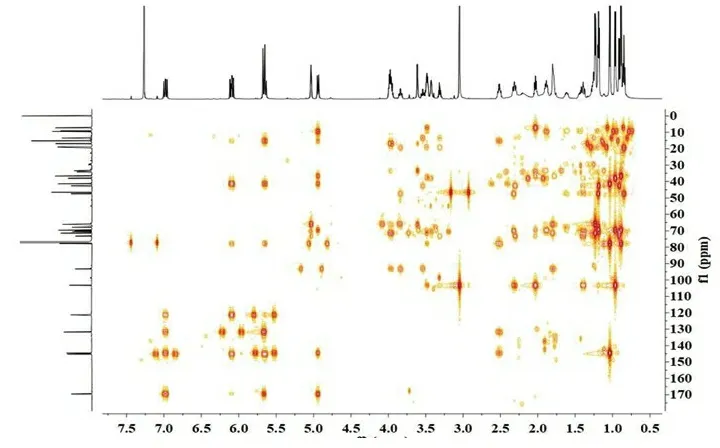
图4 化合物1的1H-1H COSY谱(CDCl3,600MHz)

图5 化合物1的HMBC谱(CDCl3,600MHz)
图6 化合物1的1H-1H COSY和HMBC 相关关系

表1 化合物1的1H NMR和13C NMR数据
2.3 化合物1的抗结核分枝杆菌活性
化合物1对结核分枝杆菌具有较强抑制活性,MIC值为0.48μg/ml,阳性对照异烟肼和利福平的MIC值分别为0.058、0.129μg/ml。
文献报道[11],洋橄榄叶素类化合物的C-11、C-11′甲氧基取代及C-14′的甲基取代,均使其抗耐药菌活性降低。但这些结构的改变并没有显著影响其抗结核分枝杆菌活性[10],本文实验结果也证明符合上述结构特征的化合物1仍具有较强的抗结核分枝杆菌活性。这提示洋橄榄叶素类化合物的抗结核分枝杆菌机制可能与其对革兰氏阳性菌的抗菌机制不同,值得进一步深入研究。
3 结论
洋橄榄叶素类化合物是一种具有C2-对称性的十六元环大环双内酯抗生素,目前已从不同链霉菌中分离到了近20个此类化合物,大部分结构中含有双内酯、半缩醛(酮)、6-去氧糖苷等结构片段,具有高度的结构相似性。此类化合物表现出多种生物活性,如抗癌、免疫抑制、抗炎、抗病毒、抗菌等。其中,抗菌活性表现比较突出,对多种耐药菌具有较强的抗菌活性[11-13]。吸水链霉菌是它们的产生菌之一。本文首次从吸水链霉菌LP-93中分离到的11,11′-O-二甲基-14′-去乙基-14′-甲基-洋橄榄叶素,对包括甲氧西林耐药金黄色葡萄球菌(MRSA)、耐万古霉素粪肠球菌 (VRE)在内的多种耐药菌的MIC值均在64μg/ml以下[11],并且具有较强的抗结核杆菌活性,为此菌在生物农药、抗菌药物开发等方面的应用,奠定了一定基础。

