血清标志物孕酮、β-HCG、E2和INHA在孕6周异位妊娠诊断中的价值
孙秋瑾,杨现春,张欣欣,王 宇,刘晓娟
(北京市朝阳区妇幼保健院检验科,北京 100021)
异位妊娠是妇产科常见的急腹症之一,当异位妊娠破裂或流产后,可造成急性腹腔内出血,甚至危及患者生命。近二十年来,世界各国异位妊娠的发病率呈显著上升趋势,这引起了妇产科医生们对异位妊娠诊治的高度关注。提高异位妊娠的诊断技术可以减少误诊率及漏诊率,为早期安全治疗及保留输卵管再生育功能创造有利的条件。同时,随着辅助生殖技术的开展,原来少见的病例,如同侧或双侧输卵管多胎妊娠、宫内宫外同时妊娠也常有发生。目前,异位妊娠的诊断除依靠病史、临床表现外,主要依靠超声和实验室血清β人绒毛膜促性腺激素(β-HCG)动态监测来诊断。但是在妊娠早期孕6周左右,异位妊娠患者β-HCG的水平较低,通过超声检查不能完全确定妊娠部位,而且妊娠6周内超声检查难以见到胚芽。部分患者(8%~22%)出现蜕膜管型与血液形成的假妊娠囊现象,此时超声诊断易与宫内妊娠囊相混淆,这些都易造成异位妊娠漏诊和误诊。因此,在异位妊娠的早期诊断中,超声的应用存在一定局限性,对18%临床病例无法明确诊断[1]。此时,血清相关标志物的检测成为了诊断异位妊娠的较好方法。一般认为异位妊娠时β-HCG的倍增时间延长为3~8 d(正常早期妊娠β-HCG的倍增时间为1.4~2 d)。但临床仍有许多不典型情况出现,导致早期诊断延迟。联合其他血清标志物共同检测有助于提高异位妊娠孕6周左右时的诊断效能。为筛选出联合检测标志物并评估这些标志物用于联合诊断的灵敏度和特异度,本课题组进行了如下研究。
1 资料与方法
1.1一般资料 将本院2018年8-10月经临床检查及妊娠结局证实为异位妊娠的患者68例纳入研究作为异位妊娠组;将同期宫内妊娠流产者其病理检查结果为检出滋养细胞或绒毛组织的100例纳入研究作为宫内妊娠流产组;将同期经超声确认为正常宫内妊娠的100例作为对照组。纳入研究之前均经患者知情同意,本研究通过了医院伦理委员会批准。排除标准:(1)患者之前服用过雌、孕激素类等药物;(2)多胎妊娠;(3)恶性肿瘤性疾病患者;(4)疑似为异位妊娠时已经行药物治疗者。3组患者年龄分别为(30.10±5.51)岁、(29.49±4.48)岁、(29.11±4.32)岁;停经天数分别为(43.75±5.33)d、(42.16±5.01)d、(42.98±5.15)d;月经周期分别为(27.1±4.1)d、(27.0±4.4)d、(26.9±4.6)d。对以上3组的年龄、停经天数、月经周期进行两两比较,差异均无统计学意义(P>0.05)。
1.2方法
1.2.1标本采集 对上述纳入研究者(异位妊娠组于治疗前采集标本)使用带隔离胶的Vacuette真空静脉采血管采集血液5 mL;采集得到的标本需要在30 min内及时、尽早离心(离心力1 500×g,离心10 min,避免纤维蛋白原干扰);离心后,取上层血清2 mL左右存放于低温冻存管中-80 ℃保存,剩余血液进行β-HCG和孕酮的检测。
1.2.2仪器与试剂 罗氏全自动电化学发光免疫分析仪E602检测孕酮、β-HCG、游离β-HCG(F-β-HCG)、妊娠相关血浆蛋白A(PAPP-A);东曹全自动化学发光免疫分析仪AIA2000检测雌二醇(E2)、糖类抗原125(CA125)、甲胎蛋白(AFP);贝克曼全自动化学发光免疫分析仪DXI800检测抑制素A(INHA)。孕酮、β-HCG、 F-β-HCG、PAPP-A的检测使用德国罗氏公司生产的配套试剂、质控品、校准品;E2、CA125、AFP的检测使用日本东曹公司生产的配套试剂、质控品、校准品;INHA的检测使用美国贝克曼公司生产的配套试剂、质控品、校准品。
1.2.3方法 对于纳入研究者,抽血当天进行β-HCG和孕酮的检测;其他6项血清标志物于2018年10月27-28日将收集完的3组血标本从-80 ℃冰箱中分别复融后,进行F-β-HCG、PAPP-A、E2、CA125、AFP和INHA 6项标志物的检测。各项目检测前项目校准和室内质控均通过。
1.3统计学处理 采用SPSS19.0进行统计学分析,采用中位数(M)和四分位数间距(P25~P75)来表述异位妊娠相关的8种血清标志物的水平;3组间的比较采用非参数(Mann-WhitneyU和WilcoxonW)秩和检验;使用受试者工作特征曲线(ROC曲线)评估各血清标志物及联合检测的诊断效能(截断值、灵敏度和特异度),评估各血清标志物及联合检测在异位妊娠早期诊断中的价值。
2 结 果
2.13组人群8项血清标志物水平比较 除PAPP-A和AFP外,其他标志物均出现中位数水平在异位妊娠组、宫内妊娠流产组、对照组中依次升高的现象,见表1。异位妊娠组与对照组比较,8项血清标志物水平差异均有统计学意义(P<0.05);宫内妊娠流产组与对照组比较,只有孕酮和E2水平差异有统计学意义(P<0.05),其他标志物水平差异均无统计学意义(P>0.05);宫内妊娠流产组与异位妊娠组比较,8项标志物水平差异均有统计学意义(P<0.05)。见表2。
2.28项血清标志物单项检测在异位妊娠和宫内妊娠流产诊断中的效能评价 比较8项血清标志物ROC曲线的曲线下面积(AUC),发现在异位妊娠诊断中的诊断价值由高到低依次为孕酮、E2、INHA、β-HCG、F-β-HCG、PAPP-A、CA125、AFP,各标志物的截断值、灵敏度和特异度见表3、图1;在宫内妊娠流产诊断中的诊断价值由高到低依次为孕酮、E2、INHA、β-HCG、F-β-HCG、CA125、AFP、PAPP-A,各标志物的截断值、灵敏度和特异度见表4。
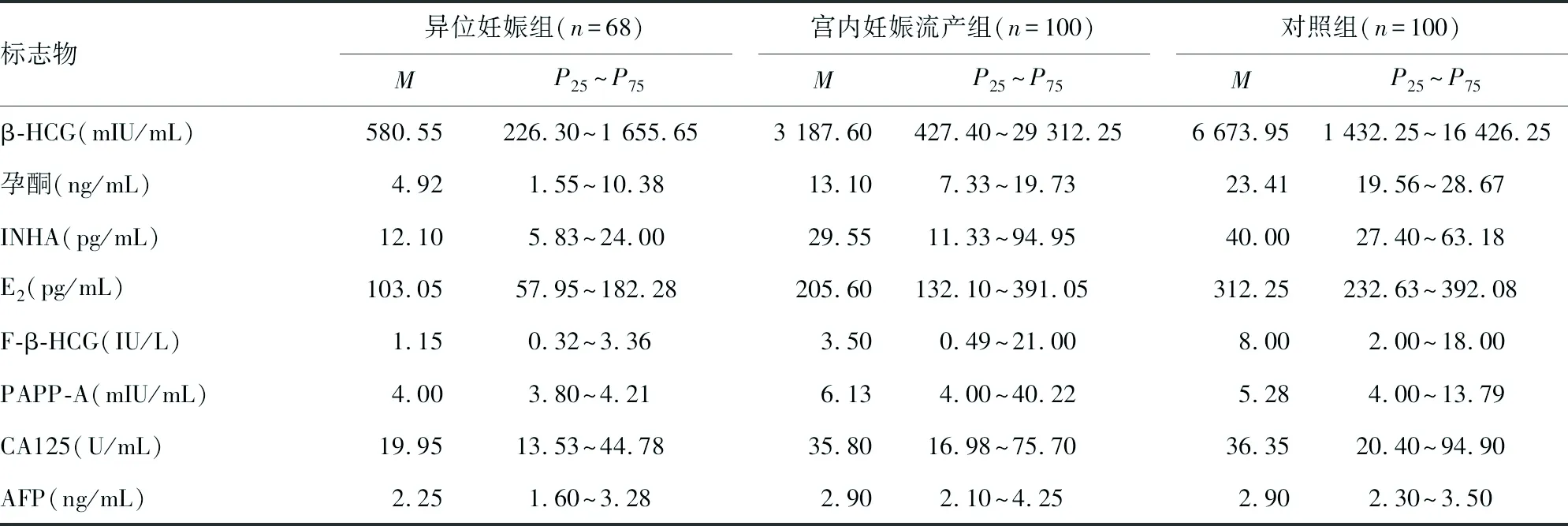
表1 3组间8项血清标志物水平比较
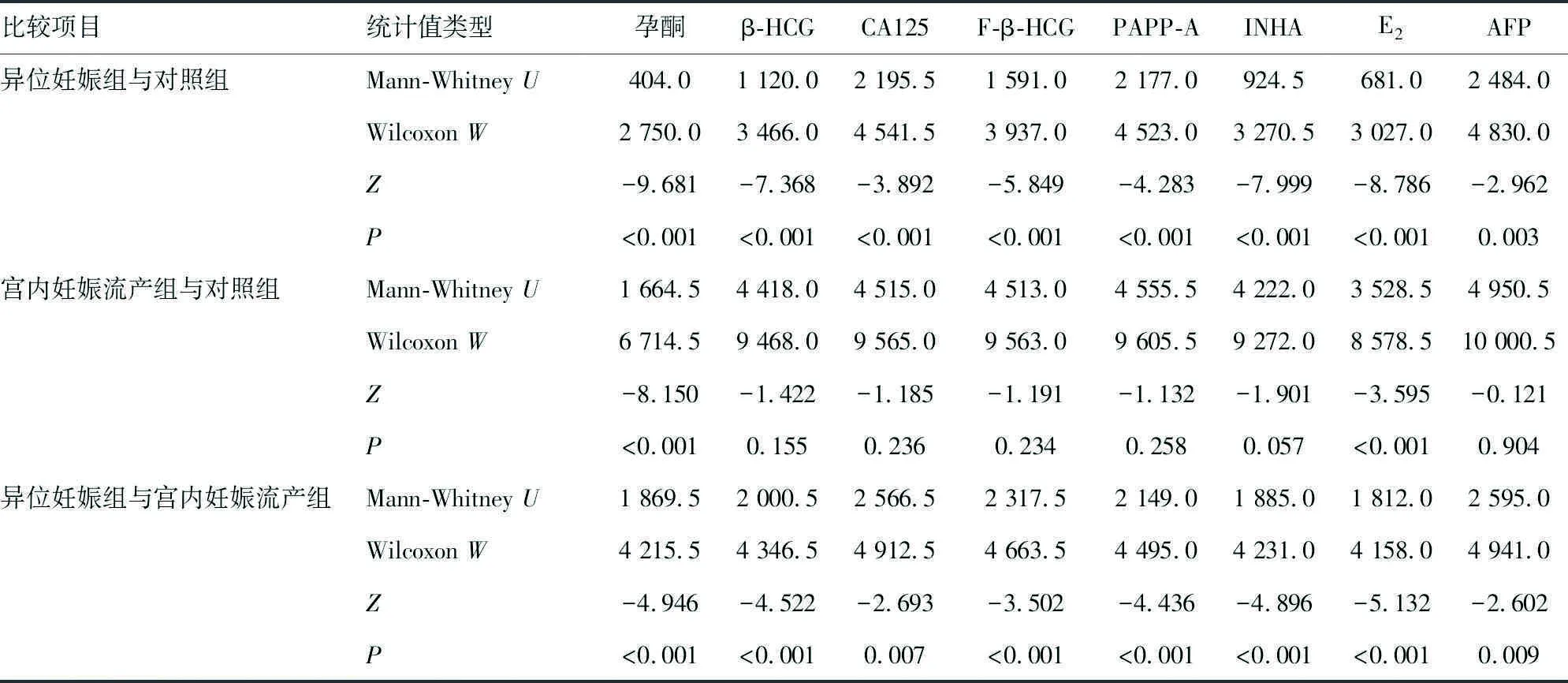
表2 3组间8项血清标志物水平的两两比较

表3 8项血清标志物在异位妊娠诊断中的效能
2.3多项血清标志物联合检测诊断异位妊娠的ROC曲线 血清标志物对异位妊娠的诊断效能作Logistic回归后,得出4项血清标志物(孕酮、β-HCG、E2、INHA)联合诊断异位妊娠的ROC曲线:综合4项标志物的灵敏度为86.8%,特异度为98.0%,AUC=0.970(P<0.001,95%CI:0.945~0.995)。ROC曲线见图2。
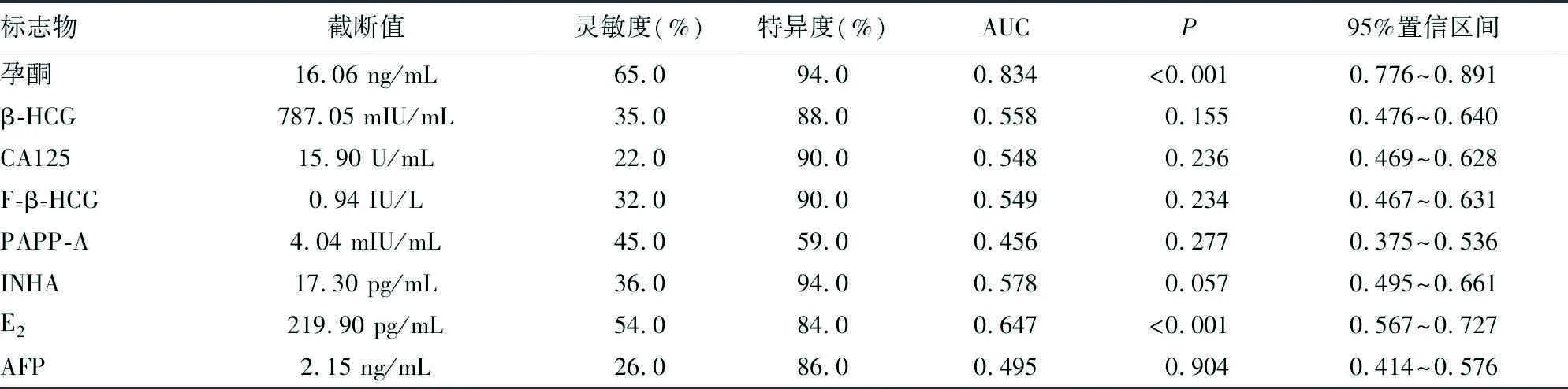
表4 8项血清标志物在宫内妊娠流产诊断中的效能

图1 异位妊娠诊断中8项血清标志物的ROC曲线汇总图
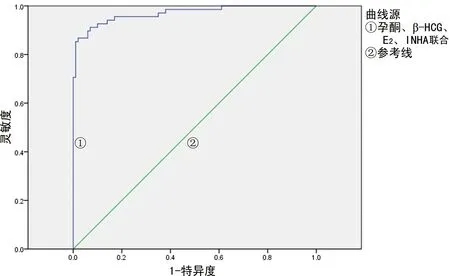
图2 孕酮、β-HCG、E2、INHA联合检测用于诊断异位妊娠的ROC曲线
3 讨 论
异位妊娠是妇产科常见的急腹症之一,世界各国异位妊娠的发病率呈明显上升趋势[2]。异位妊娠发病除了有输卵管病变、受精卵经过输卵管受阻等原因之外,还与辅助生殖技术的大规模开展有着密切的关系,原本少见的同侧或双侧输卵管多胎妊娠,宫内宫外同时妊娠目前也时有发生。
异位妊娠的部位主要包括输卵管、卵巢、宫颈、腹腔、阔韧带、子宫残角等。其中输卵管妊娠占所有异位妊娠的95%。输卵管由于管腔十分狭小,肌层薄,缺乏黏膜下组织,妊娠时不能形成完好的蜕膜。同时,血供不足,滋养细胞数量相对较少,氧合程度不佳。由此会造成滋养细胞合成的系列激素水平受到严重影响,出现降低的现象(如β-HCG、F-β-HCG、孕酮、E2、INHA、PAPP-A等)。这些因素,是造成异位妊娠胚胎发育不良、卵巢黄体功能减弱的病理基础。
与异位妊娠早期诊断相关的血清标志物有多种,近年来文献报道多集中在β-HCG、孕酮、CA125、PAPP-A、血管内皮生长因子(VEGF)、激活素(ACT)、抑制素(INH)等[3]。β-HCG和孕酮联合检测已经得到了国内、外学者的广泛认同,类似的报道较多[4-5];英国国立健康与临床优化研究所(NICE)出版的《对异位妊娠和流产的诊断和初始管理》[6]临床指南中,推荐将β-HCG 0~48 h动态变化与孕酮联合检测用于异位妊娠诊断。但是由于异位妊娠早期(妊娠6周之内)仍有大量β-HCG及孕酮变化不典型情况的出现,而且单纯依靠这两种血清标志物无法更好地鉴别宫内妊娠流产与异位妊娠。此时通过超声检查难以见到胚芽,不能完全确定妊娠部位,患者纠结于妊娠的结局是什么,医生纠结于要求患者住院观察还是回家随访。
目前,多种有价值的血清标志物在自动化检验平台上准确、快速地检测得以日益普及,这为联合多种标志物检测,提高异位妊娠早期诊断效能提供了可能。本研究还涉及了E2、INHA、F-β-HCG、PAPP-A、CA125、AFP等血清标志物。考虑到VEGF的检测,国内能够采购的试剂盒为酶联免疫法,不适用于急腹症的常规快速筛查,因此没有被纳入本研究的范畴之内。国内学者一般选择包括β-HCG和孕酮在内的3项或4项血清标志物作为研究对象[7-8],在同一研究中涉及8项标志物还是少见的。本研究进行了大量的检测与数据分析,得出对异位妊娠的诊断价值由高到低的标志物依次为:孕酮、E2、INHA、β-HCG、F-β-HCG、PAPP-A、CA125、AFP,通过Logistic回归得出效能较高的前4项血清标志物(孕酮、β-HCG、E2、INHA)联合诊断的灵敏度可达到86.8%;特异度可达到98.0%。
本研究中显示,孕酮对异位妊娠的诊断效能最高,异位妊娠组孕酮的水平明显低于对照组,与国内金萍[9]和程琳等[10]的报道相同。因此孕酮水平可以作为异位妊娠早期诊断的良好指标之一。只因为低水平的孕酮不能鉴别是早期流产还是异位妊娠,因此其不能作为独立的诊断指标。E2主要由卵巢分泌,可促使输卵管黏膜上皮细胞的分泌活动增加,加快纤毛生长,促进受精卵经过输卵管运送到子宫腔。当E2水平下降时,导致受精卵停留输卵管时间过长,增加了输卵管着床的概率,E2还可以促使胎盘和黄体共同合成孕激素[11-13]。E2的监测对于不良妊娠结局(先兆流产和异位妊娠)的预测有重要价值,叶菁华等[14]的研究中发现E2是比β-HCG和孕酮更敏感的指标。E2在本研究中预测异位妊娠的诊断效能:灵敏度83.8%,特异度84.0%,AUC为0.900,诊断效能仅次于孕酮。INHA是妊娠期间胎盘和胎儿生长发育的重要激素[15],属于转化生长因子β超家族中一员,可抑制FSH释放,促进E2的合成,在早期胚胎形成和性腺发育中起作用。异位妊娠时由于滋养层细胞发育不良,胎盘功能不足,使INHA分泌明显减少。SEGAL等[16]发现异位妊娠与正常妊娠产生的INHA相比,水平明显降低,和本研究的结果相同。在卢慧等[17]的研究中血清INHA诊断异位妊娠的截断值为16.50 pg/mL。该研究的INHA、β-HCG、孕酮、VEGF标志物诊断异位妊娠时,INHA的AUC最大为0.969,认为INHA是比HCG更敏感更能准确评估滋养细胞活力的指标。本研究INHA诊断异位妊娠的截断值为17.25 pg/mL,结果较为接近;诊断效能也是INHA高于HCG,但是低于孕酮,这一点不同于卢慧等[17]的研究。
对4项诊断效能较高的标志物(孕酮、β-HCG、E2、INHA)进行联合检测,明显提升了早期孕6周异位妊娠的诊断效能,ROC曲线AUC=0.970(P<0.001,95%CI=0.945~0.995),特异度为98.0%。4项标志物都可以实现在化学发光或电化学发光检测系统上进行自动化检测,具备准确、快速提供临床结果的能力,而且4联检测费用适宜(小于200元),综合卫生经济效益较高。
4 结 论
异位妊娠早期孕6周之内的诊断中,对于一些不典型的病例,强烈推荐临床采用孕酮、β-HCG、E2和INHA联合检测方案,可以显著提高诊断效能,为异位妊娠早期的治疗创造有利时机,有助于输卵管再生育功能的保留。

