一株植物乳杆菌体内降胆固醇的作用机制
靳 妲 马微微
(1 东北农业大学乳品科学教育部重点实验室 哈尔滨150030 2 黑龙江中医药大学 哈尔滨150040)
他汀类药物是临床上常用的改善高胆固醇血症的药物,然而长期服用他汀类药物可能造成肌肉疼痛、疲劳,还可能提高糖尿病的风险[3-4],因此益生菌疗法走进人们的视野。联合国粮农组织和世界卫生组织将益生菌定义为“当达到一定数量时,对宿主有益的活性微生物”[5]。乳酸菌在人类肠道系统中的代谢和功能性质对人类的健康有很大的益处。有很多研究证明益生菌具有降胆固醇的作用。2009年,Jungae Jeun 等[6]在基因水平上证明了植物乳杆菌具有明显的降胆固醇功效。2016年,Damodharan K 等[7]用瑞士乳杆菌发酵酸乳,在体内和基因水平上证实乳杆菌的降胆固醇作用。
植物乳杆菌KLDS1.0386 分离自中国内蒙古地区传统发酵乳制品,有研究证明KLDS1.0386 具有体外降胆固醇能力、良好的胃肠拮抗性和粘附性[8-9]。本试验通过建立C57BL/6 小鼠高胆固醇模型研究此菌株的降胆固醇能力,利用蛋白免疫印记法测定其对小鼠肝脏胆固醇调节的几个关键基因表达的影响,为开发具有降胆固醇功能的益生菌提供理论依据。
1 材料与方法
1.1 材料与试剂
总胆固醇检测试剂盒、甘油三酯检测试剂盒、高密度脂蛋白检测试剂盒、低密度脂蛋白检测试剂盒,上海科华生物工程股份有限公司;CYP7A1一抗、LDLR 一抗、FXR 一抗、SREBP2 一抗,Santa Cruz;HMGCR 一抗,Abcam;β-actin 一抗,北京博奥森;普伐他汀钠片,第一三共制药有限公司;其它试剂均为国产分析纯。
1.2 设备与仪器
BCN1360 型生物洁净工作台,北京东联哈尔仪器公司;DHP-9082 型电热恒温培养箱,上海一恒科技有限公司;全自动高压灭菌锅HVE-50,HIRAYAMA 公司;超低温冰箱,SANYO 转移脱色摇床,海门其林贝尔仪器制造有限公司;低温离心机,Eppendorf 公 司;UVP 凝 胶 成 像 系 统,Thermo公司;电泳仪,北京六一;半干转膜仪,ATTO 公司;紫外-可见分光光度计,MILTON ROY COMPANY公司;超纯水仪,北京康铭泰克科技发展有限公司;美国UVP 分析仪。
1.3 乳酸菌与培养基
植物乳杆菌KLDS1.0386(Lactobacillus plantarum)由东北农业大学乳品科学教育部重点实验室提供。供试菌株在试验前需进行复苏与纯化,经MRS 液体培养基,37 ℃培养,连续传代3 次以恢复菌种活力用于后续试验。
MRS 培养基:蛋白胨 5.0 g,牛肉膏5.0 g,胰蛋白胨10.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,葡萄糖20.0 g,吐温-80 1.0 g,酵母粉5.0 g,硫酸锰0.25 g,硫酸镁0.58 g,柠檬酸氢二铵2.0 g,用蒸馏水溶解后定容至1 L,在121 ℃条件下高压灭菌15 min。
1.4 试验方法
1.4.1 小鼠的分组与饲养 6 周龄C57BL/6 雄性小鼠购买自北京维通利华实验动物技术有限公司,将40 只小鼠按平均体质量无显著差异随机分成5 组,每组8 只:空白组、高胆固醇模型组、KLDS1.0386 低剂量组、KLDS1.0386 高剂量组、普伐他汀对照组(见表1)。空白组小鼠喂普通基础饲料,其它4 组小鼠喂高胆固醇饲料,培养30 d,建立高胆固醇模型小鼠。饲养温度20~25 ℃,湿度45%~50%,自由采食与饮水,12 h 光-暗循环。
供试样品通过灌胃的方式给予小鼠,将活化好的植物乳杆菌KLDS1.0386 按2%的接种量接种到MRS 液体培养基中,37 ℃培养18 h,经3 000 r/min 离心10 min 获得培养菌株,用无菌生理盐水洗涤2 次,最后用无菌生理盐水重悬调至109,1010CFU/mL,分别作为低剂量组和高剂量组[6]。普伐他汀按小鼠3 mg/kg 体重剂量给药[10]。空白组和高胆固醇模型组以无菌生理盐水代替。各组按照每只小鼠1 mL/100 g 体重的剂量灌胃,每日灌胃1 次,连续灌胃4 周。
激光剥蚀技术(LA)作为一种应用于大部分固体样品的引入方法,与干扰少、灵敏度高的电感耦合等离子体质谱(ICP-MS)联用,可以避免溶液制备中的稀释效应,对降低方法检出限更为有利。该技术仅仅需要极少的样品消耗量,可以实现微区分析和微损分析[1-9]。Christopher L[1]等人用此项技术成功地分析了镁合金表面元素的分布。本文以63Cu的强度稳定且达到最大值为考察依据,对激光剥蚀的实验条件进行优化,确定了最佳仪器参数,并通过计算各杂质元素的相对灵敏度因子(RSF)[10],最终实现了LA-ICP-MS内标定量法对纯铜中Fe、Zn、As、Sn、Sb、Pb、Bi共7种痕量元素的测定。
高胆固醇根据文献[11]改良后自行配制,由北京科澳协力饲料有限公司制造。
基础饲料配方:面粉20%,麸皮25%,玉米20%,米粉10%,豆料20%,鱼粉2%,骨粉2%,食盐0.9%,维生素0.1%。
高胆固醇饲料:胆固醇3%,胆盐0.3%,猪油10%,蛋黄粉5%,基础饲料81.7%。

表1 各组别小鼠饮食情况对照表Table 1 The diet compositions for mice of the different groups
1.4.2 血液采集与血脂检测 小鼠灌胃第28 天取血,小鼠采血前禁食12 h。采取毛细玻璃管眼眶后静脉丛取血方法,室温放置1 h。4 000 r/min 离心5 min,收集血清,采用酶法检测试剂盒利用全自动生化分析仪分别检测小鼠血清总胆固醇、甘油三酯、低密度脂蛋白胆固醇和高密度脂蛋白胆固醇浓度。
1.4.3 Western-blotting 检测 小鼠灌胃第28 天进行解剖取肝脏,肝脏取出后装进无菌冻存管中,迅速放入液氮中防止蛋白降解。选取5 种肝脏胆固醇代谢相关的关键基因作为检测对象,即HMGCR、CYP7A1、LDLR、FXR 和SREBP2。送样至成都杨克斯生物技术有限公司进行Western-blotting 试验,分析供试菌株对肝脏胆固醇代谢的影响。
1.5 数据分析
试验数据均以平均数±标准差来表示,采用SPSS 20.0 软件对试验数据进行统计分析,应用单因素方差分析进行多组数据之间的比较,P<0.05为差异显著,P>0.05 为差异不显著。
2 结果与分析
2.1 血脂分析
小鼠血清胆固醇水平变化直接反应供试菌株的体内降胆固醇效果,分别检测了不同饮食处理组小鼠血清甘油三酯、胆固醇、低密度脂蛋白、高密度脂蛋白浓度,结果如表2所示。
本试验通过采食高胆固醇饲料,30 d 后成功构建出高胆固醇小鼠模型。通过灌胃植物乳杆菌KLDS1.0386,28 d 后,在血清甘油三酯、胆固醇、低密度脂蛋白水平上,与高胆固醇对照组相比,灌胃KLDS1.0386 低剂量组和高剂量组均有所下降,尤其是高剂量组,与高胆固醇对照组相比均属于明显差异(P<0.05),分别下降了23.61%,16.97%和31.11%,高密度脂蛋白水平变化不显著(P>0.05),这与已报道的结果类似。Jungae Jeun 等[6]以C57BL/6 小鼠为模型,每天灌胃浓度为109CFU/mL 活性的植物乳杆菌和1010CFU/mL 失活的植物乳杆菌,维持4 周,结果显示,与对照组相比,小鼠血清低密度脂蛋白胆固醇和甘油三酯水平显著下降42%和32%。丁盼盼等[12]采用一株从羊粪中提取的植物乳杆菌灌胃小鼠,为期30 d,结果显示,与对照组相比,小鼠血清胆固醇、甘油三酯水平分别下降了31.3%和20.44%。
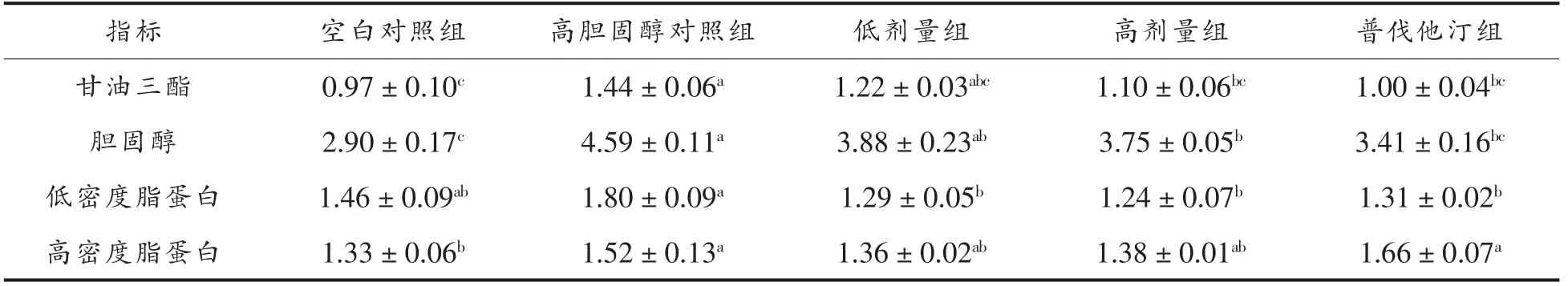
表2 不同饮食处理小鼠血清胆固醇水平Table 2 The cholesterol levels in the serum of mice fed a different diet
2.2 Western-blotting 检测
Western-blotting 检测菌株KLDS1.0386 对高胆固醇模型C57BL/6 小鼠肝脏胆固醇相关代谢基因在蛋白水平表达的影响,如图1所示。

图1 不同饮食处理小鼠肝脏相关蛋白表达的免疫印迹分析Fig.1 Western blot of protein expression in the liver of mice fed a different diet
2.2.1 HMGCR 蛋白表达量水平分析 HMGCR是肝脏胆固醇合成的限速酶,降低HMGCR 的表达可以抑制体内胆固醇水平[13],研究显示,高脂饮食对HMGCR 的表达具有抑制作用,这可能是由于体内胆固醇水平上升过快,而对HMGCR 导致的负反馈调节作用,以防止更多的胆固醇合成。如图2所示,与单纯的进食高胆固醇饲料相比,剂量组小鼠HMGCR 蛋白表达量要更低一些,尤其是高剂量组,明显低于模型组,具有统计学意义(P<0.05),这说明植物乳杆菌KLDS1.0386 可以通过抑制HMGCR 的表达来降低体内胆固醇水平。
2.2.2 SREBP2 蛋白表达量水平分析 SREBP2是SREBPs 家族的成员之一,主要用于胆固醇合成的调节,是HMGCR 和LDLR 的上游基因[14],可促进其表达。如图3所示,与模型组相比,高低剂量组表达并没有明显差异,而Kim 等[15]采用大鼠动物模型,灌胃植物乳杆菌发酵豆乳,结果显示与对照组相比,灌胃豆乳的大鼠的SREBP2 蛋白表达量明显下降,这与本试验结果不符,可能是由于菌种特异性的缘故,KLDS1.0386 可能通过其它途径去调节体内胆固醇水平。

图2 不用饮食处理小鼠肝脏HMGCR 蛋白表达的免疫印迹分析Fig.2 Western blot of HMGCR protein expression in the liver of rats fed a different diet
2.2.3 LDLR 蛋白表达量水平分析 LDLR 是一种细胞表面糖蛋白,大多存在于组织细胞中,其可以将血液中的低密度脂蛋白胆固醇吞进肝细胞中来保持胆固醇平衡,过度的胆固醇则可能抑制LDLR 的表达,而有些降脂药就是通过升高LDLR的表达来完成其作用机制[16]。如图4所示,与模型组相比,高低剂量组小鼠LDLR 表达量有所上升,但差异不显著,这可能与KLDS1.0386 对SREBP2的作用不显著有关,普伐他汀组与其它4 组相比表达量明显增加,由此说明,KLDS1.0386 并不是通过调节LDLR 的表达降低胆固醇水平。
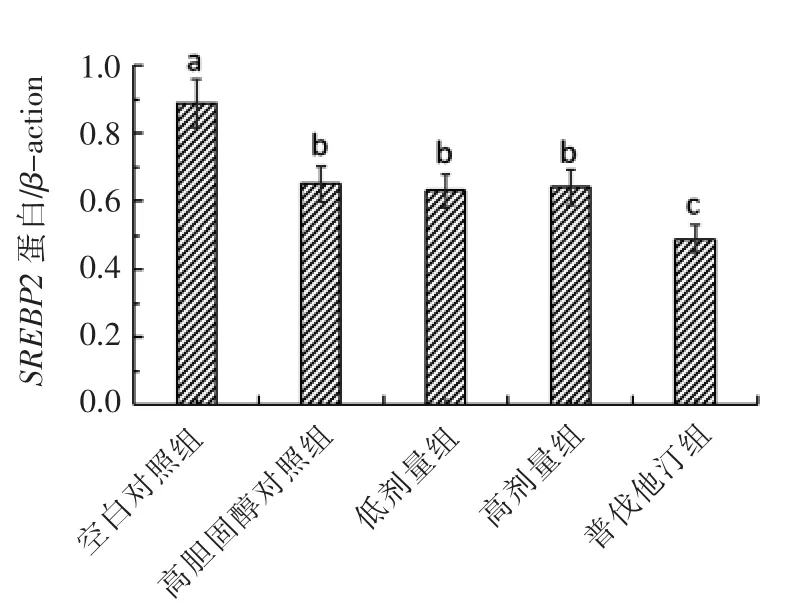
图3 不用饮食处理小鼠肝脏SREBP2 蛋白表达的免疫印迹分析Fig.3 Western blot of SREBP2 protein expression in the liver of rats fed a different diet
2.2.4 CYP7A1 蛋白表达量水平分析 CYP7A1是胆固醇代谢经典途径中的限速酶,其催化胆固醇合成7α-胆固醇,经过一系列酶反应形成胆汁酸,研究显示,CYP7A1 的表达受到抑制会导致胆汁酸合成的下降,从而升高体内胆固醇水平,而食物中的胆固醇和内源性胆固醇都可以提高CYP7A1 的表达[17]。如图5所示,与单纯进食高胆固醇饲料相比,灌胃益生菌的两组小鼠CYP7A1的表达量有所升高,尤其是高剂量组,与模型组形成显著差异 (P<0.05),这说明KLDS1.0386 升高CYP7A1 的表达量,加速了肝脏中胆固醇向胆汁酸的转移,反馈降低体内胆固醇水平。
2.2.5 FXR 蛋白表达量水平分析 FXR 是CYP7A1 的上游基因,FXR 的表达量上升会导致FXR 与胆汁酸结合形成胆汁酸-FXR 复合物,此复合物可以反过来与CYP7A 基因结合抑制其转录,CYP7A 基因负责限速酶CYP7A1 的转录,从而CYP7A1 转录也被抑制,导致胆固醇合成胆汁酸减少,体内胆固醇水平上升[18]。如图6所示,灌胃KLDS1.0386 后,FXR 的表达量出现下调,尤其是高剂量组,与模型组形成显著差异 (P<0.05),而KLDS1.0386 具有胆盐水解酶活性[8],由此可推测,CYP7A1 表达量的升高可能是由于FXR 表达的抑制导致的,而FXR 表达量的抑制可能是由于KLDS1.0386 产生的胆盐水解酶使体内产生更多游离型胆汁酸,而非游离型胆汁酸减少的缘故。

图5 不用饮食处理小鼠肝脏CYP7A1 蛋白表达的免疫印迹分析Fig.5 Western blot of CYP7A1 protein expression in the liver of rats fed a different diet

图6 不用饮食处理小鼠肝脏FXR 蛋白表达的免疫印迹分析Fig.6 Western blot of FXR protein expression in the liver of rats fed a different diet
3 结论
本试验结果表明植物乳杆菌KLDS1.0386 通过抑制小鼠肝脏HMGCR 蛋白表达与通过下调小鼠肝脏FXR 蛋白的表达激活CYP7A1 的表达,调节体内胆固醇水平,为开发具有降胆固醇特性的益生菌提供了理论基础,为生产降胆固醇发酵乳制品提供了理论依据。

